Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Protección Vegetal
versión impresa ISSN 1010-2752
Rev. Protección Veg. vol.26 no.3 La Habana sep.-dic. 2011
Artículo original
EVALUACIÓN DEL CO-PRODUCTO DE CIKRON-H PARA LA BIODESINFECCIÓN DE SUELOS. EFECTO NEMATICIDA
EVALUATION OF CIKRON-H BY-PRODUCTS FOR SOIL BIODISINFECTION. NEMATICIDAL EFFECTS
Lucila Gómez*, Mayra G. Rodríguez*, R Enrique*, Dainé Hernández-Ochandía*, Yanet Rodríguez**, Adelay Lorenzo***, Luisa Díaz-Viruliche***
*Grupos de Plagas Agrícolas, Centro Nacional de Sanidad Agropecuaria (CENSA), Apartado 10, San José de las Lajas, Mayabeque, Cuba. Correo electrónico: lucila@censa.edu.cu; **Desarrollo y Biotecnología Industrial, Centro Nacional de Sanidad Agropecuaria (CENSA), Apartado 10, San José de las Lajas, Mayabeque, Cuba. ***Faultad de Agronomía. Universidad Agraria de la Habana (UNAH). Carretera de Tapaste y Autopista Nacional, San José de las Lajas, Mayabeque, Cuba
RESUMEN
En el trabajo se evaluó el efecto de la biodesinfección de suelo con subproductos de CIKRON-H sobre Meloidogyne incognita Kofoid y White (Chitwood) raza 2 y poblaciones de nematodos saprobióticos en el suelo. Se observó además, la influencia sobre el desarrollo de Solanum lycopersicum L. var. Campbell-28 y sobre la composición químico-física del suelo. La biodesinfección se realizó en condiciones semicontroladas durante 21 días en macetas de cinco litros de capacidad, utilizando una dosis del co-producto de 7kg.m2 de suelo-1 y un nivel de M. incognita de 5 J2-h.g de suelo-1. Se utilizó un diseño completamente aleatorio con cinco tratamientos y cinco réplicas cada uno. Los suelos infestados con M. incognita sin biodesinfección, así como los no inoculados ni biodesinfectados sirvieron como controles del experimento. Las plantas de tomate se trasfirieron a las macetas después de 72 horas de completado el proceso de biodesinfección. Se demostró que la biodesinfección disminuyó significativamente los juveniles infestivos de M. incognita (>50%) y se incrementaron las poblaciones de nematodos saprobióticos en el suelo, toda vez que el índice de agallamiento en las raíces del cultivo disminuyó de grado 5 a 2. Sin embargo, la composición físico-química del suelo varió y se observó un efecto desfavorable sobre el crecimiento del cultivo.
Palabras clave: Rhyzophora mangle; Meloidogyne incognita; nematodos saprobióticos; Solanum lycopersicum.
ABSTRACT
The effects of soil biodisinfection using CIKRON-H by-product on Meloidogyne incognita Kofoid y White (Chitwood) race 2 and saprophytic nematode populations were evaluated. The influence of the biodisinfection on the growth of Solanum lycopersicum L. var. Campbell-28 and on the soil physic-chemical composition was also observed. The biodisinfection was carried out in potted soil (5L capacity) inoculated with 5 J2-eggs of M. incognita.g-1 soil under semi-controlled conditions during 21 days. CIKRON-H by product was applied in a dose of seven kg. m2 of soil-1 and a completely randomized design with five treatments and five replicates each was used. Nematode infected soils without biodisinfection and non-infected-biodisinfected soils were used as the experiment controls. Tomato plants were transplanted 72 h after the biodisinfection process was completed. The root gall index and infestive juveniles of M. incognita and the total number of saprophytic nematodes in soil were recorded after 60 days of transplanting. The results showed a significant reduction of infestive juveniles of M. incognita in soil (>50%) and in the root gall index (from degree 5 to 2). Saprophytic nematode populations significantly increased compared with the initial population. The soil physic-chemical composition varied and a negative effect on the the crop growth was shown.
Key words: Rhyzophora mangle; Meloidogyne incognita; saprophytic nematodes; Solanum lycopersicum.
INTRODUCCIÓN
Los nematodos del género Meloidogyne Göldi son de gran importancia económica debido a los efectos negativos que ocasionan a la producción agrícola mundial. Las principales medidas para su control son el uso de nematicidas químicos, la rotación de cultivos y el uso de cultivares resistentes, cuando se encuentran disponibles. Los fumigantes, tales como el bromuro de metilo, a pesar de su eficacia y amplio espectro de acción, poseen efectos secundarios negativos por su alta toxicidad, persistencia en el suelo, efectos carcinogénicos, presencia de residuos de bromuro inorgánico en los cultivos y contaminación de las aguas subterráneas (1). Por tales motivos estos productos se han restringido y muchas veces prohibido, teniendo como reto la búsqueda de alternativas que los sustituyan. Entre las medidas seleccionadas por el Comité Técnico de Opciones al Bromuro de Metilo (BMTOC), se encuentran las desinfecciones no químicas de suelo y sustratos, el uso de materia orgánica y la biodesinfección de suelos (2).
El empleo de la biodesinfección ha mostrado una alta eficacia en la disminución de poblaciones de nematodos fitoparásitos del género Meloidogyne (3); contribuye además, al reciclaje de nutrientes y al mantenimiento de la fertilidad de los suelos, mejorando sus propiedades físico-químicas a través de la incorporación de materia orgánica (4). Su uso en la agricultura ha sido de gran utilidad, no sólo como alternativa no química para el manejo de nematodos, sino también evitando la acumulación de residuales de diversas industrias, ayudando a disminuir los problemas de contaminación ambiental (5).
Dentro del Programa Nacional para el Desarrollo y la Generalización de la Medicina Natural y Tradicional del MINSAP, el Centro Nacional de Sanidad Agropecuaria (CENSA), ejecuta una línea de investigación relacionada con el desarrollo de un producto natural derivado de la corteza del mangle rojo (Rhizophora mangle L.).
Durante la obtención del ingrediente farmacéutico activo a partir del mangle rojo, se genera un residual sólido que podría tener potencialidades como biodesinfectante de suelo, debido a su alto contenido de taninos; paralelamente, esta podría ser una vía de gestión para dichos residuales que contribuiría a cerrar el ciclo de producción del fitofármaco. Los objetivos de este trabajo fueron: 1) evaluar el efecto de la biodesinfección con este co-producto sobre Meloidogyne incognita Kofoid y White (Chitwood) y nematodos saprobióticos en el suelo, 2) determinar su influencia sobre el desarrollo de Solanum lycopersicum L. var. Campbell-28 y 3) evaluar su efecto sobre la composición químico-física del suelo.
MATERIALES Y MÉTODOS
El estudio se realizó en los aisladores biológicos del CENSA, utilizando macetas plásticas de 5L de capacidad, contentivas de suelo Ferralítico rojo no estéril, proveniente de las áreas agrícolas de este centro.
La especie de nematodo utilizada fue M. incognita raza 2, procedente del banco de poblaciones puras del laboratorio de Nematología del CENSA y se empleó una suspensión de huevos- larvas (h-J2) que se inoculó al suelo a razón de 5 h-J2.g-1 de suelo.
El co-producto se utilizó a una dosis de 7kg.m2 de suelo-1, de acuerdo a lo recomendado por Díaz-Viruliche (6). El mismo se mezcló vigorosamente con el suelo para lograr la homogeneidad requerida y se aplicó riego hasta la saturación. Posteriormente se cubrió la superficie del suelo de cada maceta con un polietileno transparente por un período de 21 días.
Al término de este tiempo, se retiraron las cubiertas, se removió el suelo con una paleta plástica para favorecer la aireación y se tomaron muestras del suelo tratado. A las 72 horas se trasplantaron plantas de tomate var. Campbell-28, de 21 días de edad, obtenidas en bandejas de polipropileno con alveolos (cepellones).
Se utilizó un diseño completamente aleatorio consistente en cinco tratamientos con cinco réplicas cada uno. Los tratamientos se describen a continuación:
• Tratamiento 1 (T1): el suelo de las macetas fue inoculado con M. incognita homogenizando la suspensión e inmediatamente después se procedió a la aplicación del co-producto para la biodesinfección.
• Tratamiento 2 (T2): el suelo fue tratado con biodesinfección, pero no se inoculó M. incognita.
• Tratamiento 3 (T3): No recibió biodesinfección. La población de M. incognita se inoculó directamente al sistema radical del cultivo al siguiente día después del trasplante.
• Tratamiento 4 (T4): la población de M. incognita se inoculó al suelo al inicio del experimento. El suelo no recibió biodesinfección.
• Tratamiento 5 (T5): control o testigo absoluto, no se inoculó M. incognita ni se aplicó la biodesinfección.
Las evaluaciones se realizaron antes y después de la biodesinfección, y al finalizar el experimento.
Una vez realizado el trasplante, se mantuvieron las macetas en aisladores biológicos durante 60 días, a temperatura ambiente y riego en días alternos. Al término de este tiempo se retiraron las plantas, removiendo cuidadosamente el suelo para extraer completamente el sistema radical y se procedió a la evaluación.
Evaluación antes y después de la biodesinfección:
• Número total de nematodos saprobióticos.gramo de suelo-1. Este análisis se realizó solamente en T1.
• Juveniles infestivos (J2) de M. incognita en suelo. Este análisis se realizó solo en el tratamiento T1.
• Análisis de suelo: Se utilizaron los procedimientos contenidos en la Norma Ramal (7,8) y lo recomendado por Paneque et al. (9,10) determinándose:
• pH H2O: Potenciometría. Relación suelo-disolución: 1:2:5
• Materia Orgánica: Walkley y Black.
• P2O5: Oniani
• Cationes intercambiables: Extracción con NH4AC 1mol-1 a pH 7 y determinación por complexometría (Ca, Mg) y Fotometría de llama (K y Na).
• Contenido de materia orgánica del suelo (% MO) y relación carbono nitrógeno (C/N).
Evaluación al finalizar el experimento:
• Índice de agallamiento en raíces (IA).
• Altura de las plantas (cm).
• Masa fresca de las raíces (g).
Para la extracción de los nematodos saprobióticos y los J2 de M. incognita del suelo, se empleó el método de centrifugación flotación, siguiendo la metodología de Jenkins (11). El conteo de estos organismos se realizó en una cámara contadora con la ayuda de un estereomicroscopio (ZEISS).
El Índice de Agallamiento (IA) en el sistema radical de tomate se determinó a través del conteo de agallas en las raíces y se estableció la gradología mediante la escala de seis grados de Taylor y Sasser (12).
Para el análisis estadístico de los resultados, antes y después de la Biodesinfección, así como entre los tratamientos, se empleó un Análisis de Varianza Simple. Las medias se compararon mediante la Prueba de Rangos Múltiples de Duncan, haciendo uso del paquete de programas SAS.
RESULTADOS Y DISCUSIÓN
Biodesinfección con co-producto de CIKRON-H y su acción sobre poblaciones de nematodos en suelo
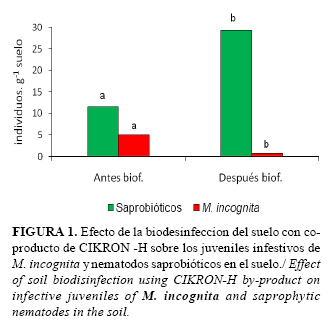
Los resultados obtenidos a partir del análisis nematológico del suelo mostraron diferencias significativas antes y después de la biodesinfección con el residual de CIKRON- H (Fig.1).
Estos resultados están en correspondencia con los obtenidos por otros autores (3). En este aspecto, Matthiessen y Kirkegaard (13) señalaron que durante el proceso de descomposición de la materia orgánica por los microorganismos del suelo, se liberan sustancias volátiles que tienen efecto sobre las poblaciones de nematodos fitoparásitos, toda vez que se incrementan las de organismos benéficos, entre ellos, los nematodos saprobióticos.
La disminución de las poblaciones del nematodo formador de agallas en el suelo parece estar relacionada con la composición química del co-producto empleado, donde se destacan las sustancias fenólicas (14), y se sabe que este tipo de sustancia y los taninos actúan como nematicidas a ciertas concentraciones (15).
En este trabajo no fue posible determinar la composición química de las sustancias que se liberan en el proceso de descomposición del co-producto en el suelo, pero se conoce, a través de los estudios realizados por Sánchez (14), que en el extracto acuoso de la corteza de R. mangle, predominan los polifenoles (54,78 %), representados en su mayoría por taninos poliméricos (80 %) y taninos hidrolizables (20 %), destacándose en estos últimos la presencia de epicatequina, catequina, ácido clorogénico, ácido gálico y ácido elágico, además se encontraron galotaninos y elagitaninos. Residuos de estos productos pueden quedar en el material empleado en la biodesinfección, los que podrían estar involucrados en la disminución de los J2 de M. incognita durante el proceso de descomposición del co-producto en el suelo.
Diversos estudios de la composición química de los manglares, han informado sobre la presencia de compuestos como taninos, alcaloides y polifenoles, los cuales tienen efecto antimicrobiano (16). Otras plantas, como Avicennia marina (Forsk) Vierh, liberan compuestos fenólicos como los taninos, y limonoides como la azaridactina, que son tóxicos para M. incognita y Meloidogyne arenaria (Neal) Chitwood; estos son derivados del proceso de descomposición en el suelo de amonios, nitratos y sulfatos de hidrógeno (17).
La aplicación de la biodesinfección con el co-producto tuvo un efecto favorable para el crecimiento de las poblaciones de nematodos saprobiótios, desde 11 a 28 individuos por gramo de suelo tratado, lo que sin dudas, redunda en mejoramiento de la salud del suelo y la nutrición de las plantas. Los nematodos tienen una función primordial en la descomposición de la materia orgánica y en la mineralización de los nutrientes de las plantas y contribuyen de manera importante al paso de energía desde los descomponedores primarios de materia orgánica a los grupos tróficos superiores (18). La descomposición primaria de la materia orgánica es efectuada por hongos y bacterias, de los cuales se alimentan los nematodos saprobióticos.
No obstante, se debe enfatizar que el ciclo de los nutrientes es un proceso complejo que involucra, además de los nematodos, a un gran número de grupos y especies de la microflora y microfauna del suelo, los cuales no fueron determinados en este trabajo.
Biodesinfección con co-productos de CIKRON-H y su acción sobre la composición físico-química del suelo
Los resultados del análisis químico del suelo antes y después de la biodesinfección evidenciaron variaciones en la composición físico-química del mismo (Tabla 1). El contenido de MO, N, C, Na y Mg aumentó ligeramente, en tanto que el P disminuyó en pequeñas proporciones y el K se redujo a la mitad de su contenido inicial. El Ca se mantuvo sin variaciones aparentes y el pH en niveles alcalinos.
El uso de la biodesinfección produce variaciones físico-químicas en el suelo (19), señalando Bello et al. (15) que el aporte de nutrientes depende de múltiples factores, entre ellos, la naturaleza del material orgánico, dosis de aplicación, duración del proceso y las características físico-químicas del suelo. Sin embargo, de manera general, los diversos materiales empleados, elevan o mantienen en proporciones aceptables el contenido de materia orgánica después de su aplicación (20), aspecto que se evidenció en este trabajo.
El pH, se mantuvo en el rango alcalino, óptimo para que exista una adecuada actividad biológica. Estas condiciones favorecen la liberación y estabilidad del amonio en la atmósfera del suelo ya que existe gran cantidad de amonio libre en el agua (21).
La disminución del contenido de potasio pudo deberse a su utilización en las reacciones enzimáticas llevadas a cabo por microorganismos del suelo para la síntesis de compuestos energéticos durante la descomposición de la materia orgánica. En este caso, el material orgánico empleado presenta un alto contenido de lignina, lo cual requiere de un mayor gasto energético de los microorganismos y, por ello, el proceso de mineralización es más lento.
Según Nelson (21), los materiales orgánicos procedentes de tallos, compuestos por largas cadenas carbonadas, como por ejemplo la corteza del mangle, con altos contenidos de lignina, demoran más tiempo en ser descompuestos por los microorganismos del suelo, que los de cadenas más cortas presentes en las hojas.
La relación C/N, disminuyó por debajo del rango óptimo (14-20). En este sentido, planteó Stirling (22) que en suelos con relación C/N por debajo de este rango, se mantiene la actividad nematicida, pero puede causar toxicidad a las plantas.
Biodesinfección con co-producto de CIKRON-H y su acción sobre las plantas
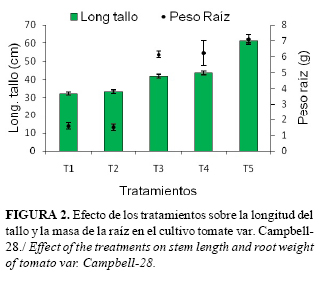
En los tratamientos donde se aplicó la biodesinfección, la masa de las raíces mostró correspondencia con el tamaño de las plantas, alcanzando estos los valores más bajos, sin diferencias significativas entre ellos, pero sí con el resto de los tratamientos. Al finalizar el experimento se pudo apreciar la influencia negativa que tuvo la biodesinfección del suelo sobre el cultivo, de manera integral (Fig. 2).
Las plantas mostraron síntomas foliares de deficiencias de potasio, donde las hojas exhibieron coloración parda, concentrada cerca de la periferia y el ápice. Fundora et al. (23), plantearon que cuando estos síntomas aparecen, es señal de que el potasio es un factor fuertemente limitante en los cultivos y son consecuencia de la concentraciones de compuestos tóxicos en las plantas deficitarias de potasio.
El contenido de Carbono aumentó ligeramente después de la biodesinfección, pero al parecer, el nivel de Carbono no se encuentra en forma fácilmente disponible para que el Nitrógeno sea utilizado por los microorganismos del suelo y sea convertido en proteínas y otros compuestos nitrogenados. Al respecto, señaló Stirling (22), que en ausencia de fuentes carbonadas fácilmente disponibles, el amonio y el nitrato pueden acumularse y causar fitotoxicidad.
En los tratamientos inoculados con nematodos sin biodesinfección (T3 y T4), las plantas alcanzaron un crecimiento intermedio, sin diferencias significativas entre ellos pero si con el resto de los tratamientos, destacándose el tratamiento control absoluto (T5) donde el crecimiento de las plantas fue mayor, con diferencias significativas con los demás tratamientos.
En este estudio se evidenció que el cultivo empleado, tomate Campbell 28, es intolerante a M. incognita, aspecto que fue informado por otros investigadores (24). La acción de los fitonematodos sobre un cultivo intolerante afecta su normal crecimiento y desarrollo (25).
Los mayores valores en la masa de las raíces se registraron en los tratamientos inoculados con nematodos (T3 y T4) y en el tratamiento control (T5), sin diferencias significativas entre ellos. Sin embargo, en T3 y T4 esta masa estuvo influenciada por la presencia de agallas y no al crecimiento normal del sistema radical.
Biodesinfección con co-producto de CIKRON-H y su acción sobre el IA de las plantas
Con respecto al IA del cultivo, se aprecia una marcada disminución del número de agallas en el tratamiento con biodesinfección (T1), difiriendo significativamente con los tratamientos que no recibieron biodesinfección (T3 y T4) (Fig. 3). Por su parte, estos últimos, presentaron diferencias significativas, aun cuando los índices de agallamiento fueron altos (grados 5 y 4, respectivamente).
La disminución del IA en las plantas del tratamiento con biodesinfección podría estar relacionada con dos factores: la baja población de M. incognita a la que se enfrentó el cultivo por la muerte de los J2 en el suelo debido a la acción de la biodesinfección, o a que los fenoles contenidos en el residual y que fueron liberados en el ambiente suelo, interfirieron en la atracción de los J2 hacia las plantas, disminuyendo la penetración de estos en las raíces. Al respecto, Stirling (22), señaló que los materiales con alto contenido de fenoles alteran la atracción de los nematodos hacia las raíces reduciendo los niveles de infestación.
En las plantas inoculadas con nematodos, las agallas se observaron en cadenas, distribuidas a lo largo de las escasas raíces secundarias y abarcando la raíz principal desde la base del tallo. El alto índice de agallamiento (grado 4) alcanzado en las raíces del cultivo en el tratamiento T4, evidencia la capacidad de las larvas de M. incognita de sobrevivir en ausencia del hospedante. Según Wright y Perry (26), las especies de Meloidogyne utilizan la diapausa como una estrategia de supervivencia para superar la ausencia de hospedantes por largos períodos de tiempo, lo que quedó evidenciado por la alta formación de agallas en las raíces.
De manera general, se observó un efecto favorable de la biodesinfección, en la disminución de la población de M. incognita, tanto en el suelo como en el cultivo y en el desarrollo de la fauna de nematodos saprobióticos, aspectos de gran importancia que sientan las bases para ser utilizado de forma promisoria en los programas de manejo agroecológico de plagas.
Sin embargo, es importante tener en cuenta el efecto tóxico que se evidenció sobre el cultivo del tomate y la disminución en el suelo de algunos elementos químicos importantes para el desarrollo de los cultivos. Por lo que, es necesario continuar estudiando las dosis y formas de aplicación del co-producto, con vistas a definir elementos que potencien su acción como mejorador de las condiciones químicas del suelo y para erradicar el efecto fitotóxico, que limita su uso en la producción agrícola.
REFERENCIAS
1. Barrés MT, Bello A, Jordá C, Tello JC. La eliminación del bromuro de metilo en la protección de cultivos como modelo mundial para la conservación del medio ambiente. MAPA, Madrid; 2007. p. 500.
2. Colombo MH, Gauna P, Lenscak MP. Desinfección de suelos por biofumigación. XIII Congreso Latinoamericano de Fitopatología. 19-22 de abril de 2005. Villa Carlos Paz, Córdoba, Argentina. Libro de Resúmenes; 2005. p. 519.
3. Gómez L, Rodríguez MG, Díaz-Viruliche L, González E, Wagner F. Evaluación de materiales orgánicos para la biofumigación en instalaciones de cultivos protegidos para el manejo de Meloidogyne incognita. Rev Protección Veg. 2006;21(3):178-175.
4. Piedra-Buena A, García-Álvarez A, Díez-Rojo MA, Bello A. Use of crop residues for the control of Meloidogyne incognita under laboratory conditions. Pest Manag Sci. 2006;62:919-926.
5. Lazarovits G, Conn KL, Abbasi PA, Tenuta M. Understanding the mode of action of organic soil amendments provides the way for improved management of soilborne plant pathogens. Acta Horticultura. 2005;689:215-224.
6. Díaz-Viruliche L. Alternativas al bromuro de metilo como fumigante del suelo en España. In: R. Labrada, editor. Report on Validated Methyl Bromide Alternatives. FAO, Rome; 2000. p.13.
7. NRAG 837-87. Suelos. Análisis químico. Reglas generales. Ciudad de la Habana, MINAGRI; Cuba; 1987.
8. NRAG. 892-88. Suelos. Análisis químico. Reglas generales. Ciudad de la Habana, MINAGRI; Cuba; 1988.
9. Paneque VM. Abonos orgánicos. Conceptos prácticos para su evaluación y aplicación. Departamento de Biofertilizantes y Nutrición de las Plantas. INCA, La Habana; 1998.
10.Paneque VM, Calaña JM. Manual de técnicas analíticas para suelo, foliar y fertilizantes químicos. INCA, La Habana; 2000. p. 72.
11.Jenkins WR. A rapid centrifugal-flotation technique for separating nematodes from soil. Plant Disease Reporter. 1964; 48:692.
12.Taylor A, Sasser JN. Biology, identification and control of root-knot nematodes (Meloidogyne species). Dept. Pl. Pathol. N. C. State Univ., Raleigh; 1978. p. 111.
13.Matthiessen JN, Kirkegaard JA. Biofumigation and Enhanced biodegradation: Opportunity and Challenge in Soilborne Pest and Disease Management. 2006. (Consultado 24/05/2010). Disponible en: http://www.redorbit.com/news/science/
14.Sánchez L. Composición química y actividad biológica de un extracto acuoso de corteza Rhizophora mangle L. (Tesis). La Habana: Centro Nacional Sanidad Agropecuaria; 1998.
15.Bello A, López-Pérez JA, Sanz R, Escuer M, Herrero J. Biofumigation and organic amendments. Regional Workshop on Methyl Bromide Alternatives for North Africa and Southern European Countries. United Nations Environment Programme (UNEP), Francia; 2000:113-141.
16.Jamale BB, Joshi GV. Effect on age of mineral constituents. Polyphenoloxides and peroxides in mangrove leaves. Int J Exp Biol. 1998;16:117-120.
17.Rich JR, Rali GS, Oppenmann CH, et al. Influence of castor bean (Ricinus communis) lectin (Ricinin) on mortality of Meloidogyne incognita. Nematropica. 1989;19:99-103.
18.Nieminen JK. Modelling the interactions of soil microbes and nematodes. Nematology. 2009;11(4):619-629.
19.Garbeva P, van Veen JA, van Elsas JD. Microbial diversity in soil: selection of microbial populations by plant and soil type and implications for disease suppressiveness. Annu Rev Phytopathol. 2004;42:243-270.
20.Pereyra SM, Ávila AL, Orecchia E. La biofumigación y el metam sodio como alternativas al uso de bromuro de metilo. Efecto sobre el control de malezas y las características químicas del suelo. Agriscientia. 2008;25(2):75-79.
21.Nelson EB. Microbial dynamics and interactions in the spermosphere. Annu Rev Phytopathol. 2004;42:271-309.
22.Stirling GR. Biological control of plant-parasitic nematodes: Progress, problems and prospects. CAB International, Wallingford, UK; 1991. p.275.
23.Fundora OH, Arzola NP, Machado J de A. El Potasio y bases agroquímicas para la fertilización potásica. En: Valdivieso AV, editor. Agroquímica. 1ra Edición. Cuba; 1988. p. 129-147.
24.Cook R, Starr JL. Resistant cultivars. En: Perry R, Moens M, editores. Plant Nematology. CABI, UK; 2006. p. 370-389.
25.Gómez L. Diagnóstico de nematodos agalleros y prácticas Agronómicas para el manejo de Meloidogyne incognita en la Producción Protegida de Hortalizas. (Tesis). La Habana: Universidad Agraria de La Habana; 2007. p. 100.
26.Wright DJ, Perry R. Reproduction, physiology and biochemistry. En: Perry R, Moens M. editores. Plant Nematology. CABI, UK; 2006. p. 187-209.
(Recibido 26-11-2010; Aceptado 6-7-2011)