Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Protección Vegetal
versión impresa ISSN 1010-2752
Rev. Protección Veg. vol.27 no.2 La Habana mayo-ago. 2012
ARTÍCULO ORIGINAL
Ciclo de vida y reproducción de Heliothis virescens (F.) (Lepidoptera: Noctuidae) sobre garbanzo
Cycle of life and reproduction of Heliothis virescens (F.) (Lepidoptera: Noctuidae) in chickpea
J.C. PérezI, Moraima SurisII
IUniversidad de Las Tunas. Filial Universitaria Municipal Jesús Menéndez. Calle 21 No 3, El Batey, Chaparra Jesús Menéndez. Las Tunas. Cuba. CP 77300. Correo electrónico: juanpz@ult.edu.cu.
IIGrupo Plagas Agrícolas, Dirección de Protección de Plantas. Centro Nacional de Sanidad Agropecuaria (CENSA). Carretera de Jamaica y Autopista Nacional. Apartado 10, San José de las Lajas, Mayabeque, Cuba. Correo electrónico: msuris@censa.edu.cu.
RESUMEN
Se presentan los resultados de la biología de Heliothis virescens (F.) sobre hojas de garbanzo en condiciones de laboratorio, con temperaturas media de 25,7 ± 2,6°C y 68,1 ± 8,44% de humedad relativa. Los adultos se sexaron y se unieron en parejas. Los huevos se recolectaron diariamente y se separaron por puestas, registrándose el número de huevos en cada puesta por hembra. Al eclosionar los huevos, las larvas se mantuvieron de forma individual en placas Petri hasta concluir este estado. Se confirmaron según las cápsulas cefálicas y las exuvias encontradas seis instares larvales con una duración para hembras de 23,56 días y 22,67 para los machos. La duración del estado de pupa por sexo fue de 9,08 y 8,16 y para el estado adulto 11,75 y 12,20 días como promedio para hembras y machos, respectivamente.
Palabras clave: Heliothis virescens, ciclo de vida, garbanzo, Cicer arietinum.
ABSTRACT
Results of the biology of Heliothis virescens (F.) on chickpea leaves under laboratory conditions with an average of temperature and relative humidity of 25.7 ± 2.6°C and 68.1 ± 8.44% respectively are presented. The sex of the adults was determined and they were united in pairs. The eggs were collected daily and separated by batch; the number of eggs per batch and per female were recorded. After egg hatching, larvae were individually maintained in Petri dishes until the end of this state. According to the cephalic capsules and exuvias found, six larval instars were confirmed with a duration for females and males of 23.56 and 22.67 days respectively.
Key words: Heliothis virescens, cycle of life, chickpea, Cicer arietinum.
INTRODUCCIÓN
El garbanzo (Cicer arietinum L.), producto de alta demanda a nivel mundial por su composición en aminoácidos, que constituye además, una fuente importante de proteínas de la dieta para el consumo humano y animal (1,2,3,4,5,6), se produce un grupo reducido de países (7).
En Cuba, durante la campaña 2003 - 2004 la superficie de siembra superó las 1 000 hectáreas, debido al incremento de su cultivo en la provincia Las Tunas (8), donde se desarrolla el cultivo desde hace más de una década con gran demanda de la población. La siembra de esta leguminosa en el territorio permite un ahorro considerable a la economía por concepto de reducción de importaciones (9).
Entre los principales factores que limitan su producción mundialmente se encuentran las afectaciones ocasionadas por los artrópodos (10). Se informa que por lo menos 55 especies de insectos se alimentan de este cultivo y entre ellas se destacan las larvas de la familia Noctuidae (Lepidoptera) (11). En particular, Heliothis virescens (F.) es reconocida porque sus daños afectan la cantidad y calidad de vainas y granos; sobre todo cuando estos se encuentran en formación, provocando reducción de los rendimientos de hasta el 30% (12).
En el continente americano H. virescens se considera la plaga de mayor incidencia sobre garbanzo (13,14). En Cuba, la refieren como la principal especie que afecta al cultivo (15) en el que provoca porcentajes de daño apreciables en dependencia del cultivar (16).
En el país, son recientes e incompletos los estudios del desarrollo de este lepidóptero sobre el garbanzo (17), por lo que evaluar todas las fases durante su ciclo de vida, así como, el periodo reproductivo sobre esta leguminosa, constituyó el objetivo del presente trabajo.
MATERIALES Y MÉTODOS
Se recolectaron larvas de H. virescens en áreas de garbanzo del cultivar JP 94 ubicadas en la provincia Las Tunas, que fueron trasladadas al Laboratorio de Entomología del Centro Nacional de Sanidad Agropecuaria (CENSA, Mayabeque). Los ejemplares se mantuvieron en placas Petri a temperatura y humedad relativa promedio de 25,7 ± 2,6°C y 68,1 ± 8,44%, respectivamente. Como alimento se suministraron hojas de garbanzo cada 24 horas.
Una vez que emergieron los adultos, se sexaron y se unieron en parejas, las que se colocaron en cilindros de cristal de 15 cm Ø x 36 cm de alto, cubiertos con tela de organza ajustada con banda elástica. En cada cilindro se ubicó un algodón embebido en una solución de miel de abeja y agua como alimento, el cual se sustituyó cada 24 horas. Para facilitar la oviposición se colocó una cinta de papel plegado en forma de acordeón, suspendido desde la parte superior del cilindro.
Al iniciar la oviposición, los huevos se recolectaron diariamente y se separaron por puesta, registrándose el número de huevos por puesta de cada hembra, los que se observaron hasta la eclosión de las larvas, las que se alimentaron con hojas de garbanzo y se mantuvieron de forma individual en placas Petri de iguales dimensiones hasta la emergencia de los adultos.
Las larvas se observaron diariamente, se registró la duración de cada estadio en el momento que ocurrió la muda y se observó la presencia de la exuvia de la cápsula cefálica, las que se midieron con la ayuda del micrómetro ocular a un aumento de 25,6x. Para determinar la relación entre el número de instares y el ancho de la cápsula cefálica se realizó un análisis de regresión según el programa estadístico InfoStat/Profesional Versión 1.1/2002.
Las pupas se mantuvieron separadas en placas Petri, se observaron diariamente y se registró la duración hasta la emergencia de los adultos, los que se sexaron y colocaron en cilindros donde se observaron diariamente hasta su muerte.
Se determinó la duración promedio de los diferentes estados de desarrollo, longevidad según sexo y la duración del periodo reproductivo.
RESULTADOS Y DISCUSIÓN
Los huevos de H. virescens bajo las condiciones en estudio eclosionaron a los 4,59 días, periodo mayor al informado por Méndez (18) sobre tabaco, en condiciones de mayor temperatura y humedad relativa (T: 27,3 a 29,5°C; HR: 71,1 a 88,5%) bajo las cuales los huevos desarrollaron de dos a tres días, influenciados por el efecto de las variables climáticas.
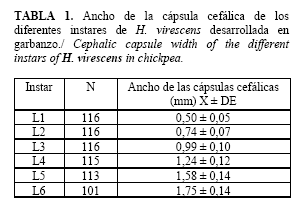
Durante el desarrollo de la larva se observaron seis instares (Tabla 1), lo que se confirmó por las exuvias y cápsulas cefálicas encontradas, resultado que coincide con lo hallado para la especie en tabaco a temperaturas promedio de 27,3 a 29,5°C y de 26°C respectivamente (18,19).
Las cápsulas cefálicas obtenidas exhibieron mayor tamaño que el informado cuando se estudió la especie en tabaco, incluidas dentro del intervalo expresado para el cuarto y quinto instar larval e inferiores a la del sexto (18), lo cual puede deberse a un menor consumo del follaje atendiendo al tamaño de la larva en relación con el de los foliolos. Méndez (20) al evaluar el efecto de diferentes dietas en la longitud y peso de las pupas así como de la fertilidad, encontró valores menores cuando la dieta fue hojas de garbanzo solo.
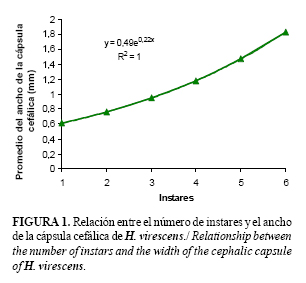
El análisis de regresión mostró una relación, directa y significativa (R2 = 1) (Fig. 1) entre el ancho de la cápsula y el número de instar correspondiente. Esto corrobora, que en instares sucesivos el tamaño de las cápsulas cefálicas aumenta de forma exponencial y permite, con un valor predictivo, estimar el instar al cual pertenece una larva, si se conoce el ancho de la cápsula cefálica.
Las larvas del primer instar presentaron una coloración amarillo claro con cabeza castaño oscuro. Las mediciones de las cápsulas cefálicas por instar (Tabla 1) mostraron valores ligeramente superiores a los encontrados por Méndez (18) al estudiar esta plaga en tabaco.
En los instares sucesivos la coloración de las larvas, fue verde pálido con setas blancas que se insertan en pináculos negros. A partir del cuatro instar la coloración verde se acentúa y comienzan a observarse franjas dorsales y laterales blanquecinas hasta finalizar este estado, lo que coincide con las descripciones de Capinera (21) y Méndez (18) en el cultivo del tabaco. Fichetti et al. (22), señalaron que cuando las larvas se alimentan de hojas de garbanzo el tegumento de las mismas presenta un predominio de colores verdes y cuando lo hacen de frutos la gama de colores se amplía (rosado, amarillento, anaranjado, castaños, entre otros). Al finalizar el último instar larval, estas permanecieron por un tiempo en quietud sin alimentarse, para convertirse en pupas.
El adulto se caracterizó por presentar en las alas anteriores tres bandas oblicuas. En las hembras las alas posteriores presentaron manchas en el margen apical de color oscuro, mientras que en los machos las alas posteriores fueron blancas o verde amarillo.
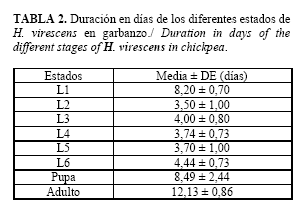
La duración de cada uno de estos estadios fue variable, con mayor extensión del primero, que duplicó la de los restantes (Tabla 2), debido probablemente a que en este periodo se produjeron las temperaturas más bajas durante el estudio (22,3 ± 1,00C).
Estos resultados difieren notablemente de los obtenidos por Álvarez et al. (17) quienes encontraron que al alimentarse la larva sobre hojas de garbanzo, el promedio de desarrollo en cada instar del 1-5 osciló de 2,1-2,8 días y hasta cuatro y 12 días durante el instar seis y siete respectivamente. Variación que pudo deberse a las condiciones bajo las cuales este autor desarrolló trabajos similares y que refiere en los de Mendoza (23), entre 21-28oC.
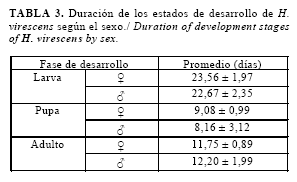
La duración total del estado de larva varió entre hembras y machos, con valores ligeramente superiores en las hembras (Tabla 3).
El periodo para su transformación en pupa fue similar en ambos sexos, con una tendencia a una menor duración en los machos. Autores como Méndez (18) plantearon que el periodo de pupa puede demorar de 10-11 días y Martínez et al. (24) refirieron que puede extenderse de 9-17 días, ambos sobre tabaco, mientras que Álvarez et al. (17), señalaron una duración de 10,8 días en garbanzo ligeramente superior a la determinada en este estudio. Estas diferencias en cuanto al desarrollo de la pupa pueden estar relacionadas con la influencia del alimento o de las condiciones de temperatura bajo las que se determinaron.
El ciclo de desarrollo fue similar para ambos sexos con una duración de 44,50 ± 1,58 para las hembras y de 44,05 ± 3,08 para los machos. Estos valores coinciden con el intervalo obtenido por Martínez et al. (24) para esta especie sobre el cultivo del tabaco aunque resultaron ligeramente superiores a los obtenidos por Álvarez et al. (17) (40,23 días) al considerar ambos sexos sobre garbanzo.
En la proporción sexual se observó una tendencia al predominio de los machos con un cociente sexual de 0,88.
El periodo de pre-oviposición fue de 4,00 ± 0,81 días como promedio, a partir del cual las hembras comenzaron a ovipositar. Mendoza (23) al estudiar este lepidóptero en condiciones de laboratorio sobre tabaco, encontró que el periodo de pre-oviposición fue de tres días. Se diferencia también a la duración de dos días que se cita para la especie en el sureste y noreste de Estados Unidos (21).
El periodo de oviposición duró alrededor de 6,5 ± 3,55 días como promedio pero en algunas hembras este se extendió hasta 12 días. La fecundidad osciló entre 117-554 huevos, con un promedio de 392 ± 207 huevos por hembra, valores que al ser comparados con los ofrecidos por Fye y McAda (25) son inferiores, pues estos autores señalaron que en algodón normalmente una hembra produce de 370 - 1626 huevos, lo que sugiere que la alimentación suministrada influye en este parámetro.
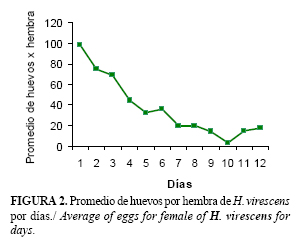
Las puestas ocurren diariamente hasta el término del periodo, con un mayor promedio durante los cuatro primeros días (Fig. 2), momento en el que se alcanzó el 50% del total de huevos, lo que indica que los daños más significativos al cultivo se producen pocos días después de la emergencia del adulto, ya que el otro 50% de los huevos los deposita en menor cantidad en un tiempo más prolongado.
El periodo de post-oviposición fue corto con un valor promedio de 3,50 ± 2,58 días aunque un número reducido de hembras logró alcanzar hasta los seis días.
La longevidad de los adultos para las hembras fue de unos 11,75 días y para los machos de 12,20 días. Resultados variables se encontraron en la literatura en relación con este parámetro que van desde los ocho hasta los 15 días de duración con una disminución de la longevidad entre los 25 y 27oC y un alargamiento de la vida del adulto sobre los 30oC (18, 21).
El ciclo de vida de la especie fue de 44,50 ± 1,58 como promedio para hembras y 44,05 ± 3,80 días para los machos. Esta especie puede desarrollar aproximadamente dos generaciones durante el ciclo del cultivo, lo que le permite incrementar sus poblaciones y ocasionar severos daños en el rendimiento debido al consumo que hace de la vaina.
Los datos obtenidos permiten completar el conocimiento acerca de la biología de esta especie sobre garbanzo en el país y proporcionan información más precisa para la continuación de los estudios ecológicos, con el objetivo de coadyuvar a perfeccionar su estrategia de manejo en un cultivo de significativa importancia para la alimentación de la población.
REFERENCIAS
1. Kantar F, Hafeez FY, Shivkumar BG, Sundaram SP, Tejera NA, Aslam A, et al. Chickpea: Rhizobium management and nitrogen fixation. In: Yadav SS, Redden R, Chen W, Sharma B, (editors). Chickpea Breeding and Management, 2007 pp. 179-192. CAB International.
2. Yousefiara M, Bagheri A, Moshtaghi N. Optimizing Regeneration in Chickpea (Cicer arietinum). Pakistan J Of Biological Sci. 2008;11(7):1009-1014.
3. Singh A, Kumar SI, Kumar VP. Differential transcript accumulation in Cicer arietinum L. in response to a chewing insect Helicoverpa armigera and defence regulators correlate with reduced insect performance. J Exp Botany. 2008;59(9):2379-2392.
4. Falcón J. Productos en General Garbanzos. 2007. Consultada 11 dic 2011. Disponible en: http://argentina-cereales.com/garbanzos.htm.
5. Ochoa-Lugo MI, Heiras-Palazuelos MJ, Milán-Carrillo J, Garzón-Tiznado J, Reyes-Moreno C. Propiedades Tecnológicas y Composición Química de Genotipos de Garbanzo Pigmentado tipo Desi. En: VII Congreso del Noroeste y III Nacional de Ciencias Alimentarias y Biotecnología. Universidad de Sonora. 2010. CLO-35.
6. Astigarraga SM. El garbanzo, una leguminosa nutritiva y barata, ¡producida en México! 2011. [Consultada: 4 de dic 2011]. Disponible en: http://www.fitness.com.mx/alimenta060.htm.
7. Dibut B, Shagarodsky T, Martínez R, Ortega Marisel, Ríos Yoania, Fey L. Biofertilización del garbanzo (Cicer arietinum L.) con Mesorhizobium cicerii cultivado sobre suelo Ferralítico Rojo. Cultivos Tropicales. 2005;26(1):5-9.
8. Shagarodsky T, Chiang María L, Cabrera Melba, Chaveco O, López MR, Dibut B, et al. Manual de instrucciones técnicas para el cultivo del garbanzo (Cicer arietinum L) en las condiciones de Cuba. INIFAT-ETIAH MINAG. 2004. pp. 1-2.
9. Labrada DR. Desarrollan el cultivo de garbanzo en Las Tunas. Consultada: 17 mar 2010. Disponible en: http://lacuaba.blogia.com/temas/agricultura.php.
10.Avalos S, Mazzuferi V, Fichetti P, Berta C, Carreras J. Entomofauna asociada a garbanzo en el noroeste de Córdoba (Argentina). Ho Arg. 2010;29(70).
11.Reed W, Cardona C, Sithanantham S, Lateef SS. Chickpea insect pests and their control. In: Ed. by Saxena MC, Singh KB. The chickpea. 1987. 283-318.
12.Anónimo. Heliothis virescens (Fabricius). 2010. Consultada: 9 abri 2010. Disponible en: http://www.bioagro.com.co/joomla/index.php?Option=com.
13.Blanco CA, Terán-Vargas AP, López JD, Kauffman JV, Wei X. Densities of Heliothis virescens and Helicoverpa zea (Lepidoptera: Noctuidae) in three plant hosts. Fla Entomol. 2007;90:742-750.
14.Sharma HC, Gowda CLL, Stevenson PC, Ridsdill-Smith TJ, Clement GV, Ranga Rao GV, et al. Host plant resistance and insect pest management in chickpea. In: Yadav SS, Redden RR, Chen W, Sharma B. (editors). Chickpea Breeding and Management. CAB International, Wallingford, United Kingdom. 2007; pp. 520-537.
15.Chiang ML, Cruz B, Shagarodsky T. Entomofauna del garbazo en Cuba. Rev Cocuyo. 1999;8:21-22.
16.Shagarodsky T, Chiang ML, López Y. Evaluación de cultivares de garbanzo (Cicer arietinum L.) en Cuba. Agronomía Mesoamericana. 2001;12(001):95-98.
17.Álvarez U, Pérez L, González M, Cruz A, Gómez J, Álvarez JM. Biología de Heliothis virescens (Fabricius) en garbanzo (Cicer arietinum L.). Centro Agrícola. 2010;37(3):89-92.
18.Méndez BA. Aspectos biológicos sobre Heliothis virescens (Fabricius) (Lepidoptera: Noctuidae) en la Empresa Municipal Agropecuaria Antonio Guiteras de la zona norte de la provincia de Las Tunas. Rev Fitosanidad. 2003;7(3):21-25.
19.Piedra F, Molliner M. Consumo de alimento de Heliothis virescens (F.) en el cultivo del tabaco en condiciones de laboratorio. Rev Fitosanidad. 1999;3(4):23-26.
20.Méndez BA. Influencia alimentaria en la fertilidad de Heliothis virescens (Fab.) (Lepidoptera: Noctuidae) en condiciones artificiales. Rev Innovación Tecnológica. 2009;15(3).
21.Capinera JL. Tobacco Budworm, Heliothis virescens (Fabricius) (Insecta: Lepidoptera: Noctuidae). 2009. Consultada: 13 feb 2011. Disponible en: http://www.edis.ifas.ufl.edu/in376.
22.Fichetti P, Avalos S, Mazzuferi V, Carreras J. Lepidópteros asociados al cultivo del garbanzo (Cicer arietinum L.) en Córdoba (Argentina). Boletín San Veg Plagas. 2009;35:49-58.
23.Mendoza HF. Estudio en el laboratorio del ciclo biológico de Heliothis virescens (F.) (Lepidoptera: Noctuidae) bajo condiciones no controladas. Centro Agrícola. 1977;4(3):79-84.
24.Martínez E, Novo PJM, Hernández HF. Ciclo biológico del Heliothis virescens Fabricius (Lepidoptera: Noctuidae) en condiciones de laboratorio no controladas. Centro Agrícola. 1984;11(2):39-45.
25.Fye RE, McAda WC. Laboratory studies on the development, longevity, and fecundity of six lepidopterous pest of cotton in Arizona. USDA Tech Bull. 1972;1454-1473.
Recibido: 1-3-2011.
Aceptado: 4-4-2012.