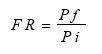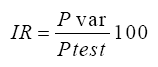Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Protección Vegetal
versión impresa ISSN 1010-2752
Rev. Protección Veg. vol.27 no.2 La Habana mayo-ago. 2012
ARTÍCULO ORIGINAL
Susceptibilidad de genotipos de Solanum lycopersicum L. frente a Meloidogyne incognita Kofoid y White (Chitwood)1
Susceptibility of Solanum lycopersicum L. genotypes against Meloidogyne incognita Kofoid & White (Chitwood)
Lucila Gómez, R. Enrique, Dainé Hernández-Ochandía, Ileana Miranda, E. González, Belkis Peteira, Mayra G. Rodríguez
Centro Nacional de Sanidad Agropecuaria (CENSA), Apartado 10, San José de las Lajas, Mayabeque, Cuba. Correo electrónico: lucila@censa.edu.cu.
RESUMEN
Se evaluó la resistencia/susceptibilidad de los genotipos Aro 8484, HA 3063, Caramba y HA 8476 de Solanum lycopersicum L. frente a Meloidogyne incognita Kofoid y White (Chitwood) raza 2 y se determinó la influencia de este nematodo sobre su crecimiento. Se establecieron dos experimentos en condiciones semi-controladas, en macetas de 1,5L de capacidad. En el primero, cada genotipo, incluyendo el control susceptible tomate cv. Campbell-28, se inoculó con 1,5 J2. g de suelo-1. Para la categorización de los genotipos en resistentes/susceptibles se determinó el índice de agallamiento, el factor de reproducción y el índice de reproducción del nematodo. En el segundo experimento los genotipos se inocularon con 0; 0,5; 1,5 y 2,5 J2. g de suelo-1. Los cuatro genotipos con niveles 0 de nematodos constituyeron los controles. Cada experimento contó con 10 réplicas por tratamiento con una distribución aleatoria en casas de vegetación. Se realizó un análisis de regresión lineal para establecer la relación entre los niveles de nematodos y la altura de las plantas. Todos los genotipos fueron susceptibles a M. incognita. Se demostró que entre el 60 y el 94% de la disminución del tamaño de las plantas está relacionado con el aumento de las poblaciones del nematodo. No se recomienda el uso de estos genotipos en instalaciones de producción protegida de hortalizas con suelos infestados por M. incognita, sin antes establecer medidas de manejo que disminuyan las poblaciones por debajo de 0,5 J2.g de suelo-1.
Palabras clave: nematodos formadores de agallas, resistencia, susceptibilidad.
ABSTRACT
The resistance/susceptibility of Solanum lycopersicum L genotypes Aro 8484, HA 3063, Caramba and HA 8476 against Meloidogyne incognita Kofoid and White (Chitwood) race 2 and the influence of the nematode on the genotype growths were evaluated in two experiments under semi-controlled conditions. In the first experiment, the genotypes, including a susceptible control tomato Campbell-28, were inoculated with a level of 1,5 J2. g of soil-1. Root gall index, was reproduction factor and reproduction index of the nematode were determined for categorizing resistant/susceptible genotypes. In the second experiment, three levels of nematodes (0,5; 1,5 and 2,5 J2. g of soil-1) were used. Not inoculated genotypes were established as a control. Both experiments had 10 repetitions and were placed in a green house using a randomized distribution design. A lineal regression analysis was used to establish the relation of nematode levels and the plant growths. All genotypes were susceptible to M. incognita. It was demonstrated that the 60 to 94% of plant growth decrease related to the nematode population increase. The use of genotypes is not recommended in soils infected with M. incognita unless management measures are established for keeping nematode population below 0,5 J2.g of soil-1.
Key words: root-knot nematodes, resistance, susceptibility.
INTRODUCCIÓN
Los nematodos formadores de agallas del género Meloidogyne Göldi, constituyen una seria amenaza en los sistemas de producción intensiva a nivel mundial (1). En la producción protegida de hortalizas en Cuba, la presencia de estos organismos es alarmante, siendo Meloidogyne incognita Kofoid y White (Chitwood) la especie más abundante y distribuida (2,3). El manejo de esta plaga es muy difícil, debido a su amplio rango de hospedantes y la presencia de especies y razas virulentas y agresivas, cohabitando en un mismo cultivo o plantación. Por lo que se hace necesaria la aplicación de diferentes tácticas de manejo para disminuir sus poblaciones en el suelo.
Actualmente uno de los métodos de mayor importancia en el manejo de poblaciones es el empleo de variedades resistentes. Sin embargo, entre las hortalizas cultivadas en sistemas protegidos, es difícil encontrar cultivares resistentes que puedan ser utilizados en los esquemas de manejo. De ahí que el uso continuado de cultivares susceptible ha traído como consecuencias el acortamiento del período de vida útil de las plantaciones, la depauperación antes de completar los 140 a 180 días, y mermas considerables en los rendimientos (4).
La mayoría de los genotipos que se utilizan en estos sistemas son híbridos importados, con genes de resistencia a Meloidogyne spp. (gen Mi), pero su uso intensivo, generalmente sin la aplicación de medidas de manejo, ha mostrado desaciertos frente a la variabilidad patogénica de las especies de esta plaga. En Cuba se realizan numerosos estudios para conocer la cuantía en que estos genotipos permiten la reproducción de los nematodos, pues este es un elemento práctico que ayuda al productor para la toma de decisiones en la programación y establecimiento de las medidas de manejo.
El objetivo de este trabajo fue evaluar la resistencia/susceptibilidad de cuatro genotipos (Aro 8484, Caramba, HA 8476 y HA 3063 de tomate (Solanum lycopersicum L.) frente a M. incognita, así como determinar la influencia de este nematodo sobre el crecimiento de dichos genotipos.
MATERIALES Y METODOS
El experimento se realizó en condiciones semicontroladas en los aisladores biológicos del Centro Nacional de Sanidad Agropecuaria (CENSA), utilizando macetas de 1,5L de capacidad (=1,5 Kg), contentivas de una mezcla de suelo y abono orgánico (estiércol vacuno), en proporción 1:1 y esterilizada a 121°C durante 1h en autoclave.
Las semillas de S. lycopersicum de los genotipos Aro 8484, Caramba, HA 8476 y HA 3063, suministradas por el Grupo Empresarial Agrícola del Ministerio del Interior (GEA-MININT), se sembraron en bandejas de polietileno con alvéolos y a los 21 días de germinadas, se transfirieron las plántulas a macetas. Una semana después del trasplante se inocularon con nematodos.
La especie de nematodo utilizada fue M. incognita raza 2, extraída del banco de poblaciones puras del Laboratorio de Nematología del CENSA. Esta población fue identificada morfológica, fisiológica y molecularmente por Gómez (2) y se mantiene sobre S. lycopersicon cv. Campbell 28 en cajuelas de 50x50cm, contentivas de una mezcla de suelo y abono orgánico (1:1).
La suspensión de juveniles infestivos (J2) de M. incognita se preparó mediante la metodología de Hussey y Barker (5). Como población inicial (Pi) del experimento se utilizó 1,5 J2.g de suelo-1. La inoculación se realizó practicando cuatro orificios en el suelo alrededor de las plantas, para asegurar el contacto de los J2 con el sistema radical. Cada genotipo constituyó un tratamiento y como control susceptible se usó el cultivar de tomate Campbell-28, que permitió la comprobación de la viabilidad de los nematodos inoculados y establecer la categorización de los hospedantes en cuanto a la resistencia / susceptibilidad. Las macetas con las plantas inoculadas se dispusieron siguiendo un diseño completamente aleatorio y se establecieron 10 réplicas de cada tratamiento, incluyendo el control. Las plantas se mantuvieron con riego en días alternos y a los 60 días de inoculadas se extrajeron los sistemas radicales. Cada sistema radical se lavó cuidadosamente en una cubeta con agua corriente para desprender las partículas de suelo y lograr una mejor visualización de los síntomas.
El Índice de Agallamiento (IA) se estableció mediante la escala de 0-5 grados de Hartman y Sasser (6) y la población final (Pf) se determinó a través del conteo de huevos y J2 por sistema radical utilizando el método de Hussey y Barker (5). Con este valor se calculó el factor de Reproducción (FR) mediante la fórmula:
lo que permitió establecer la cantidad de veces que se reprodujo la población inicial del nematodo en cada hospedante al finalizar el experimento.
La categorización de los genotipos en cuanto a resistencia/susceptibilidad, se realizó mediante la metodología utilizada por Gómez (2). Para ello se determinó el Índice de Reproducción (IR), a través de la siguiente fórmula:
Donde Pvar se corresponde con el número de huevos-J2 producido por el genotipo evaluado y Ptest es el número de huevos-J2 producido por el cultivar que se empleó como control susceptible.
Para determinar la influencia de la población de M. incognita sobre el crecimiento de los genotipos, se diseñó otro experimento utilizando niveles crecientes del nematodo. Los niveles de nematodo utilizados fueron: 0; 0,5; 1,5 y 2,5 J2. g de suelo-1, por lo que se establecieron 16 tratamientos. Los cuatro genotipos con niveles 0 de nematodos representaron los controles del experimento. Cada tratamiento incluyendo los controles se replicó 10 veces, disponiéndose las macetas de forma aleatoria en las casas de vegetación. A los 60 días las plantas se extrajeron de las macetas y se registró la altura de las plantas (cm) desde la base del tallo hasta el extremo apical. Con los datos obtenidos se realizó un análisis de regresión lineal para establecer la relación entre los niveles de nematodos y la altura de las plantas, comparándose con los controles en cada uno de los genotipos evaluados.
RESULTADOS Y DISCUSIÓN
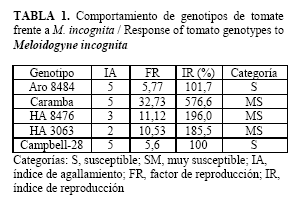
Los resultados revelaron que todos los genotipos de tomate evaluados son buenos hospedantes de M. incognita raza 2. Todos los genotipos se ubicaron en la categoría de muy susceptibles (MS), excepto Aro 8484, que al igual que el control, se manifestó como susceptible (S). La mayor reproducción del nematodo se observó en el genotipo Caramba (FR= 32,73). Sin embargo, en el IA no se obtuvo la misma respuesta. Los genotipos HA3063 y HA8476 manifestaron un menor número de agallas en el sistema radical mientras que en el resto se registró el máximo índice de la escala utilizada (Tabla 1).
En Cuba, se han realizado diversos estudios de resistencia susceptibilidad de genotipos de tomate para casas de cultivos protegidos utilizando la población de M. incognita raza 2 usada en este trabajo (2,7,8). Esta población fue originalmente encontrada parasitando tomate y cohabitando con poblaciones de diferentes especies de Meloidogyne en suelos de cultivos protegidos en Cuba (2) y ha mostrado su habilidad para reproducirse en numerosos genotipos de tomate (2,7,8,9).
Es importante señalar que los genotipos utilizados en todos estos estudios, son importados de regiones con condiciones edafo-climáticas diferentes a las de Cuba (10), lo que supone una limitante para la expresión de la resistencia. Según Starr et al. (11) en los países de clima tropical, como Cuba, la situación es compleja, debido a la existencia de una mayor diversidad de géneros de nematodos y especies (y probablemente patotipos o razas), que generalmente poseen ciclos de vida más cortos y con más generaciones por ciclo de cultivo, que colocan a este último, a una mayor presión de la plaga.
La habilidad de la población de M. incognita, para reproducirse en todos los genotipos de tomate evaluados en Cuba, incluyendo los de este trabajo, supone su alta agresividad frente a este cultivo. Según Hussey y Janssen (12), la agresividad refleja la habilidad de un nematodo para reproducirse sobre un hospedante susceptible bueno o malo. En este aspecto, la población cubana de M. incognita debiera ser considerada para su uso en la búsqueda de resistencia en los programas de mejoramiento genético de tomate.
El estudio confirmó lo planteado por Navarro-Barthelemy et al. (7), que el IA no debe ser utilizado como único elemento para determinar la resistencia de un genotipo o cultivar frente a M. incognita, aun cuando este se considera un elemento importante para estimar el daño provocado por esta plaga. Según Cook y Starr (13), la formación de agallas no es imprescindible para el desarrollo del nematodo. Por tanto, los cultivos susceptibles pueden mostrar bajos IA y altos niveles de reproducción del nematodo, como se observó en los genotipos HA3063 y HA8476, o viceversa, como ocurrió con el resto de los genotipos, incluyendo el control.
Por esta razón debe tenerse especial cuidado con el uso de los genotipos que no mostraron altos índices de agallamiento. Pueden ser subestimados en condiciones de producción donde M. incognita este presente e incrementar las poblaciones de nematodo para los cultivos sucesivos. Igualmente el cultivo continuado de estos genotipos, sin medidas de manejo o esquemas de rotación adecuada, incrementará las poblaciones del nematodo en el suelo a corto plazo. Según Curtis et al. (14), una hembra de Meloidogyne spp., puede depositar alrededor de 30-40 huevos por día, pudiendo producir cientos de huevos en toda su vida reproductiva.
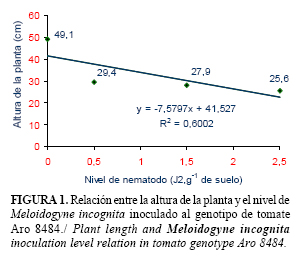
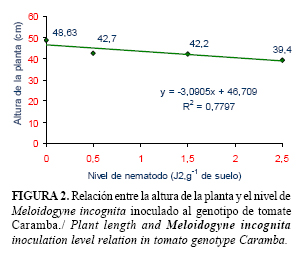
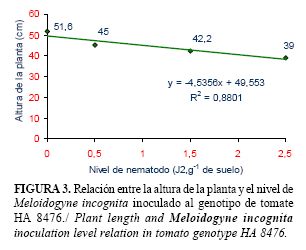
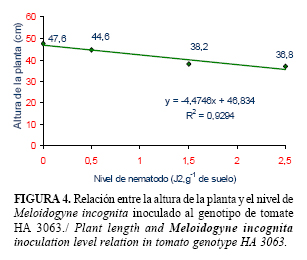
Los resultados del análisis de regresión para todos los genotipos se muestran en las figuras 1, 2, 3 y 4. En estos se evidencia que entre el 60 y el 94% de la disminución del tamaño de las plantas está relacionado con el aumento de las poblaciones de M. incognita. El crecimiento de todos los genotipos se afectó por la presencia del nematodo, aún con la dosis de aplicación más baja (0,5 J2.g-1 de suelo). Sin embargo, para el genotipo ARO-8484, la disminución lineal regresiva de la altura de la planta se hizo más evidente a medida que aumentó el nivel de nematodo (menor pendiente).
El comportamiento mostrado por los genotipos evaluados en este experimento, está relacionado con su sensibilidad frente a las poblaciones crecientes de M. incognita. Según Cook y Starr (13), la sensibilidad de un hospedante no solamente depende de su genotipo, sino también de cuantos nematodos la afectan. A densidades poblacionales altas las plantas sufren una reducción considerable de su crecimiento y viceversa. Sin embargo, la sensibilidad también está sujeta a la influencia del ambiente.
Este último aspecto debe tomarse en cuenta por los productores, ya que las condiciones en que se obtiene el tomate en la producción protegida en Cuba, el cultivo está sometido a diversas presiones para la expresión de sus rendimientos potenciales. En la producción de tomate en el trópico, se sabe que los rendimientos son impactados por las condiciones ambientales (15), las que son verdaderamente estresantes en la temporada primavera-verano en Cuba. A ello se suma el impacto de plagas como Meloidogyne spp., y problemas en la aplicación adecuada de la disciplina tecnológica. Sikora y Fernández (1) acotaron que en la producción protegida de hortalizas donde se siembran o plantan cultivos susceptibles repetidamente en un mismo suelo y el daño provocado por Meloidogyne spp., es severo. Por su parte, Greco y Di Vito (16), establecieron el umbral de daño de Meloidogyne para un diverso número de cultivos e informaron que el promedio es aproximadamente de 0,5-2 J2.g-1 de suelo.
Cuando las plantas son severamente infestadas por Meloidogyne spp, el sistema radical se reduce a un número limitado de raíces funcionales. Se observa la presencia de agallas y los sistemas vasculares completamente desorganizados. Hay escasas raíces secundarias, afectándose la toma y transporte de agua y nutrientes (1). Si las plantas sobreviven a estas condiciones, la floración y fructificación se reducen marcadamente y como consecuencias se afectan los rendimientos.
Por tanto, los genotipos evaluados no deben ser plantados en instalaciones de producción protegida de hortalizas con suelos infestados por M. incognita, sin antes establecer medidas de manejo que disminuyan las poblaciones por debajo de 0,5 J2.g-1 de suelo.
REFERENCIAS
1. Sikora RA, Fernández E. Nematode Parasites of Vegetables. En: Luc M, Sikora RA, Bridge J, editors. Plant Parasitic Nematodes in Subtropical and Tropical Agriculture. CAB International. UK; 2005. p. 319-392.
2. Gómez L. Diagnóstico de nematodos agalleros y prácticas agronómicas para el manejo de Meloidogyne incognita en la Producción Protegida de Hortalizas. Tesis. La Habana: Universidad Agraria de la Habana Centro Nacional de Sanidad Agropecuaria, 2007.
3. Gómez L, Rodríguez MG, Enrique R, Miranda I, González E. Factores limitantes de los rendimientos y calidad de las cosechas en la producción protegida de hortalizas en Cuba. Rev Protección Veg. 2009;4(2):117-123.
4. Rodríguez MG, Gómez L, Cuadra R, Díaz-Viruliche L, Fernández E, Casanova A, et al. Nematodos formadores de agallas en Sistemas de Cultivos Protegidos: Diagnóstico y Manejo. Centro Nacional de Sanidad Agropecuaria, Laboratorio de Nematología, Dirección de Protección de Plantas; Informe Final de Proyecto. Programa Ramal de Hortalizas-MINAG, Cuba. 2006.
5. Hussey RS, Barker KB. A comparison of methods for colleting inocula of Meloidogyne spp. including a new technique. Plant Disease Report. 1973;57:1025-1028.
6. Hartman KM, Sasser JN. Identification of Meloidogyne species on the basis of differential host test and perineal pattern morphology. En: Barker KR, Carter CC, Sasser JN, editors. An Advanced Treatise on Meloidogyne. Methodology. North Carolina State University Graphics. USA; 1985. p. 69-78.
7. Navarro-Barthelemy L, Gómez L, Enrique R, González FM, Rodríguez MG. Comportamiento de genotipos de tomate (Solanum lycopersicum L.) frente a Meloidogyne incognita (Kofoid y White) chitwood. Rev Protección Veg. 2009;24(1):54-57.
8. Rodríguez MG, Gómez L, González FM, Carrillo Y, Piñón M, Gómez O, et al. Comportamiento de genotipos de la familia Solanaceae frente a Meloidogyne incognita (Kofoid y White) Chitwood. Rev Protección Veg. 2009;24(3):137-145.
9. González FM, Gómez O, Rodríguez Y, Casanova A, Piñón M, Gómez L, et al. Evaluación de la resistencia a Meloidogyne spp. de nuevos portainjertos para tomate. Fitosanidad. 2009;13(2):134.
10.Casanova AS, Gómez O, Pupo RF, Hernández M, Chailloux M, Depestre T, et al. Manual para la producción protegida de hortalizas. MINAGRI-VCV-IIHLD, La Habana. Cuba; 2007. 138 pp.
11.Starr JL, Bridge J, Cook R. Resistance to plant-parasitic nematodes: history, current use and future potential. En: Starr JL, Cook R, Bridge J, editors. Plant resistance to parasitic nematodes. CAB International, UK; 2002. p. 1-22.
12.Hussey RS, Janssen GJW. Root-knot Nematodes: Meloidogyne Species. En: Starr JL, Cook R, Bridge J, editors. Plant resistance to parasitic nematodes. CAB International, UK; 2002. p. 43-70.
13.Cook R, Starr JL. Resistant Cultivars. En: Perry R, Moens M, editors. Plant nematology. CAB International. UK; 2006. p. 370-389.
14.Curtis RHC, Robinson AF, Perry RN. Hatch and Host Location. En: Perry RN, Moens M, Starr JL, editors. Root-knot nematodes. CAB International. UK; 2009. p. 139-155.
15.Langlais C, Ryckewaert P. Guía de los cultivos protegidos de hortalizas en la zona tropical húmeda. CIRAD. Guadalupe; 2002. 90 pp.
16.Greco N, Di Vito M. Population Dynamics and Damage Levels. En: Perry RN, Moens M, Starr JL, editors. Root-knot nematodes. CAB International. UK; 2009. p. 246-269.
Recibido 31-10-2011.
Aceptado 23-12-2011.
1 Investigación ejecutada en el marco del proyecto «Interacción tomate-Fusarium oxisporum-Meloidogyne incognita: Alternativas para el manejo en sistema de cultivos protegidos»