Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Protección Vegetal
versión impresa ISSN 1010-2752
Rev. Protección Veg. vol.27 no.3 La Habana sep.-dic. 2012
ARTÍCULO ORIGINAL
Efecto de la presencia de abono orgánico sobre la actividad de Pochonia chlamydosporia var. catenulata (Kamyschko ex Barron y Onions) Zare y Gams frente a Meloidogyne enterolobii Yang y Eisenback
Effect of the presence of organic amendment on the activity of Pochonia chlamydosporia var. catenulata (Kamyschko ex Barron and Onions) Zare & Gams on Meloidogyne enterolobii Yang y Eisenback
Jersys ArévaloI, S.D. SilvaII, Marina D.G. CarneiroIII, R.B. LopesIII, Regina M.D.G. CarneiroIII, Myrian S. TiganoIII, L. Hidalgo-DíazI
ICentro Nacional de Sanidad Agropecuaria, Apartado 10, San José de las Lajas, Mayabeque, CP 32700, Cuba. Correo electrónico: jersys@censa.edu.cu.
IIUniversidad de Brasília UnB, Brasília- DF, CP 02372, Brasil.
IIIEmbrapa- Recursos Genéticos y Biotecnología, Brasília- DF, CP 02372, Brasil.
RESUMEN
Se evaluó el efecto de la presencia de abono orgánico sobre la actividad de dos cepas seleccionadas de Pochonia chlamydosporia var. catenulata (Kamyschko ex Barron y Onions) Zare y Gams (IMI SD 187 y CG1006) de Cuba y Brasil, respectivamente, frente a Meloidogyne enterolobii Yang y Eisenback. El experimento se realizó en Embrapa-Cenargen, Brasilia-DF (Brasil) y se mantuvo en casa de vegetación durante los meses de febrero-abril de 2011. Se utilizó un suelo agrícola y se combinó la presencia-ausencia de abono orgánico (Bioplant) (1:1 v/v) con suelo natural (no esterilizado y esterilizado). Se prepararon cuatro tratamientos con cada cepa donde se inocularon 5000 clamidosporas.g-1 de sustrato y cuatro grupos controles (sin Pochonia), en bolsas de polietileno con 4kg de sustrato, donde se trasplantó una postura de achicoria y se añadieron 5000 juveniles/huevos de M. enterolobii. Se comprobó que el desarrollo saprofítico de ambas cepas de P. chlamydosporia var. catenulata estuvo en el orden de 103-104 UFC.g-1 en el suelo y las raíces. El porcentaje de colonización de masas de huevos y el parasitismo de huevos de la cepa CG1006 fue superior, con valores entre 77-92% y 71-83%, comparado a la IMI SD 187 que logró 58-89 y 37-74%, respectivamente. Aun cuando ambos hongos no redujeron el índice de agallas de M. enterolobii, disminuyó el número de huevos sanos, respecto al control. Los resultados indicaron que la presencia de abono orgánico no influyó significativamente en la actividad de la cepa nativa, pero sí de la cepa foránea (IMI SD 187) fundamentalmente en el suelo natural. Se ratifica la pertinencia de estudios en suelos no esterilizados, al ofrecer información más confiable en la selección de cepas promisorias como agentes de control biológico de nematodos y su empleo dentro de estrategias de manejo.
Palabras clave: hongos nematófagos, Nematodos formadores de agallas, control biológico, enmienda orgánica.
ABSTRACT
The effect of the presence of organic amendment on the activity of two selected strains of Pochonia chlamydosporia var. catenulata (Kamyschko ex Barron and Onions) Zare & Gams on Meloidogyne enterolobii Yang & Eisenback was evaluated. The fungal strains studied were IMID SD 187 from Cuba and CG1006 from Brazil. The experiment was carried out in Embrapa-Cenargen, Brasilia-DF (Brazil), under greenhouse conditions during February-April, 2011. An agricultural soil (sterilized and not sterilized) was used and combined with the presence-absence of organic amendment (Bioplant) (1:1 v/v). Four treatments were prepared inoculating polyethylene bags with 4kg of substrate with 5000 chlamydopores.g-1 of substrate of each of the strains, leaving non-inoculated bags as controls. Then, a chicory plant was transplanted into each bag, and 5000 juveniles/eggs of M. enterolobii were added. Colonization of both strains of P. chlamydosporia var. catenulata was in the order of 103-104 UFC,g-1 in the soil and roots. The percentages of egg mass colonization and egg parasitism of the strain CG1006 were higher, between 77-92% and 71-78%, than those of IMI SD 187, which were 58-89% and 37-74%, respectively. Although the galling index of M. enterolobii was not reduced by the effect of none of the fungi, the number of healthy egg was reduced compared with the control. The results indicated that the presence of organic amendment did not influence the activity of the native strain significantly, but it did influence that of the foreign strain (IMI SD 187), fundamentally in natural soil. Therefore, the pertinence of studies in non- sterilized soils was ratified for offering more reliable information for the selection of promising strains as biological control agents of nematodes and their use within nematode management strategies.
Key words: nematophagous fungi, Root-knot Nematodes, biological control, organic ammendments.
INTRODUCCIÓN
Pochonia chlamydosporia (Goddard) Zare y Gams, es un parásito facultativo de huevos de nematodos formadores de quistes y agallas, con potencial como agente de control biológico (1, 2). Este hongo se aisló en diferentes regiones y cultivos, parasitando de manera natural poblaciones de Meloidogyne Goeldi o en estado saprófito en suelo (3, 4, 5).
La relación entre el crecimiento saprofítico y la virulencia de este hongo nematófago es compleja. El crecimiento extensivo en la rizosfera es esencial; sin embargo, los aislamientos que solo proliferan en el suelo no tienen efecto significativo en la reducción de poblaciones de nematodos (6). Por otra parte, resultados obtenidos por Monfort et al. (7) y Podestá et al. (8), indicaron que la microbiota natural influye en la proliferación de P. chlamydosporia en el suelo y que este sería más receptivo para aislamientos nativos que para aquellos que no lo son (7, 9).
En Brasil, recientemente se obtuvieron cepas nativas de este hongo aisladas de huevos de Meloidogyne enterolobii Yang y Eisenback (syn. jun. Meloidogyne mayaguensis Rammah y Hirschmann), con perspectivas para su uso como agentes de control biológico (10); mientras que Cuba posee una cepa seleccionada de Pochonia chlamydosporia var. catenulata (Kamyschko ex Barron y Onions) Zare y Gams (IMI SD 187) efectiva para el manejo de Meloidogyne spp. (2, 11 ,12), que se utiliza como ingrediente activo del bioproducto KlamiC® (13).
El potencial de estas cepas como agentes de control biológico de M. enterolobii se evidenció en guayaba (Psidium guajava L.) (14) y hortalizas (15); sin embargo, esos estudios se realizaron utilizando suelo estéril y elevado contenido de abono orgánico.
El objetivo de este trabajo fue evaluar el efecto de la presencia de abono orgánico en suelo esterilizado y no esterilizado (natural) sobre la actividad saprofítica y patogénica de dos cepas de P. chlamydosporia var. catenulata frente a M. enterolobii.
MATERIALES Y MÉTODOS
Se utilizaron dos cepas de P. chlamydosporia var. catenulata: CG1006 (nativa de Brasil, aislada de huevos de M. enterolobii) e IMI SD 187 (autóctona de Cuba y obtenida de huevos de Meloidogyne incognita (Kofoid y White) Chitwood.
El experimento se realizó durante dos meses (febrero-abril/2011), a temperatura media de 21±3ºC, en condiciones semicontroladas de casa de vegetación en instalaciones de Embrapa-Recursos Genéticos y Biotecnología (CENARGEN), Brasilia-DF (Brasil). Se utilizó suelo natural (Oxisol rojo), colectado en una región agrícola de la ciudad de Gama-DF (Brasil). Previamente se descartó la presencia de cepas nativas de P. chlamydosporia en el suelo, utilizando medio semiselectivo (16) y de Meloidogyne spp. a través de plantas indicadoras (Solanum lycopersicum L. cv Santa Clara) (17).
Se establecieron 12 tratamientos de 8 réplicas cada uno, con las cepas (CG1006 e IMI SD 187) o sin ellas (grupos controles). Se utilizaron bolsas de polietileno con 4kg de sustrato y se combinó la presencia-ausencia de abono orgánico (Bioplant) (1:1 v/v) con suelo natural (no esterilizado) y esterilizado (30 min./ 121ºC en autoclave) (Tabla 1).
En cada bolsa se trasplantó una plántula de 15 días de germinada de achicoria (Cichorium endivia L.) cv. cichorium a raíz desnuda, las que se produjeron en bandejas plásticas con suelo abonado (1:1 v/v) y esterilizado en autoclave.
El inóculo fúngico se obtuvo mediante fermentación en estado sólido en bolsas con filtro (18). En los tratamientos con el hongo, al momento del trasplante, se añadió una suspensión de 5000 clamidosporas.g-1 de sustrato de cada cepa en 100mL de agua destilada estéril alrededor de la raíz de cada planta. Las bolsas se mantuvieron bajo sistema de riego en días alternos.
Después de 10 días se inocularon 5000 huevos de M. enterolobii alrededor de la raíz de cada planta de achicoria. La suspensión de huevos se obtuvo a partir de una población pura de M. enterolobii y la extracción se realizó con hipoclorito de sodio (1%), a partir de la raíz de una planta de tomate infestada.
A los dos meses, se removieron y extrajeron las plantas de achicoria de 4 bolsas de cada tratamiento. Las raíces se lavaron cuidadosamente con agua corriente para retirar los restos de sustrato y se colocaron sobre papel absorbente para eliminar el exceso de agua. Inmediatamente se determinó su masa fresca. Posteriormente, se evaluó el índice de agallamiento mediante la escala de 0-5 grados propuesta por Taylor y Sasser (19) (0= sin agallas, 1= 1-2, 2= 3-10, 3=11-30, 4= 31-100, 5= más de 100 agallas).
Para la extracción de los huevos de M. enterolobii las raíces de cada planta se batieron en una solución de hipoclorito de sodio al 1%. Luego se lavaron con agua a través de tamices de 20, 100 y 500 Mesh, se colectaron en el tamiz más pequeño y se obtuvo una suspensión en 100mL de agua (20). El conteo de huevos por planta se realizó en cámara de Peter utilizando un microscopio óptico Zeiss (4X) y se determinó el número de huevos.g-1 de raíz.
Las réplicas restantes se utilizaron para determinar la actividad saprofítica y parasítica de ambas cepas. La colonización del hongo en el suelo y las raíces se determinó mediante el método de dilución y siembra en medio semiselectivo (16). Para evaluar la colonización sobre las masas de huevos de M. enterolobii, se extrajeron 50 masas de huevos de cada raíz con ayuda de un estéreo microscopio, se lavaron tres veces con agua destilada estéril y se sembraron en dos placas Petri con Agar Agua con Antibiótico (AAA) (Agar Técnico: 15g.L-1, Cloranfenicol: 50mg.L-1, Tetraciclina: 50mg.L-1 y Sulfato de Estreptomicina: 50mg.L-1) a razón de 10 masas de huevos por placa. Luego se incubaron durante 5 días a 25ºC. Con el resto de las masas de huevos se preparó una suspensión de huevos en 1mL de agua estéril y se sembraron 0,2mL en dos placas con AAA donde se determinó el porcentaje de huevos parasitados a las 48h (16). Estos resultados se utilizaron para estimar el número de huevos sanos.g-1 en las raíces, según Sorribas et al. (18).
Los parámetros evaluados se compararon mediante un Análisis de Varianza Simple. La diferencia entre las medias se determinó a través de la prueba de rango múltiple de Duncan con un nivel de significación p£0.05, mediante el paquete estadístico InfoStat versión 1.1 (21).
RESULTADOS
A los dos meses, la colonización de ambas cepas de P. chlamydosporia en el suelo estuvo en el orden de 103-104 UFC.g-1. La proliferación de la cepa nativa CG1006 en el suelo fue significativamente superior comparado con la cepa foránea IMI SD 187, excepto en el tratamiento con suelo esterilizado sin abono orgánico, donde la cepa IMI SD 187 logró la mayor colonización. En el suelo esterilizado la presencia de abono orgánico favoreció la colonización de la cepa nativa CG1006 y afectó la cepa IMI SD 187; mientras que en el suelo natural la colonización de cada cepa de manera independiente, no mostró diferencias significativas entre los tratamientos en presencia y ausencia de abono orgánico (Figura 1).
La Figura 2 muestra que la colonización de ambas cepas sobre las raíces de achicoria estuvo en el orden de 103-104 UFC.g-1 de raíz. La concentración de CG1006 fue significativamente superior respecto a IMI SD 187 en cada uno de los tratamientos. Sin embargo, la presencia de abono orgánico afectó la colonización de ambos hongos en las raíces, excepto en los tratamientos con la cepa IMI SD 187 en suelo natural donde no hubo diferencias en la colonización tanto en presencia como en ausencia de abono orgánico. El comportamiento de esta cepa en la colonización de las raíces fue similar al que se observó en el suelo.
La colonización de ambas cepas de P. chlamydosporia sobre las masas de huevos de M. enterolobii estuvo entre 58-92%. Se comprobó que el uso de abono orgánico (1:1 v/v) no tuvo un efecto signifactivo, independientemente de que el suelo utilizado era natural o esterilizado (Figura 3).
La actividad parasítica de CG1006 sobre los huevos de M. enterolobii fue significativamente superior (71-78%), respecto a IMI SD 187 (37-74%), excepto en el tratamiento con suelo esterilizado sin abono orgánico donde IMI SD 187 logró un alto porcentaje de huevos parasitados. La presencia de abono orgánico no afectó el parasitismo de huevos de M. enterolobii de la cepa CG1006 pero sí redujo el porcentaje de huevos parasitados por la cepa foránea IMI SD 187, independientemente del suelo esterilizado o no (Figura 4).
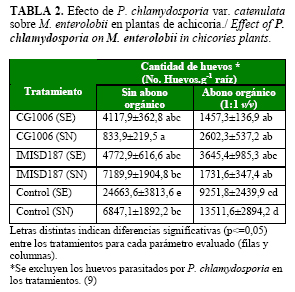
La población de M. enterolobii en las plantas de achicoria a los dos meses del cultivo, estimada a través del índice de agallas, fue alta entre 4,5-5 grados en todos los tratamientos. No obstante, se comprobó que en los tratamientos con ambas cepas hubo una reducción significativa del número de huevos sanos, siendo mayor con la cepa nativa CG1006 en suelo natural sin materia orgánica. Sin embargo, las diferencias no fueron significativas cuando se compararon los tratamientos (suelo estéril o no estéril y presencia o no de materia orgánica), ni entre ambas cepas (Tabla 2).
DISCUSIÓN
Los resultados confirmaron las potencialidades de ambas cepas de P. chlamydosporia var. catenulata frente a M. enterolobii, al colonizar la rizosfera de las plantas infestadas y parasitar más del 60% de los huevos del nematodo; aunque el parasitismo de la cepa foránea IMI SD 187 fue menor en presencia de abono orgánico. Esta cepa logró una mayor colonización en el tratamiento con suelo esterilizado sin abono orgánico. Estos resultados pudieran estar relacionados con un incremento de otros microrganismos presentes que podrían no ser compatibles con esta cepa o que liberen compuestos con efecto fungistático. Resultados informados por Podestá et al. (9) y Liu et al. (22), indicaron que el efecto antagonista de la comunidad microbiana en suelo natural sobre el inóculo de hongos nematófagos puede afectar su actividad biológica. Por otra parte, estudios sobre la colonización de P. chlamydosporia y Paecilomyces lilacinus (Thom) Samson, realizados por Monfort et al. (7), señalaron que la influencia de la microbiota en la proliferación de estos hongos en el suelo lo hace más receptivo para aislamientos nativos. Lo que sugiere que la cepa CG1006 tendría mayor adaptación comparada a la IMI SD 187.
Sin embargo, a pesar de esta desventaja, la cepa IMI SD 187 fue capaz de persistir en el suelo natural y en las raíces de achicoria en el orden de 103 UFC.g-1 después de dos meses de aplicado y logró una colonización superior al 58% sobre masas de huevos. Atkins et al. (23) comprobaron que esta cepa puede ser muy competitiva al ser inoculada, incluso, junto con una cepa de P. chlamydosporia var. chlamydosporia de origen diferente. Otras cepas no nativas de P. chlamydosporia mostraron dificultad al ser aisladas nuevamente de la rizosfera después de la aplicación y necesitarían de múltiples aplicaciones para lograr un incremento en las poblaciones (9).
La presencia de abonos orgánicos puede influir en la colonización de P. chlamydosporia; generalmente el crecimiento se ve favorecido en suelos orgánicos (1). Sin embargo, Puertas e Hidalgo (24) indicaron que este hongo no requiere de elevadas proporciones de abonos orgánicos para su establecimiento en el suelo y la rizosfera. Por otra parte, Mauchline et al. (25) y Manzanilla et al. (26) sugirieron que fuentes de nutrientes adicionales pudieran afectar su actividad parasítica. Según los resultados obtenidos, la adición de abono orgánico en proporción (1:1 v/v) no tuvo un efecto negativo en el parasitismo de la cepa CG1006 sobre los huevos de M. enterolobii, mientras que el parasitismo de la cepa foránea IMI SD 187 disminuyó en los tratamientos con suelo abonado. Esto podría estar relacionado con una mayor preferencia de la cepa CG1006 por M. enterolobii, ya que fue aislada de esta especie.
La efectividad de P. chlmaydosporia en la reducción de nematodos formadores de agallas se incrementa cuando se combina con otras medidas de manejo, como sugirieron Hidalgo y Kerry (27) y Carneiro et al. (14); entre ellas las enmiendas orgánicas. Por tanto, se ratifica la pertinencia de estudios en suelos no esterilizados al ofrecer información más confiable en la selección de cepas promisorias como agentes de control biológico de nematodos y en el uso adecuado de cepas seleccionadas dentro de estrategias de manejo de nematodos.
REFERENCIAS
1. Kerry BR. Exploitation of the nematophagous fungus Verticillium chlamydosporium Goddard for the Biological Control of Root-knot Nematodes (Meloidogyne spp.). En: Butt TM, Jackson C, Magan N. (Editors). Fungi as Biocontrol Agents: Progress, Problems and Potential. CAB International, Wallingford. 2001; pp. 155-168.
2. Atkins SD, Hidalgo-Díaz L, Clark IM, Morton CO, Montes de Oca Nivian, Gray PA, et al. Approaches for monitoring the release of P. chlamydosporia var. catenulata, a biological control agent of root-knot nematodes. Mycol Res. 2003;107(2):206-212.
3. Hidalgo L, Sánchez L, Gómez L. Verticillium chlamydosporium Goddard, parásito de huevos de Meloidogyne incognita. Rev Protección Veg. 1998;13(1):29-30.
4. Hidalgo-Díaz L, Bourne JM, Kerry BR, Rodríguez MG. Nematophagous Verticillium spp. in soils infested with Meloidogyne spp. in Cuba: isolation and screening. International Journal of Pest Management. 2000;46:277-284.
5. Verdejo-Lucas S, Ornat C, Sorribas FJ, Stchiegel A. Species of Root-knot Nematodes and Fungal Egg Parasites Recovered from Vegetables in Almería and Barcelona, Spain. Journal of Nematology. 2002;34(4):405-408.
6. Leij de FAAM, Kerry BR. The nematophagous fungus Verticillum chlamydosporium Goddard, as a potencial biological control agent for Meloidogyne arenaria (Neal) Chitwood. Revue Nematol. 1991;14:157-164.
7. Monfort E, López-llorca LV, Janson HB, Salinas J. In vitro soil receptivity assays to egg-parasitic nematophagous fungi. Mycological Progress. 2006;5:18-23.
8. Podestá GS, Dallemole-Giaretta R, Freitas LG, Lopes EA, Ferraz S, Zooca RJF. Atividade de Pochonia chlamydosporia em solo natural ou autoclavado sobre Meloidogyne javanica. Nematología Brasileira. 2009;33(2):191-193.
9. Sorribas FJ, Ornat C, Galeano M, Verdejo-Lucas S. Evaluation of a native and introduced isolate of Pochonia chlamydosporia against Meloidogyne javanica. Biocontrol Science and Technology. 2003;13(8):707-714.
10.Arévalo J, Hidalgo-Díaz L, Martins I, Souza JF, Castro JMC, Carneiro RMDG, et al. Cultural and morphological characterization of Pochonia chlamydosporia and Lecanicillium psalliotae isolated from Meloidogyne mayaguensis eggs in Brazil. Tropical Plant Pathology. 2009;34(3):158-163.
11.Hidalgo L. Potencialidades de cepas autóctonas de Verticillium chlamydosporium (Goddard) como agente de control biológico de Meloidogyne spp. Tesis en opción al grado de Doctor en Ciencias Agrícolas. Universidad Agraria de La Habana, Cuba. 2000; 100 p.
12.Kerry BR, Hidalgo-Díaz L. Application of Pochonia chlamydosporia in the integrated control of root-knot nematodes on organically grown vegetable crops in Cuba. IOBC/WPRS Bull. 2004;27(1):123-127.
13.Registro Central de Plaguicidas, MINAGRI. Lista Oficial de Plaguicidas Autorizados en la República de Cuba. 2010, p 325.
14.Carneiro RMDG, Hidalgo-Díaz L, Martins I, Silva KFA, De Sousa MG, Tigano MS. Effect of nematophagous fungi on reproduction of Meloidogyne enterolobii on guava (Psidium guajava) plants. Nematology. 2011;13(6):721-728.
15.Arévalo J, Silva SD, Carneiro MDG, Lopes RB, Carneiro RMDG, Tigano MS, et al. Pochonia chlamydosporia (Goddard) Zare y Gams como potencial agente de control biológico de Meloidogyne enterolobii (Yang y Eisenback) en cultivos hortícolas. Rev Protección Veg. 2012;27(2):123-129.
16.Kerry BR, Bourne JM. A manual for research on Verticillium chlamydosporium, a potential biological control agent for root-knot nematodes. IOBC/WPRS. 2002; 84 pp.
17.García O, Fernández E. Instituto de Investigaciones de Sanidad Vegetal- Unidad de Sistemática y Biología (Cuba). Metodología para determinar el comportamiento varietal de cultivos agrícolas a los nematodos parásitos. 1983; 7pp.
18.Montes de Oca N. Buenas prácticas de fabricación para la obtención de um bionematicida a partir de la cepa IMI 187 de Pochonia chlamydosporia var. catenulata. Tesis de Doctor en Ciencias Agrícolas. Universidad Agraria de La Habana, Cuba. 2004; 152 pp.
19.Taylor AL, Sasser JN. Biology, identification and control of root-knot nematodes (Meloidogyne species). Cooperative publications, Dept. Plant Pathology, North Carolina State Univ. & U.S. Agency of International Development, Raleigh. 1978; 111p.
20.Hussey RS, Barker KB. A comparison of methods of colleting inocula of Meloidogyne spp. including a new technique. Plant Dis Reptr. 1973;57:1025-1028.
21.Di Rienzo JA, Balzarini MG, González L, Tablada M, Guzmán W, Casanoves F, et al. InfoStat/Profesional Versión 1.1. 2002.
22.Liu X, Xiang M, Che Y. The living strategy of nemathophagous fungi. Mycoscience. 2009;50:20-25.
23.Atkins SD, Peteira B, Clark IM, Kerry BR, Hirsch PR. Use of real-time quantitative PCR to investigate root and gall colonisation by co-inoculated isolates of the nematophagous fungus Pochonia chlamydosporia. Ann Appl Biol. 2009;155:143-152.
24.Puertas A, Hidalgo L. Efecto de diferentes abonos orgánicos sobre el establecimiento de Pochonia chlamydosporia var. catenulata en el sustrato y la rizosfera de plantas de tomate. Rev Protección Veg. 2009;24(3):162-165.
25.Mauchline TH, Kerry BR, Hirsch PR. The biocontrol fungus Pochonia chlamydosporia shows nematode host preference at the infraspecific level. Mycol Res. 2004;108(2):161-169.
26.Manzanilla-López RH, Esteves I, Powers SJ, Kerry BR. Effects of crop plants on abundance of Pochonia chlamydosporia and other fungal parasites of root-knot and potato cyst nematode. Annals of Applied Biology. 2011;159(1):118-129.
27.Hidalgo-Díaz L, Kerry BR. Integration of biological control with other methods of nematode management. In: Ciancio A. & Mukerji KG. (Editors). Integrated management and biocontrol of vegetable and grain crops nematodes. 2008; 29-49.
Recibido: 5-12-2011.
Aceptado: 10-8-2012.












 Curriculum ScienTI
Curriculum ScienTI