Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Protección Vegetal
versión impresa ISSN 1010-2752
Rev. Protección Veg. vol.28 no.1 La Habana ene.-abr. 2013
ARTÍCULO ORIGINAL
Efecto in vitro de aceites esenciales sobre Alternaria solani Sorauer
In vitro effect of essential oils on Alternaria solani Sorauer
Yanisia Duarte, Oriela Pino, Danay Infante, Yaima Sánchez, María del Carmen Travieso, B. Martínez
Dirección de Protección de Plantas, Centro Nacional de Sanidad Agropecuaria (CENSA), Apartado 10, San José de las Lajas, Mayabeque. CP 32700. Cuba. Correo electrónico: yanisia@censa.edu.cu.
RESUMEN
Este trabajo tuvo como objetivo determinar la actividad antifúngica in vitro de diez aceites esenciales sobre Alternaria solani Sorauer, importante patógeno de las solanáceas. Se evaluó el efecto por contacto directo y por exposición a los vapores. Los bioensayos se realizaron según diseño completamente aleatorizado, se utilizó el método de discos de papel inoculados con los aceites, enfrentados a discos del fitopatógeno y se evaluó el crecimiento radial del hongo. Todos los aceites, excepto Citrus sinensis (L.) Osbeck (naranjo dulce), inhibieron el crecimiento micelial hasta los 7 días. A los 14 días se observó inhibición total en los tratamientos con los aceites de Pimpinella anisum L. (anís), Ocimum basilicum L. (albahaca blanca), Ocimum basilicum L. variedad genovese (albahaca genovesa) y Piper auritum Kunth (caisimón de anís). Los metabolitos volátiles de los aceites no mostraron efecto fungicida; no obstante se observó inhibición del crecimiento micelial de A. solani en los tratamientos con los extractos de Ruta chalepensis L. (ruda) y Piper auritum. Los resultados abren nuevas perspectivas para el control de este patógeno.
Palabras clave: aceites esenciales, actividad antifúngica, Ocimum basilicum, Piper marginatum, Ruta chalepensis, Pimpinella anisum, Piper auritum, Piper aduncum subsp. Ossanum, Citrus sinensis.
ABSTRACT
The aim of this work was to determine the in vitro antifungal activity of ten essential oils on Alternaria solani SORAUER. The effect by direct contact and exposure to vapors was evaluated. The bioassays were performed using a completely randomized design and the method of paper discs inoculated with the oils facing phytopathogen discs; the fungal radial growth was evaluated. All the oils, except those from Citrus sinensis (L.) Osbeck (sweet orange), inhibited the mycelial growth until the seventh day. At day 14, a total inhibition was observed in the treatments with the oils from Pimpinella anisum L. (anise), Ocimum basilicum L. (white basil), Ocinum basilicum L. var. genovese (Genovese basil), and Piper auritum Kunth (anise caisimon). No fungicidal effect was shown by the volatile metabolites of the oils; however, the inhibition of A. solani mycelial growth was observed in the treatments with the extracts of Ruta chalepensis L. (ruda) and P. auritum. These results open new perspectives for the control of this pathogen.
Key words: essential oils, antifungal activity, Ocimum basilicum, Piper marginatum, Ruta chalepensis, Pimpinella anisum, Piper auritum, Piper aduncum subsp. Ossanum, Citrus sinensis.
INTRODUCCIÓN
Alternaria solani Sorauer es un hongo fitopatógeno que afecta principalmente a solanáceas y entre ellas al tomate (Solanum lycopersicum L.) y la papa (Solanum tuberosum L.), ocasionando la enfermedad conocida como Tizón temprano. La enfermedad presenta tres fuentes de inóculo principales: clamidosporas en el suelo, tubérculos semillas contaminados y las solanáceas silvestres que crecen todo el año en colindancia en los campos de cultivo (1).
En el caso de la papa, la enfermedad puede ocasionar síntomas en hojas, tallos y tubérculos. Los síntomas se manifiestan en hojas viejas de la planta, los que avanzan hasta ocurrir la fase de tizón (2). En el tomate, el hongo puede causar el mal del talluelo (damping-off) en el semillero y necrosis en frutos (3).
En Cuba, el Tizón temprano se considera como una enfermedad fúngica importante, cuyo agente etiológico presenta variabilidad genética y patogénica entre los aislados procedentes de diferentes localidades (2, 4).
Numerosas alternativas se utilizan para manejar esta enfermedad, como el uso de semillas y plántulas sanas, prácticas culturales e introducción de variedades resistentes, todo lo que conlleva a la reducción del número de aplicaciones de productos químicos (5,6,7).
Para el manejo de este hongo se desarrollaron también estudios de productos bioactivos, a partir de microorganismos como Bacillus sp., Pseudomonas aeruginosa Schröter (GLUTICID) y Trichoderma spp. (8, 9, 10, 11).
El desarrollo de medios efectivos para el manejo de plagas es esencial para lograr productividad, rentabilidad y evitar los impactos negativos en la biodiversidad de los agroecosistemas, por efecto de los plaguicidas sintéticos (12). En la actualidad el desarrollo de productos a partir de las plantas es una alternativa promisoria, pues se demostró el efecto negativo sobre el desarrollo de hongos fitopatógenos de productos derivados de numerosas plantas (13, 14, 15).
El presente trabajo tuvo como objetivo determinar la actividad anti-fúngica in vitro de diez aceites esenciales sobre A. solani., para establecer sus potencialidades para el manejo de esta plaga.
MATERIALES Y MÉTODOS
Los aceites esenciales empleados en la investigación, provenientes del Laboratorio de Productos Naturales del Centro Nacional de Sanidad Agropecuaria (CENSA), se obtuvieron de las siguientes especies vegetales: Ocimum basilicum L. (albahaca blanca), Ocimum basilicum variedad genovese L. (albahaca genovesa), Piper marginatum Jacq. (anisillo), Ruta chalepensis L. (ruda), Pimpinella anisum L. (anís), Piper auritum Kunth (caisimón de anís), Melaleuca quinquenervia (Cav) S.T. Blake (melaleuca), Piper aduncum subsp. ossanum (C. DC.) Saralegui (Platanillo de Cuba) y Citrus sinensis (L.) Osbeck (naranjo dulce).
El aceite de C. sinensis se obtuvo por expresión, y los restantes por hidrodestilación en equipo Clevenger, según lo establecido en la norma ISO 65-71: 84 (16). El tiempo de destilación fue de 3 horas, excepto para el aceite II de O. bacilicum, que se destiló por 5 horas. Cada esencia se secó sobre sulfato de sodio anhidro (Fluka, PA) y se almacenó a 8oC hasta su análisis.
Procedencia del patógeno
El hongo fitopatógeno utilizado para la evaluación antifúngica de los aceites fue A. solani (cepa 100), seleccionada para el estudio por ser altamente agresiva en el cultivo del tomate (17), proveniente del cepario del Laboratorio de Micología Vegetal (CENSA). El hongo se multiplicó en placas Petri contentivas de Papa-Dextrosa-Agar (PDA) (Biocen) (39 g.L-1). Para la obtención del material biológico, se sembraron en el centro de las placas Petri fragmentos de la periferia de la colonia y se incubaron a 28ºC ±2°C durante 72 horas.
Determinación de la eficacia de los aceites en la inhibición del crecimiento del hongo fitopatógeno in vitro
El trabajo se realizó empleando placas Petri de 90 mm de diámetro con medio PDA esterilizado a 121ºC (15 min). Para evaluar el efecto de los aceites se utilizaron dos bioensayos.
En el primero se evaluó el efecto por contacto directo de los aceites sobre el hongo. En cada placa se colocaron equidistantes cuatro discos de papel de filtro Whatman N° 1(6mm diámetro) estériles, y a cada uno se le añadieron 10 mL del aceite correspondiente. Posteriormente, se colocaron discos de 4 mm de diámetro del fitopatógeno sobre los discos de papel de filtro previamente inoculados, procurando un contacto directo del micelio del hongo con el aceite. El crecimiento radial del hongo se midió con una regla graduada diariamente hasta los 7 días (dinámica de inhibición).
Transcurrido ese período, en los tratamientos donde no hubo crecimiento los discos del fitopatógeno se voltearon sin estar en contacto con el papel tratado con el aceite. El crecimiento radial del hongo se evaluó hasta los 14 días. Los tratamientos se realizaron bajo un diseño completamente aleatorizado.
En el segundo bioensayo se evaluó el efecto de los vapores de los aceites que mostraron resultados satisfactorios en el primer ensayo. Un disco de papel inoculado con el aceite se colocó en el centro de la placa y se sembraron discos del fitopatógeno en el área circundante a 5 mm del disco. El crecimiento radial del hongo se midió con una regla graduada cada 24 horas hasta los 5 días.
En ambos bioensayos, las placas se sellaron con papel Parafilm y se incubaron a una temperatura de 28ºC±2°C. Se emplearon tres réplicas para cada tratamiento. Como control negativo, se utilizó un disco de papel de filtro tratado con agua bidestilada estéril.
Análisis estadístico
Se realizó la evaluación del Porcentaje de Inhibición del Crecimiento Radial (PICR), empleando la fórmula de Abbot (18):
PICR (%) = [(RC RT) / RC] x 100
Donde: RC = Radio del micelio del control; RT = Radio del micelio del tratamiento
Los datos del primer bioensayo se transformaron mediante
Los valores se sometieron a un Análisis de Varianza (ANOVA) de clasificación simple y las medias se compararon según la Dócima de Rangos Múltiples de Duncan para p<0.05, con el paquete estadístico INFOSTAT Profesional ver. 2.1 (19).
RESULTADOS Y DISCUSIÓN
Los diez aceites evaluados provocaron 100% de inhibición en el crecimiento micelial de A. solani (efecto por contacto directo) en los primeros 7 días, excepto en el tratamiento (C. sinensis) donde se evidenció efecto fungistático.
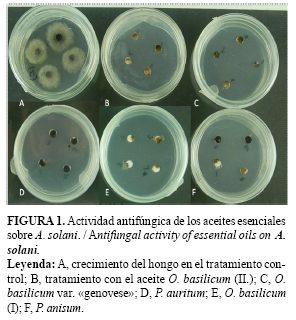
Al concluir la segunda fase de evaluación a los 14 días, se observó que los tratamientos provenientes de P. anisum, O. basilicum (I y II), O. basilicum variedad genovese y P. auritum mostraron efecto fungicida (Fig. 1). Los cinco aceites restantes presentaron efecto fungistático con un bajo porcentaje de inhibición. No obstante, es necesario profundizar en el efecto que se observó y determinar si los productos naturales evaluados producen solo una inhibición del crecimiento o la muerte del microorganismo.
La acción antifúngica de aceites esenciales sobre Alternaria spp. se estudió con anterioridad. Así por ejemplo, Mishra et al. (20), informaron que extractos y aceites esenciales de Muralla koenigii Linn inhibieron al hongo A. solani utilizando el método de difusión en disco. Mientras Nehal (21) informó que el aceite de Dianthus caryophyllus L. (clavel) (1%) provocó 100% de inhibición del crecimiento micelial de este hongo. Por su parte, aceites esenciales de melaleuca, albahaca y anís inhibieron el crecimiento de Alternaria porris (Ellis) Cif. (22).
La caracterización del efecto biológico de los aceites esenciales permitirá seleccionar los candidatos con mayores posibilidades para la obtención de un producto efectivo en condiciones de campo. La efectividad de los aceites esenciales puede estar asociada a la acción de sus vapores, por ello es importante definir la contribución de estos en el efecto observado en el bioensayo por contacto directo.
En la Tabla 1 se muestran los valores del crecimiento de A. solani a los 5 días bajo el efecto de los metabolitos volátiles de los aceites. Ninguno de los tratamientos mostró efecto fungicida. Las esencias de R. chalepensis y P. auritum evidenciaron efectos fungistáticos sobre el patógeno. Los restantes aceites estimularon el crecimiento micelial del hongo fitopatógeno (Fig. 2). Resultados similares obtuvieron Pupo et al. (23), con aceites esenciales de flores de Tagetes erecta L. y hojas de Lepianthes peltata (L.) Raf., los cuales estimularon el crecimiento de A. solani.
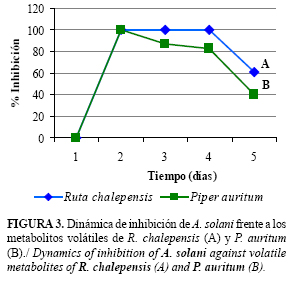
Para los aceites esenciales R. chalepensis y P. auritum, que mostraron efecto fungistático sobre el fitopatógeno, se determinó la dinámica de inhibición diaria (Fig.3).
Los metabolitos volátiles de R. chalepensis (Fig. 3A), produjeron 100% de inhibición del crecimiento de A. solani desde el segundo día hasta el cuarto, disminuyendo a 60,6 % de inhibición al 5to día. Mientras que los metabolitos volátiles de P. auritum (Fig. 3B), inhibieron el crecimiento del patógeno al segundo día, a partir del cual los valores de inhibición decrecen llegando al quinto día a 40,1%.
Se evidenció que el efecto inhibidor sobre la velocidad de crecimiento fue diferente para cada aceite, aunque existió una tendencia a que la mayor acción biológica se manifieste durante los primeros 4 días de exposición. Este comportamiento pudiera estar asociado a la cinética de evaporación del aceite que conlleva a una mayor concentración de vapores durante el periodo inicial de evaluación. Otro aspecto que pudiera influir, son los cambios en el tiempo de la composición cuantitativa de los compuestos bioactivos en la fase vapor de los aceites. Los resultados obtenidos se relacionan con las características de los aceites esenciales como sustancias volátiles que producen un efecto biológico a corto plazo y poseen baja residualidad (24).
Estudios posteriores deberán profundizar en el modo de acción de estos aceites esenciales y sus componentes para definir las causas del efecto observado en cada caso. Los estudios de modo de acción de aceites esenciales en hongos son escasos, entre los existentes se refiere que el efecto antifúngico de algunos productos naturales está asociado a afectaciones en la síntesis de la pared de las hifas (22).
De los aceites estudiados, los de P. anisum, P. auritum y O. basilicum (I y II), mostraron efecto fungicida sobre A. solani. Los vapores de las esencias de R. chalepensis y P. auritum evidenciaron un efecto fungistático sobre el crecimiento de las colonias. El aceite de P. auritum se destacó por un efecto antimicrobiano por contacto y por exposición a los vapores, elementos que lo señalaron como el candidato más promisorio para el desarrollo de un producto natural para el manejo del tizón temprano.
El uso de los fungicidas sintéticos se ha visto desfavorecido por sus efectos negativos sobre organismos no diana y la contaminación ambiental y varias investigaciones se han realizado para explorar el potencial de aceites esenciales como agentes antifúngicos. Si los productos naturales revelan efectos biológicos promisorios, como los evidenciados por los aceites esenciales estudiados, entonces poseen potencial como alternativas ambientalmente seguras en el manejo de hongos fitopatógenos.
REFERENCIAS
1. Pérez L, García A. Enfermedades fungosas y bacterianas de la papa: descripción, epidemiología y manejo. En: Estévez, A (Ed.) El cultivo de la papa en Cuba. Ediciones INCA. La Habana; 2005:338-480.
2. Veitía N, Alvarado-Capó Y, García LR, Bermúdez-Caraballoso I, Leiva-Mora M. Aplicación de la selección in vitro en el mejoramiento genético de la papa para la resistencia al Tizón temprano. Biotecnología Vegetal. 2008;8(1):3-14.
3. Rueda A, Shelton AM. Tizón Temprano del Tomate. Cornell International Institute for Food, Agriculture and Development. Global Crop Pests. 1996 [consultado 19 marzo 2011] Disponible en: http://web.entomology.cornell.edu/shelton/veg-insects -global/spanish/eblight.html
4. Martínez S, Snowdon R, Kuhnemann P. Variability of Cuban and international populations of Alternaria solani from different hosts and localities: AFLP genetic analysis. European Jour Plant Pathol. 2004;110:399-409.
5. Castellanos L. Nocividad, epidemiología y manejo del tizón temprano (Alternaria solani Sor.) en el cultivo de la papa. [Tesis para optar por el grado de Doctor en Ciencias]. Universidad Central de Las Villas; 2000.
6. Peteira B, León O. Interacciones hospedante patógeno: logros y perspectivas en Cuba. Rev Protección Veg. 2011;26(3):137-143.
7. Rodríguez MAD, Brommonschenkel SH, Matsuoka K, Mizubuti ESG. Components of resistance to early blight in four potato cultivars: Effect of leaf position. Phytopathology. 2006;154:230-235.
8. Reinoso Y, Vaillant D, Casadesús RL, García PE, Pazos V. Selección de cepas de Bacillus y otros géneros relacionados para el control biológico de hongos fitopatógenos. Fitosanidad. 2007;11(1):35-40.
9. Villa P, Stefanova M, Frías A, Díaz de Villegas ME, Bell A, Torres E, et al. Producción de un biofungicida a partir de Pseudomonas aeruginosa cepa PSS, efectivo en el control de hongos fitopatógenos. Experiencia cubana. 2006;10(2):146-147.
10.Rodríguez F, Stefanova NM. Control biológico del tizón temprano (Alternaria solani Sorauer) en el cultivo de la papa (Solanum tuberosum L.) en condiciones de campo. Fitosanidad. 2005;9(4):35-37.
11.Martínez B, Solano T. Antagonismo de Trichoderma spp. frente a Alternaria solani (Ellis y Martin) Jones y Grout. Rev Protección Veg. 1995;10:221-225.
12.Koul O, Cuperus GW. Ecologically Based Integrated Pest Management: Present Concept and New Solutions. CAB International. ISBN-13: 978 184593 064 6. 2007. 1-17p.
13.Farooq M, Jabran K, Cheema ZA, Wahid A, Siddique AHM. The role of allelopathy in agricultural pest management. Pest Manag Sci. 2011;67:493-506.
14.Luna LA, Lara G. Aleopatía y extractos vegetales: alternativa para el manejo de insectos, plagas y enfermedades en cultivos. 2007. Boletín Técnico. Corporación Colombiana de Investigación Agropecuaria, CORPOICA. 21pp. SBN: 978-958-8311-55-5
15.Pino O, Sánchez Y, Rojas M, Rodríguez H, Abreu Y, Duarte Y, et al. Composición química y actividad plaguicida del aceite esencial de Melaleuca quinquenervia (Cav.) S.T. Blake. Rev Protección Veg. 2011;26(3):177-186.
16.International Standarization Organization. ISO 65-71. Spices, condiments and herbs. Determination of volatile oil content. 1984. (Norma ISO).
17.Martínez B, Bernal A, Pérez S, Muñiz Y. Variabilidad patogénica de aislamientos de Alternaria solani Sor. Rev Protección Veg. 2002;17(1):45-53.
18.Abbott W S. A method of computing the effectivenses of an insecticide. J Econ Entomol. 1925;18:264-267.
19.Di Rienzo J, Balzarini M, González L, Tablada M, Guzmán W, Robledo C, et al. InfoStat Profesional versión 2.1. Universidad Nacional de Córdoba. Argentina. 2009. Disponible en: http://www.infostat.com.ar
20.Manoj Mishra K, Ram VS, Mahesh G, Narendra P, Kailash P. Anti-fungal potencial of leave extracts of Muralla koenigii .International J Research in Ayurvela Farmacy. 2010;1(2):549-552.
21.Nehal S. El-Mougy. Effect of some essential oils for limiting early blight (Alternaria solani) development in potato field. Jour Plant Protection Research. 2009;49(1):58-62.
22. Thaker VS, Pawar VC. Evaluation of the anti-Fusarium oxysporum f. sp cicer and anti-Alternaria porri effects of some essential oils. World J Microbiol Biotechnol. 2007;23:1099-1106.
23.Pupo Yoannia Gretel, Kalombo D, Herrera L, Malheiros de Mendonca Dina Isabe, Vargas Belyani. Efecto de extractos vegetales en el crecimiento y germinación de esporas de Alternaria solani (E. & M.) J. & G. en condiciones in vitro. Rev Iberoam Micol. 2011;28(1):60.
24.Isman MB. Botanical insecticides, deterrents, and repellents in modern agriculture an increasingly regulated world. Annu Rev Entomol. 2006;51:45-66.
Recibido: 3-4-2012.
Aceptado: 9-11-2012.