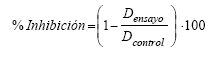Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Protección Vegetal
versión impresa ISSN 1010-2752
Rev. Protección Veg. vol.28 no.2 La Habana mayo-ago. 2013
ARTÍCULO ORIGINAL
Actividad antagónica in vitro de Tsukamurella paurometabola C-924 frente a fitopatógenos
In vitro antagonistic activity of Tsukamurella paurometabola C-924 against phytopathogens
Marieta MarínI, Idania WongI, Graciela GarcíaII, Rolando MoránI, Rosa BasultoI, Eulogio PimentelI, Jesús MenaI
ICentro de Ingeniería Genética y Biotecnología, Circunvalación Norte y Avenida Finlay, CP 70100. Camagüey, Cuba. E-mail de contacto: marieta.marin@cigb.edu.cu.
IILaboratorio Provincial de Sanidad Vegetal de Camagüey, Cuba.
RESUMEN
El objetivo de este trabajo fue determinar las potencialidades de Tsukamurella paurometabola cepa C-924 como agente de control biológico de hongos fitopatógenos. Se evaluó el efecto de la bacteria sobre siete especies de hongos fitopatógenos a través de ensayos in vitro utilizando los medios Agar Triptona Soya (ATS) y Agar Papa Dextrosa (PDA). La actividad antagónica se determinó cada 24 horas midiendo el diámetro de las colonias de los hongos en presencia de la bacteria, determinando posteriormente los porcentajes de inhibición del crecimiento micelial con relación al control. Se evidenció que T. paurometabola C-924 tuvo actividad antagónica en ambos medios. Los mayores valores de inhibición se produjeron en el medio ATS, sobre Alternaria longipes (Ellis y Everh.), Bipolaris oryzae (Breda de Haan), Colletotrichum gloeosporioides (Penz.), Fusarium oxysporum f. sp. cubense (E.F. Sm.), Pestalotia palmarum (Cooke) y Thielaviopsis paradoxa (De Seynes). En ambos medios de cultivo el menor porcentaje de inhibición se observó frente a Pythium debaryanum (R. Hesse). Los resultados sugieren que T. paurometabola C-924 posee potencialidades in vitro como antagonista de los hongos fitopatógenos estudiados.
Palabras clave: Alternaria longipes, Bipolaris oryzae, Colletotrichum gloeosporioides, Fusarium oxysporum f. sp. cubense, Pestalotia palmarum, Thielaviopsis paradoxa, Pythium debaryanum, antagonismo.
ABSTRACT
The aim of this work was to determine the potential of Tsukamurella paurometabola C-924 as a biological control agent of phytopathogenic fungi by its in vitro evaluation on the culture media Agar Triptone Soy (ATS) and Potato Dextrose Agar. The antagonistic activity was determined by measuring the diameter of the fungal colonies grown in presence of the bacterium every 24 hours; the inhibition percentages were calculated by comparing each diameter of these colonies with those of their respective controls grown in absence of the bacterium. T. paurometabola C-924 showed an antagonistic activity on both culture media. The highest inhibition values were determined on ATS against Alternaria longipes (Ellis and Everh.), Bipolaris oryzae (Breda de Hann), Colletotrichum gloesporioides (Penz). Fusarium oxysporum f. sp. cubense (E.F. Sm), Pestalotia palmarum (Cooke) and Thielaviopsis paradoxa (De Seynes). On both culture media, the lowest inhibition percentage was found against Pythium debaryanum (R. Hesse). The results suggested that T. paurometabola C924 had in vitro potential as an antagonistic agent against the phytopathogenic fungi tested.
Key words: Alternaria longipes, Bipolaris oryzae, Colletotrichum gloeosporioides, Fusarium oxysporum f. cubense, Pestalotia palmarum, Thielaviopsis paradoxa, Pythium debaryanum, antagonism.
INTRODUCCIÓN
El uso extensivo de los plaguicidas químicos en la agricultura no impidió que cada año las enfermedades causadas por hongos fitopatógenos provoquen pérdidas de millones de dólares en los cultivos de todo el mundo (1). Asimismo, los problemas medioambientales de la actualidad, unidos al desarrollo de poblaciones de fitopatógenos resistentes, redujeron la disponibilidad de fungicidas efectivos. En este contexto se incrementó en la última década el interés por los agentes de control biológico, los que emergieron como componente importante del manejo integrado de plagas.
Diferentes productos comercializados para el control biológico de plagas agrícolas usan un único agente de biocontrol como antagonista de una determinada especie fitopatógena, lo que frecuentemente se informó como una de las causas de inconsistencia de las formulaciones (2). Aunque la alta especificidad de los biocontroladores es un elemento favorable en cuanto a su seguridad ambiental, en ocasiones esto se convierte en una de las principales limitantes para su explotación comercial. Es por esto que las tendencias actuales en el desarrollo de inoculantes microbianos se encaminan a la búsqueda de cepas multifacéticas de amplio espectro de acción sobre varias dianas (3).
Entre los mecanismos de control biológico expresados por rizobacterias y ampliamente reconocidos se encuentran: competencia por un nicho ecológico o sustrato, inducción de resistencia sistémica en las plantas (4,5), así como la síntesis de compuestos inhibitorios como sideróforos, antibióticos, enzimas líticas y detoxificadoras (6). Se comprobó que la producción de estos compuestos antifúngicos depende en gran medida del medio empleado para cultivar el agente de biocontrol (7).
En el Centro de Ingeniería Genética y Biotecnología de Camagüey (CIGB) (Cuba), se obtuvo a partir de una muestra de suelo rizosférico de plátano (Musa spp.) la bacteria Tsukamurella paurometabola cepa C-924. Esta especie, que pertenece al orden de los Actinomycetales, agrupa bacilos irregulares, Gram positivos, no móviles, con metabolismo aerobio estricto (8). La cepa obtenida mostró ser un control eficaz de nematodos parásitos de plantas en diferentes sistemas agrícolas y constituye el principio activo del producto HeberNem®, registrado como bionematicida y biofertilizante (9).
El objetivo de este trabajo fue evaluar, mediante ensayos in vitro en dos medios de cultivo, las potencialidades de T. paurometabola C-924 como agente de control biológico de hongos fitopatógenos.
MATERIALES Y MÉTODOS
Cultivos microbianos: Se emplearon cepas de los hongos fitopatógenos: Alternaria longipes (Ellis y Everh.), Bipolaris oryzae (Breda de Haan), Colletotrichum gloeosporioides (Penz.), Fusarium oxysporum f. sp. cubense (E.F. Sm.), Sarocladium oryzae (Sawada), Pestalotia palmarum (Cooke), Pythium debaryanum (R. Hesse), Rhizopus stolonifer (Ehrenb.) y Thielaviopsis paradoxa (De Seynes), procedentes del cepario del Laboratorio Provincial de Sanidad Vegetal de Camagüey (Cuba) y conservadas en tubos de cultivo con medio Agar Papa Dextrosa (PDA) BioLife (4ºC).
La cepa T. paurometabola C-924 se obtuvo del cepario del CIGB (Camagüey), donde se encontraba conservada en medio Caldo Triptona Soya (CTS) BioLife con glicerol al 20% a -70ºC.
Ensayo de antagonismo: Para preparar los inóculos, colonias aisladas de T. paurometabola C-924 se inocularon en cultivos de 10 ml de medio CTS, que se incubaron a 37ºC durante 16 horas a 250 rpm. Los hongos se cultivaron en placas con PDA a 30ºC y se dejaron crecer durante cinco días previos al ensayo.
Del cultivo bacteriano que tenía una concentración aproximada de células de 108 unidades formadoras de colonias (ufc) . ml-1 se tomaron 100 µl y se sembraron por diseminación mediante espátula de Drigalsky en placas Petri con medio PDA (pH 5,6 ± 0,2).
Las placas con los hongos previamente crecidos se perforaron utilizando un obturador de 6 mm de diámetro. Los discos se colocaron en el centro de las placas sembradas con la bacteria, a razón de un disco para cada placa y tres réplicas (placas) por tratamiento, luego se incubaron a 30ºC durante siete días. El mismo procedimiento se realizó en placas de ATS a pH 7,3 ± 0,2.
La evaluación consistió en mediciones del diámetro de las colonias de los hongos crecidos en presencia de la bacteria. Se calculó el porcentaje de inhibición al compararlo con un control (ausencia de bacteria). Para ello se empleó la siguiente fórmula:
Donde Densayo indica el diámetro de la colonia del hongo en presencia de la bacteria y Dcontrol indica diámetro de la colonia del hongo en el tratamiento control.
Procesamiento estadístico: A los porcentajes de inhibición se les realizó la prueba de normalidad de Shapiro y Wilks (10) y la prueba de homogeneidad de varianza, a partir de las cuales se determinó realizar análisis no paramétricos. Los datos se procesaron mediante la prueba no paramétrica de comparación múltiple de Kruskal-Wallis seguido de la prueba de comparación múltiple de medias no paramétrica de Student-Newman-Keuls (SNK), utilizando el paquete estadístico STATISTIC versión 6.0.
RESULTADOS
La cepa bacteriana C-924 de T. paurometabola resultó antagónica, en mayor o menor medida, a todos los fitopatógenos en ambos medios de cultivos, con valores máximos de inhibición del crecimiento micelial hacia el quinto día de incubación, donde el hongo más afectado por la bacteria en ambos medios fue P. palmarum, resultando Pyt. debaryanum el fitopatógeno menos afectado.
Los mayores porcentajes de inhibición se produjeron en todos los hongos cuando la bacteria creció en ATS en comparación a los expresados en PDA, donde los valores de inhibición en todas las cepas de fitopatógenos estuvieron cercanos o inferiores al 50% (Figura 1).
El crecimiento de la bacteria en el medio PDA fue pobre y lento, pero a pesar de ello, el crecimiento de los hongos en ese medio en presencia de T. paurometabola C-924 también fue pobre o se produjeron cambios en la morfología de las colonias (Figura 2). De manera general se observó inhibición del crecimiento, formación de hifas distorsionadas y liberación de pigmentos al medio.
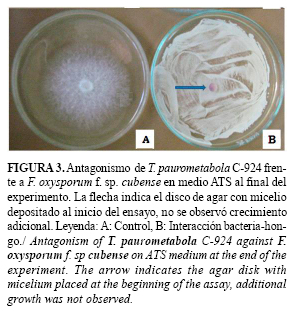
En el medio ATS se observó un fuerte efecto inhibitorio de la bacteria sobre los hongos. Al comparar los porcentajes de inhibición calculados en este medio, no se encontraron diferencias significativas entre las cepas fitopatógenas, excepto para Pyt. debaryanum sobre el que T. paurometabola C-924 tuvo un efecto menor. Para el resto de los hongos solo se mantuvo el disco de micelio depositado sobre las placas al comienzo del ensayo sin ningún crecimiento adicional (Figura 3).
DISCUSIÓN
El mayor efecto observado en medio ATS, en relación con PDA, podría estar relacionado con las características propias de ambos medios de cultivo (pH y composición aminoacídica).
El medio PDA con pH de 5,6 ± 0,2, fue poco favorable para T. paurometabola C-924, que creció mejor en ATS de pH neutro. Por otra parte, el ATS es un medio con un alto contenido de nitrógeno, rico en aminoácidos que estimulan el crecimiento de esta cepa que posee gran afinidad por los sustratos proteicos (11).
Las variaciones en los componentes nutricionales de los medios de cultivo y en sus condiciones de incubación, poseen efecto directo sobre la producción de metabolitos secundarios por parte de la bacteria, como aquellos compuestos con actividad antifúngica. Este efecto involucra cambios, tanto en la cantidad, como en la composición de estos compuestos (12), lo que podría explicar las diferencias encontradas en cuanto a la actividad antagónica de T. paurometabola C-924 en los dos medios evaluados. Resultados similares informaron Dilantha et al. (13) quienes ensayaron diferentes cepas de Pseudomonas spp. frente a Sclerotinia sclerotiorum (Lib.) y obtuvieron mayor actividad antifúngica (inhibición de micelios y esclerocios) en los tratamientos donde la bacteria creció en ATS que en medio Agar Nutriente. De igual forma se demostró que cambios en el pH y componentes del medio de cultivo tuvieron influencia directa sobre la actividad de Burkholderia cepacia frente a Trichoderma viride (Pers.) (14).
El crecimiento en un medio de cultivo apropiado es un elemento indispensable para alcanzar el estadio fisiológico adecuado para que un agente microbiano realice su actividad biocontroladora de manera óptima (15), en este sentido el medio ATS resultó un medio favorable para la expresión de la actividad antifúngica de T. paurometabola C-924.
Las rizobacterias producen una gran variedad de compuestos con actividad antimicrobiana que son empleados como sistemas de defensa. En estudio previos, se demostró que T. paurometabola C-924 produce quitinasas y proteasas extracelulares (9), lo que podría estar estrechamente relacionado con la actividad antifúngica demostrada por la cepa en este estudio. El género Pythium no presenta quitina en su pared celular. P. debaryanum pertenece a la clase Oomycota, del reino Stramenopila (18) . Aunque anteriormente fueron clasificados como hongos por sus semejanzas morfológicas y fisiológicas con estos, en realidad no lo son. Se diferencian entre otras características en que sus paredes celulares están compuestas por b-1,3-glucano, b-1,6-glucano y b-1,4-glucano (celulosa) y carecen de quitina o la presentan en muy baja proporción (17). De igual forma son más resistentes a los tóxicos y antibióticos producidos por plantas y bacterias que los hongos verdaderos (18). Son estas particularidades las que podrían explicar el bajo porcentaje de inhibición relativo al crecimiento micelial observado en el ensayo frente a T. paurometabola C-924.
Rizobacterias representantes de los géneros Azotobacter, Bacillus, Enterobacter, Paenibacillus y Pseudomonas exhibieron potencialidades antagónicas frente a hongos fitopatógenos (19). Entre los actinomicetos (grupo al que pertenece el género Tsukamurella), se notificó Streptomyces como colonizador de la rizosfera y capaz de ejercer control sobre hongos fitopatógenos, además de poseer caracteres estimuladores del crecimiento vegetal (20).
In vitro, T. paurometabola C-924 demostró potencialidades como antagonista de A. longipes, B. oryzae, C. gloeosporioides, F. oxysporum, S. oryzae, P. palmarum, Pyt. debaryanum, R. stolonifer y T. paradoxa, especies fúngicas que son agentes causales de enfermedades en cultivos de interés económico como: antracnosis, pudrición de frutos, de raíces, el carbón de la cebolla, manchas foliares, disminución de la germinación y muerte de plántulas en semilleros, entre otras (21).
En Cuba, particularmente en la agricultura urbana, los hongos fitopatógenos del suelo como F. oxysporum y Pythium sp., se listan entre las especies de mayor importancia para semilleros, viveros y plantaciones donde afectan el sistema radicular y el tallo de las plantas (22).
Sería recomendable investigar la capacidad antagonista de T. paurometabola C-924 frente a otras especies y géneros de hongos fitopatógenos y de igual forma valorar en ensayos de campo su potencial uso como controlador de hongos en la agricultura.
REFERENCIAS
1. Ahmadzadeh M, Tehrani A. Evaluation of fluorescent pseudomonas for plant growth promotion, antifungal activity against Rhizoctonia solani on common bean, and biocontrol potential. Biol Control. 2009;48:101-107.
2. Guetsky R, Shtienberg D, Elad Y, Fischer E. Improving biological control by combining biocontrol agents each with several mechanisms of disease suppression. Phytopathol. 2002;92:976-985.
3. Banerjee MR, Yesmin L, Vessey JK. Plant growth- promoting rhizobacteria as biofertilizers and biopesticides, In: Rai, M.K. (Ed.), Handbook of microbial biofertilizers. Food Products Press, Ney York. 2006. pp. 137-181.
4. Avis T, Gravel V, Antoun H, Tweddell R. Multifaceted beneficial effects of rhizosphere microorganisms on plant health and productivity. Soil Biol & Biochem. 2008;40:1733-1740.
5. Donmez MF, Esitken A, Yildiz S. Biocontrol of Botrytis cinerea on strawberry fruit by plant growth promoting bacteria. Jour Anim Plant Sci. 2011;21:758-763.
6. Bhattacharyya PN, Jha DK. Plant growth-promoting rhizobacteria (PGPR): emergence in agriculture. World Jour Microbiol Biotechnol. 2012;28:1327-1350.
7. Heidari-Tajabadi F, Ahmadzadeh M, Moinzadeh A, Khezri M. Influence of some culture media on antifungal activity of Pseudomonas fluorescens UTPF61 against the Sclerotinia sclerotiorum. Afr Jour Agric Res. 2011;6(30):6340-6347.
8. Holt GJ, Krieg RN, Snaeth PH, Staley JT, Wiliams ST. Bergey's Manual of Determinative Bacteriology. Editorial Wiliams & Wilkins. Baltimore. USA. 1994. 9na Edición.
9. Mena J, Pimentel E, Marín M, Hernández A, Sánchez I, Ramírez Y, et al. Composición biofertilizante. Centro de Ingeniería Genética y Biotecnología. Patentet Oficial WO 2008/131699. Nov 6, 2008.
10.Shapiro SS, Francia RS. An approximate Analysis of Variance Test for Normality. Jour American Statistical Association. 1972;67:215-216.
11.González N, Wong I, Pimentel E, Zamora J, Salazar E, Mena J. Expresión de proteasas extracelulares en el cultivo de alta densidad del microorganismo con actividad bionematicida Tsukamurella paurometabola C-924. Tecnología Química (Cuba). 2009;XXIX(2):83-90.
12.González S, Rojas TI. Actividad antifúngica in vitro de dos productos residuales de la caña de azúcar. Contribución a la Educación y la Protección Ambiental. Editorial Academia. 1999; p. 91-93.
13.Dilantha WG, Ramarathnam R, Akkanas S, Savchuk S. Identification and use of potential bacterial organic antifungal volatiles in biocontrol. Soil Biol & Biochem. 2005;37:955-964.
14.Parra E, Centeno S, Araque Y. Actividad antifúngica de Burkholderia cepacia aislada de maíz amarillo (Zea mays L.) bajo diferentes condiciones de cultivo. Rev Soc Ven Microb. 2009;29:103-109.
15.Bae YS, Park K, Choi OH. Laboratory culture media-dependent biocontrol ability of Burkholderia gladioli strain B543. Plant Pathol J. 2007;23(3):161-165.
16.Beneduzi A, Ambrosini A, Passaglia L. Plant growth-promoting rhizobacteria (PGPR): Their potential as antagonists and biocontrol agents. Gen Mol Biol. 2012;35(4 suppl):1044-1051.
17.Al-Saida FA, Al-Jabria AH, Al-Mahmoolia IH, Al-Hinaib AH. Occurrence and characterization of fungi and oomycetes transmitted via potting mixtures and organic manures. Crop Protection 2011;30(1):38-44.
18.van West P, Appiah A, Gow N. Advances in research on oomycete root pathogens. Physiol Mol Plant Pathol. 2003;62:99-113.
19.Ekundayo E, Adetuyi Ekundayo F. In vitro antifungal activities of bacteria associated with maize husks and cobs. Res J Microbiol. 2011;6(4):418-424.
20.Franco-Correa M, Quintana A, Duque C, Suarez C, Rodríguez MX, Barea JM. Evaluation of actinomycete strains for key traits related with plant growth promotion and mycorrhiza helping activities. Appl Soil Ecol. 2010;5(3):209-217.
21.Nawaf H, Talip A, Mohammed H. The biological activity of some Pseudomonas sp. isolates on growth of three plant pathogenic fungi under incubator conditions. Advances in Environmental Biology. 2010;4(1):53-57.
22.Vázquez L, Fernández E. Principales problemas fitosanitarios. Bases para el manejo agroecológico de plagas en sistemas agrarios urbanos. Editorial CIDISAV. Cuba. 2007. 1ra Edición. p 17-19.
Recibido: 5-11-2012.
Aceptado: 31-1-2013.