Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de Protección Vegetal
versão impressa ISSN 1010-2752
Rev. Protección Veg. vol.29 no.1 La Habana jan.-abr. 2014
COMUNICACIÓN CORTA
Antagonismo in vitro de cepas bacterianas frente a Macrophomina phaseolina Tassi (Goid)
In vitro antagonism of bacterial strains against Macrophomina phaseolina Tassi (Goid)
Mileidy Cruz-Martín*, Cynthia Sánchez-García, Mayra Acosta-Suárez, Michel Leiva-Mora, Yosbel Hernández Durán, Berkis Roque, Yelenys Alvarado-Capó
Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5. Santa Clara. Villa Clara. Cuba. CP 54 830. *Correo electrónico: mileidy@ibp.co.cu.
RESUMEN
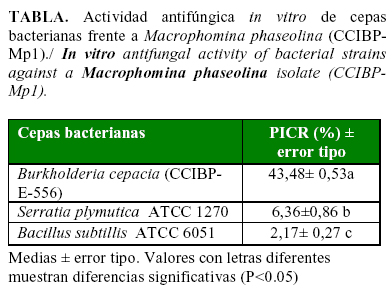
Se evaluó el control in vitro de Burkholderia cepacia (cepa CCIBP-E-556), Serratia plymuthica (cepa ATCC 1270) y Bacillus subtilis (cepa ATCC 6051), sobre Macrophomina phaseolina (Tassi) Goid, utilizando el método de cultivo dual.Se midió el radio de la colonia del hongo y se determinó el porcentaje de inhibición del crecimiento radial. B. cepacia produjo el mayor efecto sobre el aislado de M. phaseolina, provocando un porcentaje de inhibición del 43,5%, y ocasionando cambios en la apariencia del micelio, que se observaron en la zona de inhibición con el uso del microscópico óptico. Por su parte, S. plymuthica y B. subtilis provocaron valores de inhibición del crecimiento micelial en M. phaseolina por debajo del 10%, lo que indica que dichas cepas no poseen potencial como agentes de control biológico de este fitopatógeno. Se deben efectuar estudios posteriores con la cepa de B. cepacia a nivel de casa de cultivo y campo, para determinar su utilidad en el control biológico del fitopatógeno.
Palabras clave: actividad antifúngica, biocontrol, Burkholderia cepacia, Serratia plymuthica, Bacillus subtilis, frijol, Phaseolus vulgaris, fitopatógeno.
ABSTRACT
The in vitro control of strains of Burkholderia cepacia, Bacillus subtilis and Serratia plymuthica against Macrophomina phaseolina (Tassi) Goid was evaluated by the dual culture method. The radius of the fungal colony was measured, and the inhibition percentage of the radial growth determined. The B. cepacia strain showed the strongest inhibitory effect on the M. phaseolina isolate with a 43.5% of inhibition, also causing changes in the mycelium appearance on the inhibition zone, which were observed with the optical microscope. S. plymuthica and B. subtilis showed values of mycelia growth inhibition lower than 10% indicating that these strains were not useful as biological controls of this pathogen. Greenhouse and field studies on the B. cepacia strain are required to determine its potential use as a biological control agent of the pathogen.
Key words: antifungal activity, biocontrol, Burkholderia cepacia, Serratia plymuthica, Bacillus subtilis, common beans, Phaseolus vulgaris, phytopathogen.
Dentro del grupo de las leguminosas que poseen semillas comestibles, el frijol común (Phaseolus vulgaris L.) es uno de las más importantes en el mundo. Actualmente se encuentra distribuido en los cinco continentes y es componente esencial de la dieta, especialmente en Centroamérica y Sudamérica (1). En Cuba, se produce en todo el país, pues representa un producto de alta demanda, debido al hábito de consumo y necesidades nutritivas, constituyendo la principal fuente proteica de origen vegetal al alcance de la mayoría de la población (2).
La producción de frijol es afectada por muchos factores como, baja fertilidad del suelo, presencia de plagas y su conservación. En Cuba, el descenso de los rendimientos de este grano se originó, fundamentalmente, por el déficit nutricional y la incidencia de plagas (3).
El fitopatógeno Macrophomina phaseolina (Tassi) Goid es un microorganismo que habita el suelo, infecta más de 500 especies de plantas y tiene amplia distribución geográfica (4). Las semillas de las legumbres pueden diseminar el hongo en su cubierta. Cuando están infectadas, no germinan o se produce la muerte de las plántulas poco después de la germinación, constituyendo causa de descalificación de estas como material vegetal de propagación.
En Cuba, la presencia en semillas de frijol contaminadas con M. phaseolina origina la descalificación de granos como material de siembra. Un ejemplo de ello, fue lo ocurrido en los años 2009 y 2010, donde solo en la Provincia Villa Clara se desecharon 5,5t de semillas de frijol común que no se utlizaron para nuevas plantaciones.
El combate eficaz de M. phaseolina, resulta difícil, pues los tratamientos basados en el uso de fungicidas, incidieron negativamente en la nodulación de las leguminosas por la acción de bacterias fijadoras de nitrógeno (5), por lo que resulta imprescindible erradicarlo de las semillas, previo a la siembra.
Una de las alternativas empleadas para garantizar que las semillas estén libres de patógenos fúngicos en el momento de la siembra es el uso del control biológico, estrategia bien documentada en varios cultivos (6).
El empleo de Trichoderma spp ., agente de control biológico por excelencia, resultó exitosa en el control de otros fitopatógenos del suelo como Sclerotium rolfsii Sacc., Rhizoctonia solani Kühn y Pythium spp. (7,8). En relación a M. phaseolina se refirió que sus estructuras pueden ser afectadas por Trichoderma (6,9,10).
Las rizobacterias también se estudiaron como agentes de control biológico para este patógeno. Sing et al. (11) aislaron Bacillus subtilis (BN1) de la rizofera de Pinus roxburghii que resultó ser efectiva en el manejo de M. phaseolina. En general, muchas bacterias son objeto de investigaciones por la capacitad que tienen de promover el crecimiento de las plantas, ya sea directamente, por la facilitación de adquisición de nutrientes o modulación de los niveles de las fitohormonas, o indirectamente, por la disminución de los patógenos (12).
Teniendo en cuenta estos criterios, este trabajo tuvo como objetivo determinar el efecto antifúngico de cepas bacterianas frente a una cepa de M. phaseolina aislada de semillas de frijol.
Se evaluaron tres cepas bacterianas: Burkholderia cepacia (cepa CCIBP-E-556), identificada a través de técnicas bioquímicas tradicionales y de análisis de ácidos grasos (13); Serratia plymuthica (cepa ATCC 1270) y Bacillus subtilis (cepa ATCC 6051) estas últimas, pertenecientes a la colección americana de cultivos tipo. Por su parte, el aislado de M. phaseolina (CCIBP-Mp1) empleado en el ensayo, se obtuvo, a partir de semillas de frijol infectadas, provenientes de fincas particulares ubicadas en el municipio de Camajuaní, Villa Clara, Cuba. Todos estos microorganismos forman parte de la Colección de Cultivos Microbianos del Instituto de Biotecnología de las Plantas (IBP, Cuba).
Para la evaluación de la actividad antifúngica in vitro de las cepas bacterianas frente a M. phaseolina se utilizó el método de cultivo dual (14).
Se inoculó una suspensión bacteriana a una concentración de 109 ufc.ml-1 de cada una de las cepas, en forma de estría en un bode de la placa Petri (90 mm Ø) con medio de cultivo Agar Papa Dextrosa (PDA, Spectrum). Se dejó que la humedad de los inóculos fuese absorbida por el medio de cultivo y se colocó un disco de micelio (6 mm) del fitopatógeno, obtenido a partir de colonias de 7 días de cultivo, a una distancia de 70 mm del cultivo bacteriano. Se analizaron tres réplicas por cada cepa bacteriana y se empleó agua desionizada estéril como control, siguiendo el mismo procedimiento. Las placas se incubaron en la oscuridad, a 28ºC durante 120h.
Al concluir el tiempo de incubación, se midió el radio de la colonia del hongo con una regla graduada, tanto en los tratamientos como en los controles y se determinó el porcentaje de inhibición del crecimiento radial (PICR) según Rahman et al. (15).
PICR= ((R1- R2)/R1) 100
donde: R1- radio de la colonia del patógeno en ausencia de la bacteria y R2- radio de la colonia del patógeno en presencia de la bacteria
Los valores de PICR se compararon con un análisis no paramétrico mediante la prueba de Kruskal-Wallis, para ello se empleó el paquete estadístico SPSS para Windows versión 19.0.
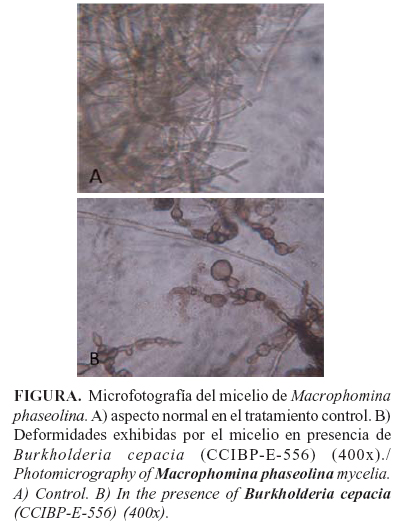
La cepa de B. cepacia CCIBP-E-556 mostró actividad antifúngica frente a M. phaseolina (CCIBP-Mp1), inhibiendo en 43,5% el crecimiento radial (Tabla). Esta cepa provocó cambios en la apariencia del micelio del hongo fitopatógeno, el que se observó de color blanco y sin formación de esclerocios. Por su parte, B. subtillis ATCC 6051 y S. plymuthica ATCC 1270, no mostraron efecto antifúngico significativo frente a M. phaseolina.
Numerosos autores refirieron la eficacia de aislados de B. cepacia para el control de hongos fitopatógenos (15, 16,17). Por ejemplo, Rahman et al. (15), seleccionaron cepas de B. cepacia que mostraron una adecuada capacidad biocontroladora sobre Colletotrichum gloesporioides (Penz.) Penz. & Sacc. en Carica papaya L., pues inhibió la germinación del 100% de los conidios del hongo fitopatógeno en sólo 24h. De igual modo, Satya et al. (18) encontraron que Burkholderia sp. (TNAU-1) redujo significativamente la incidencia de M. phaseolina en plantas de Vigna radiata L., lo que provocó un incremento en los porcentajes de germinación y tamaño de las plantas, cuando las aplicaciones se realizaron a las semillas y al suelo.
Los resultados obtenidos con las bacterias de los géneros Serratia y Bacillus, no coincidieron con informes previos (11, 19), lo que pudiera estar relacionado con las cepas bacterianas empleadas. Estas, en dependencia del lugar de aislamiento y de las condiciones de cultivo, puede tener o no, la capacidad de producir metabolitos con efecto antifúngico.
En el análisis microscópico (400x), las hifas en la zona de inhibición, se observaron de aspecto anormal con deformaciones en sus extremos (Figura).
Estos hallazgos coinciden con lo señalado por Minaxi y Saxena (20), quienes informaron la presencia de fragmentación, hinchamiento, perforaciones y lisis de hifas de M. phaseolina, en presencia de B. cepacia BAM-6, en su estudio utilizando microscopia electrónica.
Diversas cepas de B. cepacia fueron referidas como productoras de una amplia gama de metabolitos antifúngicos como pyrrolnitrin, fenazina y cepabactin, los que influyen en el crecimiento y morfología del micelio fúngico (21). De igual modo, la presencia de compuestos antifúngicos en B. cepacia frente a Rhizoctonia solani fue informada (17). Algunos de estos compuestos pudieran ser los responsables de las alteraciones observadas en el micelio de M. phaseolina en este estudio, aspecto que será objeto de investigaciones futuras.
Teniendo en cuenta la actividad in vitro de B. cepacia frente a M. phaseolina, se deben acometer en el futuro estudios a nivel de casa de cultivo y campo, de manera de obtener evidencias que avalen el uso de esta cepa bacteriana en el control biológico de este patógeno, lo que representaría una vía económica y medioambientalmente promisoria para disminuir la incidencia de la enfermedad.
REFERENCIAS
1. Ulloa A, Ulloa P, Ramírez J, Ulloa B. El frijol (Phaseolus vulgaris): su importancia nutricional y como fuente de fotoquímicos. Revista Fuente. 2011;3(8):5-9.
2. Quintero E, Guzmán L, Gil V. El banco de germoplasma de frijol del CIAP y su contribución al desarrollo en el sector productivo de Villa Clara. III Conferencia Internacional Sobre Desarrollo Agropecuario y Sostenibilidad «Agrocentro 2005», (2005). Santa Clara. CD ISBN: 959-250-207-2.
3. Ministerio de la Agricultura (MINAG). Estadísticas MINAG. República de Cuba. 2003.
4. Cardona R. Distribución vertical de esclerocios de Macrophomina phaseolina en un suelo infestado naturalmente en el estado Portuguesa. Rev Fac Agron. 2006;23(3):285-293.
5. Muthomi JW, Otieno PE, Cheminingwa GN, Nderitu JH, Wagachaja JM. Effect of legume root rot pathogens and fungicide seed treatment on nodulation and biomass accumulation. J Biol Sci. 2007;7:1163-1170.
6. Alice D, Sundravadana S. Effects of biocontrol agents and plant products Macrophomina phaseolina and colchicine content in Gloriosa superba. Plant Protect Sci. 2012;48:110-115.
7. Ngo B, Vu D, Tran D. Analyze antagonist effects of Trichoderma spp. for controlling southern stem rot caused by Sclerotium rolfsii on peanut. Plant Protection. 2006;1:12-14.
8. Tran N. Using Trichoderma species for biological control of plant pathogens in Viet Nam. J ISSAAS. 2010;16(1):17-21.
9. Ullah M, Khan M, Sahi S, Habib A. Evaluation of antagonistic fungi against charcoal rot of sunflower caused by Macrophomina phaseolina (Tassi) Goid. African Journal of Environmental Science and Technology. 2011;5(8):616-621.
10.Gajera H, Bambharolia R, Patel S, Khatrani T, Goalkiya B. Antagonism of Trichoderma spp. against Macrophomina phaseolina: Evaluation of Coiling and Cell Wall Degrading Enzymatic Activities. Journal of Plant Pathology & Microbiology. 2012;3(7):149.
11.Singh N, Paudey P, Dubey R, Mabeshwart D. Biological control of root rot fungus Macrophomia phaseolina and growth enhancement of Pinus roxburghii (Sarg.) by rhizophere competent Bacillus subtilis (BN1). World Journal of Microbiology & Biotechnology. 2008;21:1669-1679.
12.Ahemad M, Kibret M. Mechanisms and applications of plant growth promoting rhizobacteria: Current perspective. Journal of King SaudUniversity - Science. 2013:1-17.
13.Alvarado CY. Incidencia, identificación y estrategias para la prevención y el control de contaminantes bacterianos en el cultivo in vitro de la caña de azúcar (Saccharum spp. híbrido). Tesis presentada en opción al grado científico de Doctor en Ciencias Agrícolas. Universidad Central «Marta Abreu» de Las Villas, Facultad de Ciencias Agropecuarias, Cuba. 2003. 98 pp.
14.Schoina C, Stringlis I, Pantelides I, Tjamos S, Paplomatas E. Evaluation of application methods and biocontrol efficacy of Paenibacillus alvei strain K-165, against the cotton black root rot pathogen Thielaviopsis basicola. Biological Control. 2011;58(1):68-73.
15.Rahman M, Kadir J, Mahmud T, Rahman A, Begum M. Screening of antagonistic bacteria for biological activities on Colletotrichum gloesporioides in Papaya. Asian Journal of Plant Sciences. 2007;6(1):12-20.
16.De costa DM, Erabadupitiya H. An integrated method to control postharvest diseases of banana using a member of the Burkholderia cepacia complex. Postharvest Biol Technol. 2005;36:31-39.
17.Quan CS, Zheng W, Liu Q, Ohta Y, Fan SD. Isolation and characterization of a novel Burkholderia cepacia with strong antifungal activity against Rhizoctonia solani. Applied Microbial and Cell Physiology. 2006;72(6):1276-1284.
18.Satya V, Vijayasamundeeswari A, Paranidharan V, Velazhahan R. Burkholderia sp. strain TNAU-1 for biological bontrol of Root Rot in Mung bean (Vigna radiata L.) caused by Macrophomina phaseolina. Journal of Plant Protection Research. 2011;51(3):273-278.
19.Erdogan O, Benlioglu K. Biological control of Verticillium wilt on cotton by use of fluorescent Pseudomonas spp. under field conditions. Biological Control. 2010;53(1):39-45.
20. Minaxi Saxena J. Disease suppression and crop improvement in moong beans (Vigna radiata) through Pseudomonas and Burkholderia strains isolated from semiarid region of Rajasthan, India. BioControl. 2010;55(6):799-810.
21.Mendes R, Pizzirani-Kleiner A, Araujo W, Raaijmakers J. Diversity of Cultivated Endophytic Bacteria from Sugarcane: Genetic and Biochemical Characterization of Burkholderia cepacia Complex Isolates. Appl Environ Microbiol. 2007;73(22):7259-7267.
Recibido: 18-3-2013.
Aceptado: 30-9-2013.