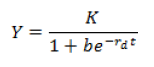Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Protección Vegetal
versión impresa ISSN 1010-2752versión On-line ISSN 2224-4697
Rev. Protección Veg. vol.30 no.1 La Habana ene.-abr. 2015
ARTÍCULO ORIGINAL
Parámetros poblacionales de Diaphorina citri Kuwayama (Hemiptera: Liviidae) y Tamarixia radiata Waterston (Hymenoptera: Eulophidae) en condiciones naturales
Population parameters of Diaphorina citri Kuwayama (Hemiptera: Liviidae) and Tamarixia radiata Waterston (Hymenoptera: Eulophidae) under natural conditions
Heyker L. Baños DíazI, Ileana Miranda CabreraI, Héctor Rodríguez MorellII, Adayakni Sánchez CastroI, Reynaldo Chico MorejónI, María de los A. Martínez RiveroI
ICentro Nacional de Sanidad Agropecuaria. Dirección de Sanidad Vegetal. Grupo Plagas Agrícolas. Laboratorio Entomología. Apartado 10, San José de las Lajas, Mayabeque. Cuba. Correo electrónico: hlellani@censa.edu.cu.
IIUniversidad Agraria de La Habana (UNAH).Facultad de Agronomía. Laboratorio de Sanidad Vegetal. San José de las Lajas, Mayabeque. Cuba.
RESUMEN
Se determinó la fluctuación poblacional de Diaphorina citri Kuwayama y su parasitoide Tamarixia radiata Waterston en zonas urbanas del municipio Playa, La Habana, Cuba. La evaluación de las poblaciones de ambos insectos se realizó cada diez días, en plantas de Murraya paniculata L. (Jack) y Citrus spp., ubicadas en jardines de viviendas privadas e instalaciones públicas. Para conocer el comportamiento de las interacciones que se establecen entre este fitófago y su plaga diana se realizaron regresiones logísticas, según un modelo no lineal, y se determinó la densidad de D. citri, para la cual se hace necesario un tratamiento control. Se observó que las poblaciones de ambos insectos fueron mayores en el año 2009 en plantas de M. paniculata; se duplicó en el caso del enemigo natural, con relación a las encontradas en el año 2007. El parasitoidismo mostró los porcentajes más bajos en los cítricos. La capacidad máxima de incremento (K) de D. citri fue de 147, la cual supera a la encontrada durante los muestreos, con una media poblacional (µ) de 110,9 individuos con una tasa neta de crecimiento instantánea rd=0,06; mientras que para el parasitoide fue de 98,25 individuos, valor que se encuentra por encima de lo observado durante los muestreos, con una media poblacional (µ) de 53,4 individuos. A partir de estos resultados se estimó que, de existir 49 individuos totales por cada 5 brotes muestreados, resultará necesaria la aplicación de alguna medida que evite el incremento acelerado de D. citri.
Palabras clave: Diaphorina citri, Tamarixia radiata, fluctuación poblacional, regresiones logísticas, capacidad máxima de incremento, tasa neta de crecimiento instantánea.
ABSTRACT
The population fluctuation of Diaphorina citri Kuwayama and its parasitoid Tamarixia radiata Waterston was determined in urban areas of the municipality of Playa, Havana City, Cuba. The study was carried out from February 15, 2007, to April 15, 2009. The populations of both insects on plants of Murraya paniculata L. (Jack) and Citrus spp. growing in private and public gardens were evaluated every ten days. In order to understand the interactions between the target pest and its parasitoid, logistic regressions,working with a nonlinear model, were used, and the generalized relationship between the samplings were used to determine the density in which a control treatment was necessary. The population of both insects on M. paniculata plants was higher in 2009; in the case of the natural enemy, the population doubled that observed in 2007. The lowest percentages of parasitoidism were found in the citrus plants. The maximum increase rate (K) of D. citri was 147, which exceeded the rate found during the samplings, with a mean population (ì) of 110.9 individuals and a net instantaneous growth rd = 0.06 ; for the parasitoid (K) was 98.25 individuals, a value higher than that observed for the samples, with a population mean (ì) of 53.4 individuals. With these results, it was estimated that, when a total of 49 individuals was present per each five sampled buds, it would be necessary the application of some measure to avoid the quick increment of D. citri.
Key words: Diaphorina citri, Tamarixia radiata, populational fluctuation, logistic regressions, maximum increase rate, instantaneous growth net.
INTRODUCCIÓN
En los últimos años, la citricultura mundial, y en particular la del hemisferio occidental, fue amenazada por el arribo, la dispersión y establecimiento de Diaphorina citri, que provoca cuantiosos daños en plantas de la familia Rutaceae. Sus ninfas y adultos extraen grandes cantidades de savia durante el proceso de alimentación, lo que propicia la formación de fumagina en la superficie de las hojas. Además, D. citri constituye un eficiente vector de la enfermedad denominada Huanglongbing (1), considerada como la más destructiva y letal en el cultivo (2).
Hasta el año 2004, cuando la enfermedad se informó por primera vez para el hemisferio occidental, estaba restringida a los continentes asiático y africano (3, 4). Esta enfermedad es causada por la bacteria Candidatus Liberibacter spp., la cual es trasmitida por dos insectos vectores: para África, el psílido Tryoza erytreae (Del Guerico), y para Asia y América, Diaphorina citri Kuwayama (5, 6, 7). En Cuba, se informó su presencia en áreas urbanas de La Habana en 1999 (8), sobre plantas de Murraya paniculata L. (Jack) y Citrus spp.
Tamarixia radiata Waterston es uno de los enemigos naturales de D. citri más estudiados, desde el punto de vista del control biológico clásico. Se caracteriza por desarrollarse como un ectoparasitoide idiobionte de ninfas de D. citri. En Cuba, este insecto benéfico se observó en abril de 2002 en parcelas de Citrus sinensis L., parasitando a D. citri en la localidad de San José de las Lajas, en la actual provincia Mayabeque (9).
El éxito de un programa de control biológico clásico puede estar determinado por el uso del ecotipo de enemigo natural apropiado, por lo que se requieren de ciertas investigaciones cuando estos se importan o se detectan por primera vez en un país o región. Estas investigaciones contribuyen al mejor desarrollo de crías masivas y a evaluar las potencialidades del biorregulador (3). Además, el conocimiento sobre la fluctuación poblacional de un insecto y su enemigo natural, es requisito indispensable para el establecimiento de un control eficiente y económico. Esta información permite planificar las medidas de control, al conocer las épocas de aparición en el campo y el número de generaciones al año, tanto de la plaga como del enemigo natural, permitiendo estimar el número de liberaciones, o cualquier otra medida que se deba realizar durante el año (10). En el presente estudio nos propusimos como objetivo estimar los niveles de parasitoidismo y emergencia, así como su fluctuación poblacional del vector D. citri y su parasitoide T. radiata sobre plantas de M. paniculata.
MATERIALES Y MÉTODOS
Los estudios poblacionales de D. citri y T. radiata se realizaron sobre M. paniculata (hospedante alternativo de ambos insectos) y plantas de cítricos que se desarrollaban en condiciones naturales, en áreas urbanas ubicadas en patios particulares.
Las colectas de las poblaciones del parasitoide y hospedante se realizaron en el municipio Playa, Provincia de La Habana, durante el período comprendido entre el 15 de febrero de 2007 al 15 de abril de 2009. Se ejecutaron muestreos cada diez días en plantas de M. paniculata y Citrus spp., bajo un diseño completamente aleatorizado.
Para contabilizar el número de ninfas de D. citri y adultos de T. radiata, distribuidos en diferentes zonas de las plantas (9), se tomaron un total de 40 brotes en plantas de cítricos y 150 brotes en M. paniculata por muestreo. El número de brotes fue mayor en este último hospedante, debido a que su arquitectura difiere totalmente de la de los árboles de cítricos, los que tienen una mayor altura y ramas de mayor tamaño.
Las muestras se colocaron en bolsas de nylon debidamente identificadas y se trasladaron al laboratorio de Entomología del Centro Nacional de Sanidad Agropecuaria (CENSA), en la provincia Mayabeque. Posteriormente, se revisaron bajo un microscopio estereoscópico Stemi SV-6, utilizando desde 10 hasta 40 aumentos, con el propósito de contabilizar las poblaciones del hospedante.
Los brotes se dispusieron en recipientes de cristal con una lámina de agua en el fondo (la que se cambió regularmente) y se colocaron en jaulas rectangulares de cristal cubiertas con una malla antiáfido por uno de sus extremos. Se realizó el conteo diario de la emergencia de los parasitoides, y se determinó el porcentaje de parasitoidismo, emergencia y la proporción sexual entre hembras y machos, en cada muestreo.
Los valores de parasitoidismo y emergencia se analizaron a través del Método de comparación de proporciones de Wald (p£0,01), mediante el paquete CompaProWin 2.1 y las medias se compararon según el test de Duncan.
A partir de los datos obtenidos, se graficó en Excel la población total del vector y el parasitoide T. radiata por muestreo, con el objetivo de establecer el comportamiento natural de ambas poblaciones de insectos.
Para la estimación de la capacidad máxima de incremento de D. citri y T. radiata, así como de la tasa de crecimiento instantáneo en condiciones no controladas, se calculó el promedio de ambas poblaciones por muestreo y se realizaron regresiones logísticas, según modelo no lineal:
Donde: Y representa la densidad poblacional, t es la unidad de muestreo (días); b, K y rd son los parámetros a ser estimados por el modelo, donde K es la capacidad máxima de incremento y rd la tasa de crecimiento instantáneo en campo.
A partir del modelo de crecimiento logístico, se estimó el valor de t para el cual ![]() .
.
Este punto fue definido por Sharov en 1999 (11) como el momento de inicio de crecimiento acelerado de la población hasta alcanzar un punto de equilibrio estable o inestable, según sean las relaciones en el ecosistema.
La densidad de D. citri, en la cual se hace necesario un tratamiento control, se determinó mediante el gráfico de la relación generalizada del Log (Nt+1) con el Log (Nt), y se analizaron los puntos de cambio, según el modelo generalizado propuesto por Southwood y Way (12).
RESULTADOS Y DISCUSIÓN
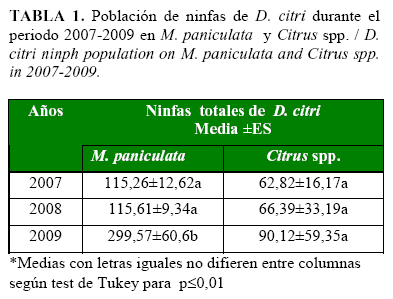
Durante el período evaluado, las densidades poblacionales de D. citri en M. paniculata aumentaron en el tiempo y fueron significativamente mayores en el año 2009. Sin embargo, el comportamiento de este indicador en las plantas de cítricos, aunque también aumentó, no mostró diferencias significativas en cuanto al número de ninfas durante el periodo 2007-2009, con poblaciones muy inferiores a las encontradas en la muralla (Tabla 1).
Este comportamiento puede tener relación con la presencia de brotes en cada una de las especies vegetales evaluadas. La muralla, como planta de jardín, cuya función fundamental es el embellecimiento del entorno, es sometida a una mayor atención y a un mayor número de podas durante el año, lo que hace que se incremente el número de brotes y con ello se produzca un aumento de las poblaciones del fitófago. Por el contrario, la presencia de altas poblaciones de ninfas de D. citri en los cítricos está limitada a los periodos de brotación del cultivo.
La media por muestreo obtenida fue de 153 individuos, valor marcadamente superior a los encontrados por Pluke et al. (13), quienes informaron una densidad poblacional del fitófago de entre 5-6 individuos por brote, lo que demuestra que D. citri encontró condiciones óptimas para su reproducción en áreas urbanas de la capital cubana.
Al respecto, Fernández y Miranda (14) plantearon que D. citri es un fuerte competidor y, de no contarse con un control biológico efectivo, presentaría una tendencia al incremento de sus poblaciones. Esta situación implicaría mayor utilización del control químico, con un mayor costo monetario y ambiental, así como un incremento de la enfermedad que transmite este vector.
Es de señalar que aunque la cantidad de adultos de T. radiata no presentó diferencias en los años 2007 y 2008, se produjo un incremento significativo en el 2009, tanto en muralla como en cítricos, pues se duplicaron las poblaciones con relación a las encontradas en el 2007 y se mostró un coeficiente sexual que favoreció a las hembras (Tabla 2). Este aumento en las poblaciones de T. radiata es posible que ses deba al establecimiento de nuevas poblaciones en las áreas muestreadas y al incremento del número de ninfas de D. citri en ese año y en ambos hospedantes, aunque superiores en muralla. Este aumento poblacional indica la fuerte denso-dependencia que existe entre D. citri y T. radiata.
Por otra parte, el parasitoidismo en M. paniculata y en las plantas de cítricos no mostró diferencias significativas entre los años evaluados; sin embargo, los porcentajes más bajos se presentaron en los cítricos, con valores que estuvieron por debajo del 50%.
La emergencia mostró una progresión ascendente en muralla, alcanzando porcentajes significativamente más elevados en el 2009. Por su parte, en cítrico se produjo un incremento en el año 2008 con relación al período precedente, pero disminuyó en el 2009, por lo que se obtuvo un valor por debajo del 50% (Tabla 3).
Es posible que la arquitectura de las plantas de muralla pudiera estar influyendo en el aumento de la emergencia, la cual alcanzó su mayor valor en el año 2009, pues estas poseen un mayor follaje, lo que favorece mayores sitios de ovipostura para D. citri e incremento en la cantidad de hospedantes disponibles, y con ello una mayor emergencia de T. radiata, lo que coincide con lo planteado por Pluke et al. (13).
La disminución de la emergencia de T. radiata en las plantas de cítricos pudo estar relacionada con dos factores, la pérdida de hojas (por la necrosis de brotes y ramas debido a la enfermedad HLB) las constituyen reservorio de las ninfas de 3ro a 5to instar del fitófago (9) y por la posibilidad de que se hayan producido temperaturas superiores a los 30oC, las que pueden influir negativamente en la tasa de emergencia de himenópteros de la familia Eulophidae (15).
Los valores de emergencia y parasitoidismo obtenidos en plantas de cítricos se encuentran dentro de los intervalos informados por Gómez et al. (16) y Pluke et al. (13), quienes acotaron valores de parasitoidismo y emergencia, en plantaciones comerciales de este cultivo, entre 27,5-80% y 43,2-80%, respectivamente.
Chong et al. (17) encontraron para T. radiata, niveles de parasitoidismo de 18,5% en plantas de M. paniculata pertenecientes a zonas residenciales en el sudeste de la Florida, valor inferior al obtenido en zonas residenciales de La Habana durante este estudio. Por su parte, Pluke et al. (13) registraron niveles de parasitoidismo entre 67 y 100% en M. paniculata, valores que concuerdan con los informados en este estudio. En M. paniculata, bajo condiciones controladas, Chu y Chien (18) obtuvieron niveles de parasitoidismo de 80% y de emergencia de 71,2%, mientras que Gómez et al. (19) informaron 88,30 y 85,50%, respectivamente (a temperatura de 25oC).
En Cuba resulta escasa la información sobre los porcentajes de parasitoidismo en campo, y solo se cuentan con los informes de González et al. (20), quienes señalaron que luego de su detección en Cuba, T. radiata asumió el protagonismo del control natural del fitófago: se calcularon porcentajes de parasitoidismo entre 30,72% y 97,26% en las zonas citrícolas del país.
Estos resultados se obtuvieron a inicios de la introducción del insecto al país. Sin embargo, ocho años después de estos informes, se evidenció una disminución en el porcentaje de parasitoidismo y la emergencia de este enemigo natural, lo que está alertando acerca de la necesidad de buscar alternativas para incrementar estos indicadores en condiciones de campo, a través de liberaciones puntuales del parasitoide.
En cuanto a la fluctuación poblacional, el parasitoide T. radiata se movió siguiendo una trayectoria similar a la de su hospedante, con picos poblacionales en los muestreos 1 y 13, correspondientes a febrero y mayo de 2007; y los números 47, 52 y 54 correspondientes los dos primeros a junio, y el último a septiembre en el 2008 (Figura 1).
En el año 2009 se produjo un incremento en la población de ninfas de D. citri, con picos más elevados en los muestreos 81, 82 y 83, correspondientes a los meses de mayo, junio y noviembre, los cuales alcanzaron valores promedios de hasta 183 individuos por brote. El parasitoide T. radiata siguió la misma trayectoria de las poblaciones de D. citri, con los idénticos picos poblacionales, pero con valores medios menores a 11,5 individuos por brote. Los mayores picos de la población pudieron estar influenciados, quizás, por la ocurrencia de bajas precipitaciones y temperaturas y humedades relativas óptimas para el desarrollo de D. citri.
En el resto de las observaciones, las poblaciones se mantuvieron relativamente bajas, lo que pudiera estar relacionado con la temperatura, la cual, aunque estuvo dentro del rango previsto para la especie, se comportó de forma variable, pues en algunos muestreos resultaron un poco más bajas y en otros superiores al rango óptimo de la especie;en estos momentos se observan menores densidades de insectos; coincidiendo además con valores de humedad relativa algo elevados.
Al comparar nuestros resultados con los de Fernández y Miranda (9), se evidenció que se produjo un incremento en la media de individuos por muestreo. Estos autores encontraron, de septiembre a diciembre de 1999, medias entre 0,7 y 2,2 individuos por muestreo. En el mes de febrero de 2000, estos autores hallaron medias poblacionales de hasta 13,50 individuos por muestreo, valor mucho más bajo que los encontrados durante el 2009 en el presente estudio. Sin embargo, Pluke et al. (13) encontraron en M. paniculata altos niveles poblacionales de D. citri (69%), correspondientes al mes de febrero y menores en el mes de abril (52% -22%). Estos datos se corresponden con valores de 7,1 a 14,0 individuos por brote.
De igual forma, Tsai et al. (21) observaron un incremento en las poblaciones del fitófago en dos parcelas de M. paniculata en el sur de Florida, periodo 1998-1999, donde los niveles más altos de la población se muestran en octubre, noviembre y diciembre de 1998, y en mayo y agosto de 1999. Estos autores relacionaron positivamente los altos niveles poblacionales con la disponibilidad de nuevas hojas, que fueron a la vez relacionadas con la temperatura mínima y menor nivel de lluvia semanal en esa zona. Además, plantearon que el crecimiento continuo de los brotes con nuevas hojas, producido en M. paniculata, podría jugar un papel importante en el mantenimiento de altas poblaciones de este insecto, cuando los brotes de nuevas hojas no están disponibles en los huertos comerciales de cítricos.
Tales comentarios coinciden con lo planteado por Etienne et al. (22), quienes afirmaron que M. paniculata constituye un reservorio de estas poblaciones, que posteriormente pueden infestar las plantas de Citrus spp. durante su periodo de brotación. Este planteamiento debe tenerse en cuenta por las autoridades competentes para el manejo de estas poblaciones en plantas de muralla, ubicadas en las zonas urbanas de la Ciudad de La Habana, por constituir focos primarios de infestación del fitófago.
Estos resultados parecen apuntar hacia la existencia de factores como la temperatura, humedad relativa, radiación solar, precipitaciones y niveles nutricionales de las plantas que influyen en el aumento de las poblaciones del vector en Cuba.
Los modelos logísticos, aunque no describen la dinámica real de las poblaciones, estiman el crecimiento de las mismas (23). La capacidad máxima de incremento (K) fue de 147 individuos para D. citri, lo que equivale a 3,67 individuos por brote y supera a la encontrada durante los muestreos, con una media poblacional (µ) de 110,9 individuos con una tasa neta de crecimiento instantánea rd=0,06 (Figura 2).
En el caso del parasitoide T. radiata, el modelo (Figura 3) mostró que la capacidad máxima de incremento (K) fue de 2,45 individuos/brote, valor que se encuentra por encima de lo observado durante los muestreos, con una media poblacional (µ) de 53,4 individuos.
Es importante esclarecer que la diferencia entre los valores de rm y rd radica en los datos a partir de los cuales son obtenidos, pues la rm se calcula mediante datos de laboratorio, bajo condiciones óptimas para el hospedante y/o parasitoide, mientras que la rd proviene de valores obtenidos en campo, donde el insecto está sujeto a variaciones climatológicas y densidad de hospedante en el tiempo, por lo que estos datos se ajustan a lo que sucede en la práctica y, por tanto, son elementos a tener en cuenta en el manejo de las poblaciones del fitófago.
Comparando ambos valores de rd (D. citri y T. radiata), podemos observar que la capacidad de crecer en el tiempo de las poblaciones de D. citri es mayor que la de T. radiata, lo que coincide con lo observado en los muestreos realizados. La rd obtenida sobre M. paniculata, en las zonas urbanas de La Habana, evidenció la tendencia al crecimiento de las poblaciones de D. citri sobre este hospedante alternativo y bajo las condiciones ambientales locales. Por lo que podemos inferir que T. radiata no estaba expresando su máximo potencial biótico.
Este comportamiento pudiera estar dado por la influencia de factores bióticos, abióticos y/o antropogénicos, pues como se expuso anteriormente, el comportamiento de los parasitoides de esta familia está influenciado fuertemente por las variaciones de temperatura. Por otra parte, este valor, al ser un estimado del comportamiento de las poblaciones en campo, sugiere la necesidad de incrementar las densidades del parasitoide para efectuar una buena regulación del fitófago.
Al respecto, Fernández y Miranda (14) señalaron que la capacidad de carga o máxima densidad de la población de D. citri, sobre Toronjo Marsh en la Isla de la Juventud, alcanzó valores de 8,86 y una tasa neta de crecimiento instantáneo de rd = 0,45.
Se ha demostrado experimentalmente que, bajo condiciones físicas uniformes del medioambiente, una población de insectos puede presentar fluctuaciones en su densidad por causa de sus enemigos naturales. Esto se debe a que el incremento en el número de insectos fitófagos favorece el incremento de sus enemigos naturales, los que por su acción parasítica o predadora, provocan con el tiempo la reducción del insecto fitófago.
Según Varley y Gradwell (24), en la naturaleza los factores de variación estacional, el efecto de la disponibilidad de alimentos y la acción de los enemigos naturales, actúan simultáneamente. De ahí que resulte complejo interpretar lo que en realidad está ocurriendo en el campo.
Por su parte, el modelo generalizado mostró que el primer punto R, que indica la necesidad de aplicación de alguna acción de control, es aquel para el cual el log (Nt)=1.6901 (Figura 4), lo que implica que de existir 49 individuos totales por cada 5 brotes muestreados, resultará necesaria la aplicación de alguna medida que evite el incremento acelerado de D. citri.
La señal dada a partir del número total de individuos y no a partir del número de individuos promedio, lo cual guarda mayor relación con la disposición agregada que sigue la mayoría de los fitófagos en los ecosistemas.
Es común encontrar plantas densamente pobladas, mientras que otras permanecen sin infestarse, lo cual hace que la media, aun cuando resulta útil para estimar el comportamiento poblacional de los fitófagos (25, 26 y 27), no sea un indicador exacto de la densidad existente.
Por otra parte, si el modelo obtenido se compara con el propuesto por Southwood y Way (12) (Figura 5), puede apreciarse que tiene al menos un punto más de oscilaciones del equilibrio, lo cual sugiere la necesidad de aplicaciones continuadas para evitar incrementos desmedidos de la densidad del fitófago.
El punto inicial R, determinado como primera señal o densidad límite, se mantiene invariable, ya que aparece antes de la aplicación de productos químicos. Por esta razón, a partir de este resultado se recomienda aplicar una medida de control, al encontrar 47 o más ninfas de D. citri en el muestreo de 5 brotes tomados al azar de plantas diferentes de M. paniculata.
Otros autores utilizaron este modelo para establecer los puntos de liberación de artrópodos benéficos para el control de fitófagos. Tal es el caso de la estimación de la densidad límite para el manejo y control del ácaro Polyphagotarsonemus latus Banks sobre pimiento en casas de cultivo protegido, donde se determinó a qué densidad de este ácaro se hace necesaria la liberación del depredador (27, 28).
No existen antecedentes publicados referentes a estos parámetros para T. radiata, por tanto, el conjunto de datos representa un novedoso resultado que se obtiene por primera vez en muralla para el estudio de las poblaciones del parasitoide en Cuba. El modelo de la relación generalizada se utiliza, por primera vez a nivel mundial, para evaluar los momentos de aplicación de T. radiata para el manejo de D. citri en zonas urbanas y puede ser utilizado como una herramienta para estimar las posibles tasas de liberación del parasitoide. Por lo que los resultados obtenidos en este estudio proveen una información básica que ayuda a una mejor comprensión del desarrollo de T. radiata y D. citri bajo condiciones de campo y ofrecen bases científicas acerca de las posibilidades de manejo del vector del HLB con T. radiata.
REFERENCIAS
1. Alemán J, Baños H, Ravelo J. Diaphorina citri y la enfermedad Huanglongbing: Una combinación destructiva para la producción citrícola. Rev Protección Veg. 2007;22(3):154-165.
2. Bové JM, Calavan ED, Capoor SP, Cortez RE, Schwarz RE. Influence of temperature on symptoms of California stubborn, South African greening, Indian citrus decline and Phillippine leaf mottling disease. En L.G. Weathers y M. Cohen [eds.], Proc. 6th Conference of the International Organization of Citrus Virologists (IOCV). Universidad de California, Riverside: 12-15. 1974.
3. McFarland CD, Hoy MA. Survival of Diaphorina citri (Homoptera: Psyllidae), and its two parasitoids, Tamarixia radiata (Hymenoptera: Eulophidae) and Diaphorencyrtus aligarhensis (Hymenoptera: Encyrtidae), under different relative humidities and temperature regimes. Florida Entomologist. 2001;84:227-233.
4. Vaccaro N, Bouvet J. Registro de un enemigo natural de la chicharrita de los cítricos en Entre Ríos, Argentina. Boletín de la IOBCSRNT. 2006;15:13.
5. Costa N. Nueva enfermedad pone en riesgo a la citricultura argentina. ASAPROVE, 2005;5:21. (En línea). Disponible en: http://www.asaprove.org.ar. Consulta: 20-9-2007.
6. Batool A, Iftikhar Y, Mughal SM, Khan MM, Jaskani MJ, et al. Citrus Greening Disease A major cause of citrus declin in the world - A Review. Hort Sci. 2007;34(4):159-166.
7. Manjunath KL, Halbert SE, Ramadugu C, Webb S, Lee RF. Detection of Candidatus Liberibacter asiaticus in Diaphorina citri and Its Importance in the Management of Citrus Huanglongbing in Florida. Phytopathology. 2008;98(4):387-396.
8. González C, Vera A, Hernández D, Tapia JL. Comportamiento de Diaphorina citri Kuw. (Hemiptera: Psyllidae) y sus enemigos naturales en Naranjo Valencia de Arimao, Cienfuegos. In: Instituto de Investigaciones en Fruticultura Tropical: Simposio Internacional de Fruticultura Tropical y Subtropical, 2., La Habana. 2007. Memorias. Ciudad de la Habana: 1-13.
9. Fernández M, Miranda I. Comportamiento de Diaphorina citri Kuwayama (Hemiptera: Psyllidae). Parte I: Características morfológicas, incidencia y enemigos naturales asociados. Rev Protección Veg. 2005;20(1):27-31.
10.Martínez BN, Godoy F. Fluctuación poblacional de Anastrepha serpentina Wied (Diptera: Tephritidae) en níspero (Achras zapota) en el Limón, Aragua Venezuela. Agronomía Tropical. 1987;37(4-69):123-129.
11.Sharov A. Quantitative Ecology Population, 1999. Disponible en: http://www.ento.vt.edu/~sharov/PopEco. Consultado: 12-01-2014.
12.Southwood TRE, Way MJ. Ecological Background to Pest Management. In: Rabb RL, Guthrie FE, editors. Univ. del Estado de Carolina del Norte; Concepts of Pest Management. 1970; 6-29.
13.Pluke RWH, Qureshi JA, Stansly PA. Citrus flushing patterns, Diaphorina citri (Hemiptera: Psyllidae) populations and parasitism by Tamarixia radiata (Hymenoptera: Eulophidae) in Puerto Rico. Florida Entomologist. 2008;91:36-42.
14.Fernández M, Miranda I. Comportamiento de Diaphorina citri Kuwayama (Hemiptera: Psyllidae). Parte III: Relación entre el ciclo de vida y el brote vegetativo foliar. Rev Protección Veg. 2007;20(3):161-164.
15.Wang X, Liu S, Guo S, Lin W. Effects of host stages and temperature on population parameters of Oomyzus sokolowskii, a larval-pupal parasitoid of Plutella xylostella. BioControl. 1999;44:391-402.
16.Gómez Torres ML, Nava DE, Gravena S, Costa VA, Parra JRP. Primeiro registro de Tamarixia radiata (Waterston) (Hymenoptera: Eulophidae) em Diaphorina citri Kuwayama (Hemiptera: Psyllidae) no Brasil. Revista de Agricultura. 2006;81:112.
17.Chong JH, Roda LA, Mannion MC. Density and Natural Enemies of the Asian Citrus Psyllid, Diaphorina citri (Hemiptera: Psyllidae), in the Residential Landscape of Southern Florida. Journal of Agricultural and Urban Entomology. 2010;27(1):33-49.
18.Chu YI, Chien CC. Utilization of natural enemies to control psyllid vectors transmitting citrus greening. In: KIRITANI, K.; SU, H.J.; CHU, Y.I. (Ed.). Integrated control of plant virus diseases. Taipei: Food and Fertilizer Technology Center for the Asian and Pacific Region. 1991; 135-145.
19.Gómez TML, Nava ED, Parra PJR. Life Table of Tamarixia radiata (Hymenoptera: Eulophidae) on Diaphorina citri (Hemiptera: Psyllidae) at Different Temperatures. Journal of Economic Entomology. 2012;105(2):338-334.
20.González C, Hernández D, Rodríguez JL. Primer informe de Tamarixia radiata Waterson como biorregulador de Diaphorina citri Kuw. en cítricos de Cuba. Citrifrut. 2000;18(1,2 y 3):38-39.
21.Tsai JH, Wang JJ, Liu YH. Seasonal abundance of the Asian citrus Psyllid, Diaphorina citri Kuwayama. (Homoptera: Psyllidae) in Southern Florida. Florida Entomologist. 2002;85(3):446-451.
22.Etienne J, Quilici S, Marival D, Franck A. Biological control of Diaphorina citri (Hemiptera: Psyllidae) in Guadeloupe by imported Tamarixia radiata (Hymenoptera: Eulophidae). Fruits. 2001;56(5):307-315.
23.Baños H, Miranda I, Martínez MA. Modelling the host -parasitoid interaction in the system Diaphorina citri- Tamarixia radiata on Murraya paniculata. IJMSEA. 2013;7(1):209-222.
24.Varley GC, Gradwell GR. Recent advances in insect population dynamics. Annual Review of Entomology. 1970;15: 1-24.
25.Miranda I. Estudio Poblacional y modelación de Tetranychus urticae Koch. Tesis presentada en opción al título de Doctor en Ciencias Agrícolas, Centro Nacional de Sanidad Agropecuaria, Cuba. 2003.
26.Rodríguez H, Miranda I, Montoya A, Rodríguez Y, Ramos M. Comportamiento poblacional de Polyphagotarsonemus latus (Banks) (Acari: Tarsonemidae) en pimiento (Capsicum annuum L.) en cultivo protegido. Fitosanidad. 2008;12(4):215-219.
27.Montoya RA. Control de Polyphagotarsonemus latus (Banks) con el ácaro depredador Amblyseius largoensis (Muma) en la producción protegida de pimiento (Capsicum annuum L.). Tesis presentada en opción al grado científico de Doctor en Ciencias Agrícolas. Centro Nacional de Sanidad Agropecuaria. Cuba. 2010.
28.Miranda I, Montoya A, Rodríguez Y, Depestre T, Ramos M, Rodríguez H. Densidad límite para el control de Polyphagotarsonemus latus (Banks) (Acari: Tarsonemidae) sobre pimiento (Capsicum annuum L.) en cultivo protegido. Rev Protección Veg. 2009;24(3):146-151.
Recibido: 18-11-2014.
Aceptado: 28-3-2015.