Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Protección Vegetal
versión On-line ISSN 2224-4697
Rev. Protección Veg. vol.30 no.2 La Habana mayo.-ago. 2015
ARTÍCULO ORIGINAL
Uso del microinjerto in vitro de ápices caulinares para eliminar ´Candidatus Liberibacter asiaticus´ en cultivares de cítricos en Cuba
Use of shoot-tip grafting in vitro to eliminate ´Candidatus liberibacter asiaticus´ in citrus cultivars in Cuba
Victoria Zamora-Rodríguez*, Maritza Luís-Pantoja, Inés Peña-Bárzaga, Xenia Ferriol-Marchena, Lester Hernández-Rodríguez
Instituto de Investigaciones en Fruticultura Tropical. Ave. 7ma No. 3005. Playa, La Habana. Cuba.
RESUMEN
El objetivo del estudio fue optimizar la técnica de microinjerto in vitro de ápices caulinares (MIV) para eliminar Candidatus Liberibacter asiaticus (CLas) en cultivares de cítricos infectados. Como fuentes de brotes se emplearon plantas de cinco cultivares con síntomas de huanglongbing (HLB): mandarinos Satsuma Tropical y Parson's Special, los híbridos de mandarinos Sunburst IVIA 200-C-1 y tangelo Nova IVIA 74-7 y limero Persa SRA-58. Para estandarizar el tamaño de ápice, suficiente para la eliminación de CLas, se ensayaron tres dimensiones compuestas por el meristemo apical con 2, 3 y 4 primordios foliares (pf) (0,1 - 0,4 mm). La presencia de CLas se constató mediante PCR dúplex en las plantas sintomáticas y PCR anidada en las plantas obtenidas por MIV. Se alcanzó un prendimiento general de 71,79%, de ellos el 46,15% para ápices de 2 pf y superior al 80% para 3 y 4 pf. De los microinjertos logrados, más del 60% creció y este parámetro estuvo por encima del 40% para ápices de 2 y 3 pf; mientras que el 80,61% correspondió a ápices de 4 pf. El 100% de las plantas obtenidas, a partir de los microinjertos, se mantuvieron libres de CLas por cuatro años, independientemente del tamaño del ápice utilizado. Los resultados confirmaron la efectividad de la técnica de microinjerto in vitro para sanear cultivares de cítricos infectados por CLas.
Palabras clave: microinjerto in vitro, saneamiento, huanglongbing, PCR, nPCR.
ABSTRACT
The aim of this research was to optimize the in vitro shoot-tip grafting (STG) technique to eliminate Candidatus Liberibacter asiaticus (CLas) from Citrus infected cultivars. Five citrus cultivars (Satsuma Tropical and Parson's Special mandarins, Sunburst IVIA 200-C-1 and Nova IVIA 74-7 hybrids of mandarins and Persian SRA-58 lime) showing symptoms of huanglongbing (HLB) were used as bud source:. Three different apex sizes, composed of the apical meristem with two, three and four leaf primordia (lp) (0.1 - 0.4 mm), were tested to standardize the apex size required to eliminate CLas. The presence of the pathogen was verified by the conventional PCR in the symptomatic plants and the nested PCR in the asymptomatic ones. The final success percentage of the shoot-tip grafting was 71.79%; 46.15% for the apex with 2 lp and over 80% for apexes with 3 and 4 lp. Sixty per cent of all the shoot-tip grafting grew normally, and this parameter was over 40% when apexes with 2 and 3 lpwere used, whereas it reached 80.61% when the apex with 4 lp was used. The 100% of the shoot-tip grafted plants were diagnosed as CLas free and this status was kept for four years regardless the shoot-tip size used. The results confirmed the reliability of the STG for removing CLas from citrus infected cultivars.
Key words: shoot-tip grafting, sanitation, huanglongbing, PCR, nPCR.
INTRODUCCIÓN
Los cítricos se afectan por enfermedades como tristeza, huanglongbing (HLB), cancrosis, leprosis, blight y clorosis variegada (CVC), entre otras, que les ocasionan graves pérdidas. Algunas de estas enfermedades comprometieron la viabilidad de la industria citrícola en varios países, debido a los daños y los costos del manejo (1).
HLB es una enfermedad sistémica con efecto devastador en los cítricos, causada por tres especies de a-proteobacterias restringidas al floema que se denominan Candidatus (Ca.) Liberibacter (L.) asiaticus, americanus y africanus (con acrónimos CLas, CLam y CLaf, respectivamente) (2, 3, 4). Estas bacterias se diseminan por los insectos vectores Diaphorina citri Kuwayama y Trioza erytreae (del Guercio) (5, 6) y a través del injerto de yemas infectadas (7).
La distribución del patógeno en las plantas enfermas es irregular (8, 9), por lo que la frecuencia de obtención de plantas con HLB, a partir de la propagación de yemas de una planta infectada, nunca es del 100% (10, 11, 12). En experimentos realizados a partir del injerto de yemas infectadas con HLB en plantas sanas, se encontraron frecuencias de transmisión que variaron desde 4% hasta 85% (10, 13, 14, 15).
No existen métodos curativos para la enfermedad HLB, y el manejo integrado regional es la única solución disponible para el control de la misma. Este incluye medidas de cuarentena, uso de yemas certificadas, eliminación de fuentes de inóculo y control de los vectores, entre otras (7, 16, 17).
En este sentido, se ensayaron varios métodos para el control de las bacterias en plantas infectadas, tales como: aplicaciones de antibióticos y otras moléculas (18, 19, 20), termoterapia (16, 20, 21), vitrificación-crioconservación (22) y microinjerto in vitro de ápices caulinares (MIV) (16, 23, 24); esta última técnica resultó la más eficaz para la eliminación de los patógenos sistémicos en cítricos y se utiliza, generalmente, combinada con termoterapia (1, 21, 23, 24). La exclusión de HLB mediante MIV se confirmó experimentalmente en 1987 en China, y luego se utilizó satisfactoriamente por otros autores (17, 23). Las bacterias causantes del HLB se consideran dentro del grupo de los patógenos muy fáciles de ser eliminados por la técnica de MIV (1, 23, 24).
En Cuba, la presencia del vector D. citri se informó en 1999 y se notificó a CLas como el único agente causal presente en el país en 2007 (25, 26, 27). La enfermedad y su vector están diseminados por todo el territorio nacional e infectan a todas las especies de cítricos (28). El uso de material de propagación certificado sanitariamente, producido dentro del Sistema de Producción de Material de Propagación Certificado de Cítricos (SPMPCC), es una de las principales medidas como estrategia del país para el manejo de la enfermedad (29).
La base de este sistema es la metodología de MIV para la obtención de plantas libres de patógenos transmisibles por injerto. Sin embargo, al optimizar la metodología de MIV para la eliminación de patógenos es necesario adecuar el tamaño del ápice y las condiciones del MIV, las cuales pueden variar entre los diferentes cultivares y los patógenos a eliminar (1, 24). Se ha demostrado que el aumento del tamaño del ápice incrementa fuertemente el porcentaje de prendimiento, pero disminuye la obtención de plantas sanas (1, 30, 31, 32). Este trabajo se realizó con el objetivo de optimizar la metodología de MIV para el saneamiento de especies de cítricos infectadas con CLas en el país.
MATERIALES Y MÉTODOS
Material vegetal y diagnóstico molecular de bacterias Candidatus Liberibacter en las plantas sintomáticas
Se utilizaron plantas con síntomas característicos de la enfermedad HLB (7), como es la presencia de moteados asimétricos en las hojas como fuentes de los brotes. Los cultivares fueron: mandarino Satsuma Tropical (Citrus unshiu (Mak.) Marc.), mandarino Parson's Special (Citrus tangerina Hort. ex Tan.), los híbridos de mandarinos Sunburst IVIA 200-C-1 [Citrus clementina Hort. ex Tan. x (Citrus paradisi Macf. x Citrus tangerina Hort. ex Tan.)] x [Citrus clementina Hort. ex Tan. x (Citrus paradisi Macf. x Citrus tangerina Hort. ex Tan.)] y tangelo Nova IVIA 74-7 [Citrus clementina Hort. ex Tan. x (Citrus paradisi Macf. x Citrus tangerina Hort. ex Tan.)] y limero Persa SRA-58 (Citrus latifolia Tan.). Cada cultivar estuvo representado por dos plantas, que se defoliaron previamente para estimular la emisión de las yemas axilares.
Para la confirmación de la presencia de alguna de las especies de Candidatus Liberibacter en estas plantas, se realizó el diagnóstico a partir de muestras de cinco hojas con moteado asimétrico por planta, que presentaban el síntoma de HLB. El ADN total se obtuvo mediante la metodología de Murray y Thompson (33) y se determinó, a través de la PCR dúplex, cuál de las tres especies de Candidatus Liberibacter se encontraba en las plantas fuentes de brotes. Esta variante de PCR detecta en una sola reacción la presencia de CLaf y CLas mediante los cebadores específicos rplA2/rplJ5 (34) y CLam con el par GB1/GB3 (35).
Todos los ensayos de PCR se realizaron con el sistema PCR Master Mix (Roche Diagnostics, Mannheim, Alemania), siguiendo las instrucciones del fabricante. Se usaron como controles positivos los ADN de plantas infectadas con CLas procedentes de Brasil y, como control negativo, el (o los) ADN de una planta obtenida de semillas en condiciones controladas. Se utilizó el siguiente programa de PCR: una desnaturalización inicial a 94ºC por 3 min., 38 ciclos de desnaturalización, 94ºC durante 45 seg, acoplamiento, 58ºC durante 45 seg y polimerización, 72ºC durante 60 seg con una extensión final de 72ºC por 5 min. Los productos de amplificación de las reacciones de PCR se separaron mediante electroforesis en gel de agarosa al 0,8% y se visualizaron con tinción de bromuro de etidio (0,5 ìg/ìl) (36).
Eliminación de CLas mediante microinjerto in vitro de ápices caulinares
Para el saneamiento se utilizó la técnica de MIV con las modificaciones establecidas en Cuba (37). Las plántulas patrones se obtuvieron por germinación in vitro de semillas de Citrus macrophylla Wester para los microinjertos de limero Persa y citrange Carrizo (Citrus sinensis (L.) Osb. X Poncirus trifoliata (L.) Raf.) para los de mandarinos e híbridos. Las hojas más pequeñas de los brotes se eliminaron con la ayuda de un microscopio estereoscópico hasta dejar los tres tamaños de ápices que se evaluaron en el ensayo: el meristemo apical con 2, 3 y 4 primordios foliares (pf) (0,1 - 0,4 mm) (Fig. 1A, 1B). Los ápices se insertaron en los cortes en forma de ventanas triangulares (Fig. 1C), realizados en el epicotilo de los patrones obtenidos in vitro (Fig. 1D) (37). Las plantas injertadas se colocaron en tubos con medio nutritivo líquido, compuesto por las sales minerales de Murashige y Skoog y sustancias orgánicas (37) y se mantuvieron en el cuarto de cultivo durante cinco a siete semanas. Trascurrido este tiempo, las plantas microinjertadas se reinjertaron en patrones de citrange Carrizo para acelerar su desarrollo y realizar su aclimatación en el aislador (37).
Las plantas se evaluaron de forma visual, semanalmente, a partir de los dos meses de reinjertadas y por espacio de 4 años para detectar la presencia de síntomas foliares de HLB. En cada cultivar, y para cada tamaño de ápice empleado, se comparó el porcentaje de ápices que prendieron y crecieron. También se compararon los cultivares a fin de evaluar la efectividad del método MIV. Para el análisis se empleó la comparación múltiple de proporciones según el método de Wald implementado en Compaprowin 1.0.
Diagnóstico de CLas en las plantas microinjertadas
El estado sanitario de las plantas obtenidas por microinjerto se confirmó molecularmente con el uso de la metodología de PCR anidada. Esta metodología mostró una sensibilidad analítica superior a la PCR convencional y a la PCR dúplex en estudios realizados previamente, por lo que se recomendó su uso en análisis en los que la bacteria pudiera encontrarse en concentraciones mínimas (38). Se colectaron cinco hojas de cada una de ellas a los 16 meses y se obtuvieron los extractos de ADN por la metodología de Murray y Thompson (33). Estos extractos se utilizaron como molde en reacciones de PCR anidada para la detección de CLas utilizando como cebadores externos: FD1/RP1 (generales de bacteria) (39) y cebadores internos: OI1/OI2c (específicos para CLas) (2). La metodología utilizada para la PCR anidada se estandarizó en el laboratorio del Instituto de Investigaciones en Fruticultura Tropical (38).
RESULTADOS Y DISCUSIÓN
Material vegetal y diagnóstico molecular de bacterias Candidatus Liberibacter en las plantas sintomáticas
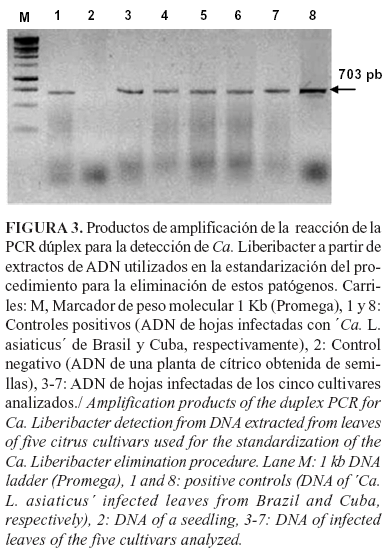
Las plantas seleccionadas de los cinco cultivares, como material de partida para la optimización del procedimiento de MIV, mostraron síntomas de moteados asimétricos difusos en las hojas y brotes cloróticos (Fig. 2). Estos síntomas fueron menos profusos en los mandarinos Parson's Special y Satsuma Tropical. En el análisis de PCR dúplex de muestras de hojas de los cinco cultivares se amplificó un fragmento de ADN con una talla de 703 pb, similar al control positivo de CLas utilizado en este ensayo y superior al de CLaf (Fig. 3). El peso de estos amplicones coincidió con el esperado (703 pb) para la detección de Clas y CLaf, según la metodología utilizada (34). La presencia de los síntomas característicos de la enfermedad (7), y la obtención de los amplicones con la talla esperada en el PCR, permitieron afirmar la presencia de CLas asociada a los síntomas de HLB en las plantas analizadas.
Eliminación de CLas mediante microinjerto in vitro de ápices caulinares
La emisión de brotes en las plantas infectadas defoliadas previamente fue abundante; sin embargo, en los mandarinos Sunburst IVIA 200-C-1 y Satsuma Tropical algunos brotes fueron deformes y otros presentaron apariencia débil o poco vigorosa. La infección crónica por las bacterias causantes del HLB o aislados severos del virus de la tristeza de los cítricos (CTV) se asoció con brotaciones erráticas. Además, muchos de los brotes emitidos por estas plantas fueron débiles cuando se utilizaron vástagos cultivados in vitro como fuentes de brotes, debido a los severos daños fisiológicos que ocasionan estos patógenos (23). No obstante, se obtuvieron suficientes brotes aptos para ser utilizados como fuentes de ápices a partir de plantas de todos los cultivares.
Con relación al prendimiento, el mejor comportamiento se observó en los cultivares mandarino Parson´s Special, tangelo Nova IVIA 74-7 y limero Persa SRA-58 que alcanzaron el 100% de ápices presos para tamaños de 3 y 4 pf y valores superiores al 60% para ápices de 2pf. En todos los cultivares se observó un incremento del prendimiento a medida que aumentó el tamaño del ápice empleado (Fig. 4).
Se consideraron como prendidos aquellos ápices que se mantuvieron vivos y con color verde por un periodo mínimo de cuatro semanas. El inicio del crecimiento de los ápices microinjertados fue perceptible a los ocho días en limero Persa SRA-58, nueve días en mandarino Parson's Special, doce días en tangelo Nova IVIA 74-7 y a los veinte días en los mandarinos Sunburst IVIA 200-C-1 y Satsuma Tropical, los que continuaron su desarrollo normal en los días posteriores (Fig. 5A).
En la medida que se utilizaron ápices de mayor tamaño se incrementó el número de microinjertos que crecieron, del cual resultó significativamente superior el porcentaje obtenido con ápices de 4 pf en comparación con los ápices de 2 y 3 pf. De los 78 ápices evaluados, 56 prendieron y de ellos más del 60% crecieron, por lo que se considera un nivel adecuado de éxito de la técnica y de obtención de plantas aptas para ser reinjertadas (Tabla 1).
Sin embargo, 22 (28,21%) de estos microinjertos que prendieron no crecieron, equivalentes al 39,29% del total de microinjertos que se realizaron. Se observó la presencia de ápices vivos que no crecen en el saneamiento de diferentes cultivares infectados con otros patógenos. Su causa pudiera estar determinada por varios factores relacionados con el patrón, la variedad, el patógeno o las condiciones ambientales de cultivo (24, 30, 31, 32). En este caso, el alto porcentaje que se obtuvo pudiera estar influido por las características de los brotes, especialmente en los cultivares de mandarinos Sunburst IVIA 200-C-1 y Satsuma Tropical, que como se describió anteriormente fueron poco vigorosos.
Diversos factores afectan el prendimiento de los microinjertos, entre ellos: la luz durante la germinación de las semillas, la edad y la variedad del patrón, la variedad a sanear y el tamaño del ápice (1, 24, 32). En este ensayo todos los factores se mantuvieron según el procedimiento estándar, excepto el tamaño del ápice, por lo que este pudiera ser el elemento de mayor incidencia en el prendimiento. Estos resultados coinciden con los informados por Navarro et al. en ensayos realizados con el cultivar de naranjo ¨Robertson Navel¨, quienes obtuvieron 47,3% de éxito con tamaño de 6 pf y se redujo a 14,6% cuando emplearon ápices de 2 pf (31, 32).
Con el procedimiento estándar el porcentaje de prendimiento varió entre 6,67% y 80% en el proceso de saneamiento de diferentes especies (1, 40). En Cuba, Zamora et al. (30) alcanzaron porcentajes de 67,41% y 71,9 % para mandarinos y limeros, respectivamente, y una media general superior al 65%, mientras que el crecimiento de los microinjertos fue de 51,79% para los mandarinos y 42,7% para los limeros.
Las 34 plantas microinjertadas obtenidas en el estudio tuvieron un desarrollo normal y estuvieron aptas para pasar a la siguiente fase (Fig. 5B) entre las 6-7 semanas posteriores al microinjerto. Finalmente, se seleccionaron por su crecimiento 31 plantas para ser reinjertadas sobre patrones de citrange Carrizo (Fig. 5C) y se conservaron en aislador durante el proceso de su desarrollo y evaluación (Fig. 5D y 5E).
Diagnóstico de CLas en las plantas microinjertadas
Las 31 plantas se mantuvieron asintomáticas durante cuatro años, independientemente del tamaño del ápice o del cultivar saneado. De manera adicional a la observación visual, no se amplificó ninguna banda en el análisis mediante PCR anidada de las muestras colectadas de todas las plantas saneadas, lo que indica que indica que las mismas no estaban contaminadas con CLas (Fig. 6).
La PCR anidada, a diferencia de la PCR convencional, utiliza dos reacciones de amplificación que aumentan considerablemente la sensibilidad (41). Es por ello que esta técnica ha sido muy utilizada en el diagnóstico de patógenos que se encuentran en concentraciones muy bajas en los extractos de ADN (35, 38, 42,43). En ensayos de validación esta técnica mostró un límite de detección de hasta 0,1 ng/ul de ADN total, equivalente a 1,1 x 102 copias del gen rplL y a 110 bacterias/gramo de tejido (38), lo que la hace adecuada para la confirmación de la sanidad de las plantas sometidas al MIV. No obstante, dicha técnica deja un margen de error que es saldado por el tiempo de observación en que se mantuvieron las plantas logradas por MIV, prolongado a cuatro años en condiciones controladas.
Se considera que los patógenos causantes de HLB son muy fáciles de eliminar con el procedimiento estándar de MIV y prácticamente el 100% de las plantas obtenidas resultan sanas. Vijayakumari et al. (40) lograron 76% y 86,95% de plantas sanas de HLB y tristeza, respectivamente, con ápices compuestos por el meristemo apical y tres primordios foliares. Sin embargo, Navarro et al. (32) obtuvieron diferencias en el saneamiento de exocortis y psorosis al incrementar los tamaños de ápices. Los porcentajes de plantas libres de psorosis decrecieron de 100% a 50% cuando la talla del ápice se incrementó de 2pf a 4pf, mientras que para exocortis se redujeron de 100% a 88,9%. Con ápices de 6pf la reducción de la eficiencia fue de 45,8% para psorosis y 83,3% para exocortis. En Cuba, la eficiencia del saneamiento con el procedimiento estándar era del 90,4% en la etapa de establecimiento de la técnica de microinjerto y se incrementó al 99,6% en la etapa de desarrollo y aplicación de la misma (30).
Los resultados obtenidos en este estudio mediante la optimización de la técnica de MIV para la eliminación de CLas coincidieron con los informados por Navarro et al. (23). Estos autores lograron el 100% de plantas libres de HLB obtenidas por MIV, a partir de brotes tomados de estacas cultivadas in vitro con ápices de 3 y 6 pf, que representan tamaños de 0,15-0,2 mm y 0,5-0,7 mm, respectivamente. Por otra parte, varios autores se refirieron controversialmente al tiempo que demoran en expresarse los síntomas característicos de la enfermedad HLB en las diferentes especies cítricas, aunque todos coinciden en que se puede extender desde los seis meses hasta dos años (9, 12, 44, 45, 46, 47).
Estas evidencias indicaron que la metodología de MIV fue exitosa en la eliminación de HLB a partir de los tejidos de los cultivares utilizados en el ensayo, incluso cuando se emplearon ápices mayores a los recomendados en el procedimiento estándar. Los resultados alcanzados permitieron corroborar el papel de la técnica de microinjerto en el SPMPCC y la eficacia para el saneamiento de especies de cítricos y géneros afines, infectados con patógenos sistémicos presentes en el país o que pudieran ingresar a causa de la situación sanitaria en la región. Adicionalmente, constituyen la primera información de cultivares libres de HLB en Cuba.
AGRADECIMIENTOS
Este estudio estuvo financiado por el Grupo Empresarial Frutícola (GEF) de Cuba, a través de los proyectos 578 y 2004.
REFERENCIAS
1. Navarro L, Juárez J. Microinjerto de ápices caulinares de cítricos in vitro. PHYTOMA. España. 2005;170:6-13.
2. Jagoueix S, Bové JM, Garnier M. The phloem-limited bacterium of greening disease of citrus is a member of the a subdivision of the Proteobacteria. Int J Syst Bacteriol. 1994;44(3):379-386.
3. Garnier M, Jagoueix-Eveillard S, Cronje P, Le Reoux H, Bové JM. Genomic characterization of a Liberibacter present in an ornamental rutaceous tree, Calodendrum capense, in Western Cape Province of South Africa. Proposal of Candidatus Liberibacter africanus subsp. capensis. Int J Syst Bacteriol. 2000;50:2119-2125.
4. Teixeira DC, Ayres AJ, Kitajima EW, Tanaka FAO, Danet JL, et al. First report of a Huaglongbing-like disease of citrus in Sao Paulo State, Brazil and association of a new Liberibacter species, «Candidatus Liberibacter americanus», with the disease. Plant Disease. 2005;89:107.
5. Capoor SP, Rao DG, Viswanath SW. Diaphorina citri Kuway. a vector of the greening disease of citrus in India. Indian J Agric Sci. 1967;37:572-576.
6. McClean APD, Oberholzer PCJ. Citrus psylla, a vector of the greening disease of sweet orange. S Afr J Agric Sci. 1965;8:297-298.
7. Bové JM. Huanglongbing: a destructive, newly-emerging, century-old, disease of citrus. Journal of Plant Pathology. 2006;88(1):7-37.
8. Li W, Levy L, John S. Hartung JS. Quantitative Distribution of `Candidatus Liberibacter asiaticus' in Citrus Plants with Citrus Huanglongbing. Bacteriology. 2009;99(2):139-144.
9. Folimonova SY, Robertson CJ, Garnsey SM, Gowda S, Dawson WO. Examination of the Responses of Different Genotypes of Citrus to Huanglongbing (Citrus Greening) Under Different Conditions. Phytopathology. 2009;99(12):1346-1354.
10.Zhao XY, Jiang YH, Qiu ZS, Su WF, Li CY. A technique of graft transmission of citrus yellow shoot disease (huanglongbing). Acta Phytopathologica Sinica. 1982;12(2):53-55.
11.Tatineni S, Sagaram US, Gowda S, Robertson CJ, Dawson WO, et al. Planta Distribution of `Candidatus Liberibacter asiaticus' as Revealed by Polymerase Chain Reaction (PCR) and Real-Time PCR. Phytopathology. 2008;98(5):592-599.
12.Lopes SA, Bertolini E, Frare GF, Martins EC, Wulff NA, et al. Graft transmission efficiencies and multiplication of `Candidatus Liberibacter americanus' and `Ca. Liberibacter asiaticus' in citrus plants. Phytopathology. 2009;99:301-306.
13.Oberholzer PCJ, von Standen DFA, Basson WJ. Greening disease of sweet orange in South Africa. Proc. 3ed Conf. IOCV. University of Florida, Gainesville. 1965; pp. 213-219.
14.McClean APD, Oberholzer PCJ. Greening disease of sweet orange: evidence that it is caused by a transmissible virus. S Afr J Agric Sci. 1965;8:253-276.
15.Marais JL, Rae M. Transmission of greening disease by various methods of inoculation. Proc. of the Symposium on Citrus Greening. Nelspruit, South Africa. 1984; pp. 62-65.
16.Su HJ. Research and Health Management of Citrus huanglongbing in Taiwan. Proc. Simposio HLB. Florida. 2008; pp. 58-93.
17.Zhao XY. Background, current situation and management of the HLB and its vector in China. II Taller Internacional de HLB, Mérida, México. 2010.
18.Zhang MQ, Powell CA, Zhou LJ, He ZL, Stover E, Duan YP. Chemical compounds effective against the citrus Huanglongbing bacterium Liberibacter asiaticus' in planta. Phytopathology. 2011;101:1097-1103.
19.Zhang MQ, Powell CA, Guo Y, Doud MS, Duan YP. A Graft-Based Chemotherapy Method for Screening Effective Molecules and Rescuing Huanglongbing-Affected Citrus Plants. Phytopathology. 2012;102(6):567-574.
20.Doud M, Zhang MQ, Powell CA, Duan YP. Thermotherapy and chemotherapy to control citrus HLB in the field. 3rd International Research Conference of Huanglongbing. (Abstract). Florida. USA. 4-7 February, 2013.
21.Fan G, Xiab Y, Lina X, Cai Z, Hu H, Wang X, et al. Evaluation of Thermotherapy against Huanglongbing (Citrus Greening) under Laboratory Condition. 3rd International Research Conference of Huanglongbing. (Abstract). Orlando, Florida. USA. February 4-7, 2013.
22.Ding F, Jin S, Hong N, Zhong Y, Cao Q, et al. Vitrificationcryopreservation, an efficient method for eliminating Candidatus Liberobacter asiaticus, the citrus Huanglongbing pathogen, from in vitro adult shoot tips. Plant Cell Rep. 2008;27:241-250.
23.Navarro L, Civerolo EL, Juárez J, Garnsey M. Improving therapy methods for citrus germplasm exchange. Proc. 12th Conf. IOCV. Riverside. 1991; pp. 400-408.
24.Navarro L. Microinjerto de ápices caulinares de cítricos in vitro y sus aplicaciones. Levante Agrícola. 1983;245:19-25.
25.González C. Diaphorina citri Kuw. (Homoptera: Psyllidae) en la citricultura cubana. Carta Circular de la RIAC. 2004;(21 y 22):23.
26.Luís M, Collazo C, Llauger R, Peña I, López D, Blanco E, et al. Huanglongbing in Cuba Citriculture. In: Proc. 11th Internacional Citrus Congress. Wuhan, China. 2008; pp. 50-51.
27.Martínez Y, Llauger R, Batista L, Luis M, Iglesia A, et al. First report of `Candidatus Liberibacter asiaticus' associated with Huanglongbing in Cuba. Plant Pathology. 2009;58(2):389.
28.Luis M, Collazo C, Llauger R, Blanco E, Peña I, et al. Occurrence of citrus huanglongbing in Cuba and association of the disease with Candidatus Liberibacter asiaticus. J Plant Pathol. 2009;91(3):709-712.
29.Llauger R, Luís M, Collazo C, Peña I, González C, et al. Huanglongbing y su vector en Cuba. Epidemiología y manejo. CitriFrut. 2010;27(2):3-8.
30.Zamora V, González M, Peña I, Pérez JM. Tres décadas del saneamiento de cultivares de cítricos en Cuba. CitriFrut. 2007;24(2):26-35.
31.Navarro L, Roistacher CN, Murashige T. Improvement of shoot-tip grafting in vitro for virus-free Citrus. J Amer Soc Hortic Sci. 1975;100:471-479.
32.Navarro L, Roistacher CN, Murashige T. Effect of size and source of shoot tips on psorosis-A and exocortis content of Navel orange plants obtained by shoot-tip grafting in vitro. Proc. 7th Conf. IOCV. Riverside, California. 1976; 194-197.
33.Murray MG, Thompson WF. Rapid isolation of high molecular weight plant DNA. Nucleic Acids Res. 1980; 239:487-491.
34.Hocquellet A, Toorawa P, Bové JM, Garnier M. Detection and identification of the two ´Candidatus Liberibacter sp´ associated with citrus huanglongbing by PCR amplification of ribosomal protein genes of the â operon. Mol Cell Probes. 1999;13:373-379.
35.Teixeira DC, Saillard C, Couture C, Martins EC, Wulff NA, et al. Distribution and quantification of «Candidatus Liberibacter americanus», agent of huanglongbing disease of citrus in Sao Paulo State, Brazil, in leaves of an affected sweet orange tree as determined by PCR. Mol Cell Probes. 2008;22:139-150.
36.Sambrook J, Fritsch EF, Maniatis T. In molecular cloning: a laboratory manual, 2nd edn. Cold Spring Harbor, NY: Cold Spring Harbor Laboratory. 1989; pp. 9.31-9.37.
37.Zamora V, Peña I, González M, González J. Instituto de Investigaciones en Fruticultura Tropical. Ministerio de la Agricultura. Metodología para la técnica de microinjerto de ápices caulinares in vitro. Cuba. 2006; 52p.
38.Collazo C, Núñez J, Luis M, Llauger R. Optimización de una reacción en cadena de la polimerasa anidada para el diagnóstico de la enfermedad «huanglongbing» de los cítricos. CitriFrut. 2011;28(2):19-30.
39.Weisburg WG, Barns SM, Pelletier DA, Lane DJ. 16S ribosomal DNA amplification forphylogenetic study. J Bacteriol. 1991;173:697-703.
40.Vijayakumari N, Ghosh DK, Das AK, Singh A, Sing S. Elimination of citrus tristeza virus and greening pathogens from exotic germplasm through in vitro shoot tip grafting in citrus. Indian Journal of Agricultural Sciences. 2006;76(3):209-210.
41.OIE. Validation and quality control of polymerase chain reaction methods used for the diagnosis of infectious diseases. Cap. 1.1.5 In: OIE (World Organization for Animal Health) terrestrial manual, OIE, Paris, France, 2008; pp. 46-55.
42.Chen J, Pu X, Deng X, Liu S, Li H, Civerolo E. A phytoplasma related to `Candidatus Phytoplasma asteri' detected in citrus showing huanglongbing (yellow shoot disease) symptoms in Guangdong, P.R. China. Phytopathology. 2009;99:236-242.
43.Wulff NA, Teixeira DC, Martins EC, Leite APR, Padiar NRH, et al. Huanglongbing diagnosis. In: Proc. Huanglongbing-Greening International Workshop, Ribeirão Preto, Brazil. 2006; pp. 17.
44.Lopes SA, Frare GF. Graft Transmission and Cultivar Reaction of Citrus to `Candidatus Liberibacter americanus'. Plant Disease. 2008;92(1):21-24.
45.Bassanezi RB, Montesino LH, Stuchi ES. Effects of huanglongbing on fruit quality of sweet orange cultivars in Brazil. European Journal of Plant Pathology. 2009;125:565-572.
46.Gottwald TR, da Graça JV, Bassanezi RB. Citrus huanglongbing: The pathogen, its epidemiology, and impact. Plant Healthy Progress. 2007.
47.Gottwald TR. Current epidemiological understanding of citrus huanglongbing. Annual Review of Phytopathology. 2010;48:6.1-6.21.
Recibido: 2-12-2014.
Aceptado: 7-1-2015.
*Autor para la correspondencia: Victoria Zamora-Rodríguez. Correo electrónico: fitopatologia8@iift.cu.