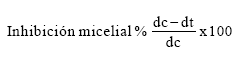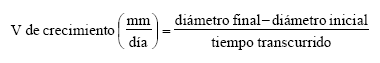Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de Protección Vegetal
versão impressa ISSN 1010-2752versão On-line ISSN 2224-4697
Rev. Protección Veg. vol.31 no.1 La Habana jan.-abr. 2016
ARTÍCULO ORIGINAL
Efecto de saponinas de Chenopodium quinoa Willd contra el fitopatógeno Cercospora beticola Sacc.
Effect of saponins of Chenopodium quinoa Willd agains the phytopatogenic fungus Cercospora beticola Sacc.
Rinel ApazaI, Hugh SmeltekopI, Yonny FloresII, Giovanna AlmanzaII, Lily SalcedoII*
ILaboratorio de Bio-orgánica, Instituto de Investigaciones Químicas, UMSA, Campus Universitario de Cota Cota, Edificio de la FCPN c. Andrés Bello y c. 27 s/n, CP 303 La Paz, Bolivia.
IIUnidad Académica Campesina Carmen Pampa-UAC-CP, Ingeniería Agronómica. Coroico - Nor Yungas - La Paz, Bolivia.
RESUMEN
Se muestra la evaluación de la actividad antifúngica de un extracto rico en saponinas que proviene de quinoa (Chenopodium quinoa Willd), obtenido de residuos del proceso industrial de beneficiado de los granos de quinoa y controlado químicamente por HPLC. La actividad se evaluó contra el hongo Cercospora beticola Sacc., plaga que afecta los cultivos de acelga. El extracto se evaluó a concentraciones de 250 mg/ml, 50 mg/ml, 5 mg/ml; 0,5 mg/ml y 0,05 mg/ml mediante dos métodos: envenenamiento del medio y evaluación (in situ) de control de C. beticola en hojas de acelga. En ambos casos, se encontró una buena actividad del extracto sobre el hongo desde una concentración de 5 mg/ml. El resultado sugiere que el uso de saponinas de quinua podría ser promisorio para combatir este fitopatógeno en cultivos de acelga y otros cultivos donde se observe incidencia del hongo.
Palabras clave: saponinas, Cercospora beticola, actividad antifúngica, Chenopodium quinoa.
ABSTRACT
In this paper, the evaluation of the antifungal activity of an extract rich in quinoa saponins (Chenopodium quinoa Willd) is presented. The extract was obtained from waste of the industrial process to benefit the quinoa grains and controlled chemically by HPLC. The activity was evaluated against the fungus Cercospora beticola Sacc. which affects the chard crop. Extract concentrations of 250 mg/ml, 50 mg/ml, 5 mg/ml, 0.5 mg/ml and 0.05 mg/ml were tested using two methods: poisoning of the culture medium and evaluation (in situ) of the control of C. beticola on chard leaves. From a concentration of 5 mg/ml, the extract showed good activity in both cases. Thus, the use of quinoa saponins is promising to control this phytopathogenic fungus in the chard crop, and other crops where the incidence of this fungus is observed.
Key words: saponins, Cercospora beticola, antifungal activity, Chenopodium quinoa.
INTRODUCCIÓN
La quinoa (Chenopodium quinoa Willd) es, desde tiempos incaicos, el alimento tradicional de la región andina. Se considerada como el grano andino de cualidades nutricionales excepcionales, debido a su contenido de proteínas y carbohidratos de alta calidad, micronutrientes y otras particularidades que la hacen un alimento funcional de gran valía (1,2). En los últimos años su cultivo aumentó considerablemente en Bolivia hasta convertirse en el principal exportador a nivel mundial.
Se aislaron más de 20 saponinas de diferentes partes de la quinoa (flores, frutos y granos) y se identificaron sus agliconas y respectivos azúcares; sin embargo, la mayor cantidad de saponinas se encuentra en el epispermo del grano, por lo que son abundantes en los residuos (mojuelo) que se desechan en el proceso de beneficiado, a través del cual se separa la cascarilla del grano por fricción (escarificado), actividad que se realiza a la quinua para consumo y exportación (3).
Las saponinas se consideran como antinutricionales en los alimentos; sin embargo, estudios recientes mostraron diversas actividades biológicas favorables para la salud, entre las que se encuentran las antibacteriana, antifúngica, disminución del colesterol y anticancerígena, entre otras (4,5). Particularmente, en las saponinas de quinua se informó la actividad antifúngica contra Botrytis cinerea (teleomorph: Botryotinia fuckeliana) (6), toxicidad frente a camarones y actividad molusquicida contra el caracol que afecta cultivos de arroz, Pomacea canaliculata Lamarck (7).
Desde 1961, se sabe que el excesivo uso de plaguicidas químicos ocasiona serios problemas para el ser humano y la naturaleza; en este sentido, se propuso el uso de las saponinas en la agricultura, visto como un bioplaguicida seguro por la Agencia de Protección Medioambiental de Estados Unidos (EPA), que tiene registrado un bioplaguicida sobre la base de saponinas de quinoa con el nombre de Heads Up y se destina, básicamente, al control de hongos y enfermedades virales, debido a las actividades que presenta como antifúngico, antiviral y molusquicida (9). Por los resultados encontrados y sus antecedentes, las saponinas de quinua representan un potencial biofungicida natural, por lo que deben continuar los estudios de optimización de su extracción y de actividad frente a otros hongos que merman la producción agrícola, del mismo modo que se realizan otras investigaciones que buscan nuevos controladores naturales (8, 9, 10,11).
Por este motivo, nuestro grupo de investigación empezó el estudio de saponinas de quinua determinando métodos para su extracción y control químico (12); se evaluó el contenido de saponinas en residuos de escarificado de quinua (18-22%) y en los extractos obtenidos con EtOH:H2O (50:50) que contienen entre 47 y 56%. Adicionalmente, se estableció una colaboración con la Unidad Académica Campesina de Carmen Pampa, ubicada en la provincia Nor Yungas de La Paz, Bolivia (13), donde existe gran interés en el uso de biopesticidas, ya que la agricultura es una importante fuente de ingresos en el lugar y las enfermedades producidas por organismos fitopatógenos, tales como bacterias, nematodos y hongos, generan grandes pérdidas en la producción agrícola (14).
Así por ejemplo, la producción de acelga (Beta vulgaris L.) en comunidades cercanas a Coroico (Nor Yungas) es significativa, pues constituye un cultivo de importancia económica para los agricultores. Cercospora beticola Sacc. es quien más afecta el cultivo. Este fitopatógeno es el principal causante de pérdidas considerables de cultivos de remolacha de azúcar y fue muy estudiado por su resistencia a fungicidas químicos (15).
Sobre la base de estos antecedentes, en el presente estudio se evaluó el efecto fungicida de un extracto de quinua rico en saponinas, obtenido de los residuos del beneficiado de quinua, contra C. beticola in vitro e in situ en cultivos de acelga.
MATERIALES Y MÉTODOS
Obtención del extracto de saponinas
Las cáscaras de quinoa real (mojuelo) se obtuvieron en la empresa Irupana Andean Organic Food. La extracción de saponinas se realizó con la mezcla de solventes EtOH:H2O (1:1) por maceración durante 72 h, con una relación de masa de mojuelo/volumen de solvente de 1/9. Después de la maceración se filtró, se extrajo el etanol por rotaevaporación en un equipo Buchi y, finalmente, se secaron las saponinas en spry dryer de laboratorio BILON. El extracto obtenido se estandarizó y controló por HPLC (12).
Aislamiento e identificación del fitopatógeno
El aislamiento del hongo C. beticola se realizó a partir de hojas de acelga infectadas, provenientes del huerto de la Unidad Académica de Carmen Pampa, y se utilizó una cámara húmeda. Luego, las hojas se colocaron en cajas Petri, herméticamente selladas y con luz fluorescente, hasta que aparecieron los primeros conidios que, posteriormente, se sembraron en agar V-8 y se incubaron a 25°C.
Se identificó el hongo fitopatógeno C. beticola por los síntomas característicos: aparición de numerosas manchas pequeñas (3-5 mm de diámetro en la madurez), redondeadas, marrones claras, a veces rodeadas de un halo marrón oscuro o rojizo sobre el limbo de las hojas maduras. En placa Petri, el crecimiento micelial es tabicado velloso blanco; mientras que sus características microscópicas fueron macroconidias con más de dos septos y las microconidias fueron pequeñas de 1 a 2 septos, con clamidosporas ovales terminales (16, 17).
Preparación de la suspensión de esporas
Al raspado del cultivo in vitro, que estaba en las cajas Petri, se le añadieron 40 ml de agua destilada en condiciones estériles; luego, la suspensión se homogenizó, se filtró con una gasa y se colocó en viales estériles. Finalmente, se llevó la suspensión a la cámara de Neubauer para el conteo.
Efecto de saponinas sobre el crecimiento micelial del fitopatógeno in vitro
El efecto de las saponinas sobre C. beticola se evaluó mediante el método del envenenamiento del medio agar V-8 con el extracto de saponina a la concentración de 500 mg/ml; posteriormente, se diluyeron para obtener las concentraciones correspondientes a 250 mg/ml, 50 mg/ml, 5 mg/ml; 0,5 mg/ml y 0,05 mg/ml, utilizando el agar como diluyente aún en estado líquido a 50°C. Cada medio (10 ml) se vertió en placas Petri estériles de 12 cm de diámetro, de acuerdo a la metodología descrita por Cruz-Triana et al. (18).
La inoculación del fitopatógeno se realizó en el centro de cada placa, donde se inocularon 100µl de la suspensión conidial (107/ml por superficie) en un radio de 5 mm y se incubó a 25°C. El testigo solo contenía agar V-8 y se realizaron cinco réplicas por tratamiento.
Para calcular el porcentaje de inhibición del desarrollo de C. beticola se utilizó la siguiente fórmula (19):
Donde:
• dc = diámetro del micelio del control en mm
• dt = diámetro del micelio del tratamiento en mm
La evaluación se realizó cada 24 horas y durante 144 horas, midiendo en ocho orientaciones porque este patógeno se desarrolla radialmente.
Para la velocidad de crecimiento micelial se utilizó la siguiente fórmula:
Evaluación de control de la Cercospora beticola con saponina in situ
Se colectaron hojas de acelga sanas, para lo cual se trasladaron al laboratorio y se hicieron cortes de 5x5 cm, se desinfectaron con hipoclorito de sodio al 5% durante 1 minuto, seguido de un lavado en agua esterilizada para eliminar los restos de hipoclorito de sodio; posteriormente, se dejaron las hojas de acelga desinfestadas sobre papel filtro estéril; luego, se colocaron dentro de las cajas Petri sobre papel de filtro húmedo.
Se aplicaron, homogéneamente, las diferentes concentraciones de saponinas (250 mg/ml; 50mg/ml; 5mg/ml; 0,5 mg/ml y 0,05 mg/ml) en la superficie de las hojas. La inoculación se realizó con la suspensión de conidios. En cada tratamiento se aplicó una dosis de 100 µl de suspensión con una concentración de 107conidios x ml-1 en la parte central del haz de la hoja de acelga; finalmente, se sellaron las placas Petri y se incubaron a 25°C. En los testigos negativos no se inoculó el hongo y para los testigos positivos no se colocaron las saponinas. Se realizaron cinco réplicas de cada prueba.
La incidencia de la C. beticola se evaluó cada 24 horas por seis días; para ello se utilizó la escala de valores en porcentaje de área afectada según Goidanich 1959, citado por Malaguti (20).
Análisis estadístico
Para la interpretación de los datos se utilizaron el análisis de varianza simple para comparar las variaciones existentes entre los tratamientos y la prueba Duncan (p<0,05) para determinar las diferencias significativas entre los tratamientos; para ello se utilizó el programa SAS (Sistema de análisis estadístico).
RESULTADOS Y DISCUSIÓN
Efecto de saponinas sobre el crecimiento micelial del fitopatógeno in vitro
A partir de las 72 horas se produjo, en todos los tratamientos, reducción del crecimiento micelial del patógeno con respecto al control, donde las concentraciones de saponinas entre 5 mgxml-1 hasta 250 mgxml-1 fueron altamente efectivas y cuya inhibición está cerca del 95%, sin diferencias significativas. La concentración de 0,5 mgxml-1 produjo una inhibición de 62,5% a 76,6 % entre las 72 y 144 horas, incluso la menor concentración (0,05 mgxml-1) produjo alrededor del 50% de inhibición (Tabla 1, Figura 1).
La dinámica de crecimiento de C. beticola, en presencia de saponinas de quinoa a diferentes concentraciones, evidenció la existencia de diferencias significativas con relación al testigo (Fig. 1).
El fitopatógeno C. beticola, sin intervención del extracto (testigo), tuvo mayor crecimiento en relación con los demás tratamientos a partir de 96 horas, pues alcanzó 30 mm a las 144 horas. El patógeno, en la concentración 0,05 mgxml-1, tuvo mayor crecimiento que en las concentraciones mayores; sin embargo, resultó interesante el hecho de que, a esta concentración, el efecto inhibitorio es aún considerable (53,3%). En las concentraciones de 5 mgxml-1, 50 mgxml-1 y de 250 mgxml-1 que alcanzaron entre 1,5 y 1,75 mm de desarrollo, prácticamente no existen diferencias, por lo que se puede indicar que la concentración efectiva in vitro, para el control del desarrollo de C.beticola, es de 5 mgxml-1.
Efecto de saponinas sobre el crecimiento micelial de Cercospora beticola en hojas de acelga
Los tratamientos de saponina de cáscaras de quinoa sobre hojas de acelga tuvieron efecto sobre el crecimiento de C. beticola, evidenciado en la existencia de diferencias significativas a partir de las 96 horas.
El fitopatógeno sin aplicación del extracto de saponina (testigo) presentó mayor crecimiento, en comparación con los demás tratamientos, lo que mostró diferencias significativas con relación a los tratamientos con la aplicación de saponinas hasta las 144 horas, llegando al 20% de desarrollo. En el tratamiento con 0,05 mgxml-1 el fitopatógeno tuvo mayor crecimiento, pues alcanzó al 11,25% en comparación con las de mayor concentración. Es de notar que la aplicación de 5 mgxml-1 de saponina ejerció un efecto considerable en el desarrollo de C. beticola, que llega al 5,25%. Los tratamientos con concentraciones mayores (50 mgxml-1 y 250 mgxml-1) mostraron un efecto similar en el desarrollo del fitopatógeno con el 2,5% y 2,25% en comparación con el control (Tabla 2).
De acuerdo a los resultados, los extractos de saponinas obtenidos a partir de cascarilla de quinoa (mojuelo), son una buena alternativa para controlar el hongo C. beticola. La concentración recomendada es de 5 mgxml-1 porque evidenció una alta inhibición, cerca del 75% con relación al testigo. Sin embargo, es importante hacer notar que estos resultados corresponden a extractos con una concentración de 55% de saponinas de quinua (12), por lo que sería recomendable hacer pruebas con extractos con mayor contenido de saponinas. Adicionalmente, estudios previos mostraron que hay dos tipos de saponinas de quinua: las saponinas monodesmosídicas y las bidesmosídicas. Normalmente tienen mayor actividad fungicida las monodesmosídicas (6), por lo que también sería recomendable realizar pruebas con extractos con mayor proporción de saponinas monodesmosídicas.
Los resultados complementan los estudios previos y ofrecen mayor soporte para la utilización de los residuos del escarificado de quinua en la obtención de un producto antifúngico, lo cual proporcionaría una alternativa que apoyaría a la cadena de la quinua en Bolivia y a los agricultores de zonas húmedas interesados en cultivos orgánicos de legumbres.
El fitopatógeno C. beticola no solo afecta a cultivos de acelga, también tiene una gran incidencia en la remolacha azucarera (Beta vulgaris L.); causa la mancha foliar que produce grandes pérdidas económicas a la industria azucarera que, adicionalmente, aumentó considerablemente la resistencia de C. beticola a pesticidas convencionales en los últimos años (21). Esto motivó que se busquen nuevas alternativas para su control, como el uso de variedades de remolacha azucarera de mayor tolerancia y el estudio de aspectos genéticos de C. beticola (22, 23). En este sentido, la utilización de saponinas para su control es una alternativa natural y promisoria.
Las saponinas poseen cualidades biológicas de gran interés, por lo que fueron objeto de diversos estudios. Se destaca su efecto piscida, insecticida, antiprotozoos, antiinflamatorio, leishmanicida, antitrichomonas, antiagregante plaquetario, broncolítico, hipocolesterolémico (5, 6, 24) y anticancerígeno (25). Existen referencias alentadoras acerca del efecto de saponinas sobre hongos fitopatógenos, como la actividad de saponinas de quinoa (5 mgxml-1) que se tratan con álcalis y se aplican sobre Botrytis cinerea y eliminan la germinación del 100% de los conidios (7), lo que sustenta la posible optimización de extractos de saponinas, modificados químicamente para mejorar la actividad antifúngica. La capacidad de formar complejos con esteroles, proteínas y fosfolípidos de membranas, representa el principal mecanismo de actividad antifúngica de las saponinas (6,26), el cual debe aprovecharse para continuar estudios de optimización del extracto de saponinas, con la finalidad de mejorar la actividad antifúngica frente a fitopatógenos que merman la producción agrícola.
AGRADECIMIENTOS
Se agradece a la Agencia Sueca ASDI por el financiamiento a los proyectos «Estudio de la Biodiversidad Vegetal» y «Plaguicidas Orgánicos a partir de Especies Vegetales Andinas de Bolivia (Parte I)», al proyecto «Plaguicida orgánico antifúngico de saponinas de plantas andinas de La Paz» financiado con fondos gubernamentales IDH y a la Empresa Irupana Andean Organic Food S.A. por la donación de cáscaras de quinoa.
REFERENCIAS
1. Ruales J, Nair BM. Nutritional quality of the proteins in quinoa (Chenopodium quinoa Willd) seeds. Plant Food Human Food Nutr. 1992;42:1-11.
2. Knishi Y, Hirano S, Tsubol H, Wada M. Distribution of minerals in quinoa (Chenopodium quinoa Willd) seeds. Biosci Biotechnol Biochem. 2004;68:231-234.
3. Kuljanabhagabad T, Thongpasuk P, Chamulitrat W, Wink M. Triterpene saponins from Chenopodium quinoa Willd. Phytochemistry. 2008;69:1919-1926.
4. Shi J, Xue SJ, Li D, Ma Y, Kakuda Y, Lan Y. Kinetic study of saponins B stability in navy beans under different processing conditions. J Food Eng. 2009;93:59-65.
5. Wang Y, Zhang Y, Zhu Z, Zhu S, Li Y, et al. Exploration of the correlation between structure, hemolytic activity and cytotoxicity of steroid saponins. Bioorg Med Chem. 2007;15:2538-2542.
6. Stuardo M, San Martín R. Antifungal properties of quinoa (Chenopodium quinoa Willd) alkali treated saponins against Botrytis cinerea. Ind Crops Prod. 2008;27:296-302.
7. San Martin R, Ndjoko K, Hostettmann K. Novel molluscicide against Pomacea caniculata based on quinoa (Chenopodium quinoa) saponins. Crop Protection. 2008;27:310-317.
8. Estrada A, Redmond MJ, Laarveld B. Quinoa saponin compositions and methods of use Saskatoon, (Patente norteamericana) US005688772A Canada, 1997.
9. Hernández AN, Bautista S, Velázquez MG. Prospectiva de extractos vegetales para controlar enfermedades postcosecha hortofrutícolas. Rev Fitotec Mex. 2007;30(2):119-123.
10.Igbinosa OO, Igbinosa EO, Aiyegoro OA. Antimicrobial activity and phytochemical screening of stem bark extracts from Jatropha curcas (Linn). Afr J Pharm Pharmacol. 2009;3(2):58-62.
11.Benítez T, Rincón AM, Limón MC, Codón A. Biocontrol mechanisms of Trichoderma strains. Int Microbiol. 2004;7:249-260.
12.Lozano M, Ticona E, Carrasco C, Flores Y, Almanza G. Cuantificación de saponinas en residuos de quinua real (Chenopodium quinoa Willd). Rebolquim. 2012;29(2):128-135.
13.Plan de Desarrollo Municipal. Fondo Nacional de Desarrollo. Provincia Nor Yungas. La Paz -Bolivia. 2010.
14.Benítez T, Rincón AM, Limón MC, Rey M, Delgado-Jarana J. Mejora de cepas de Trichoderma para su empleo como biofungicidas. Rev Iberoam Micol. 2000;17:S31-S36.
15.Karaogladinis GS, Loannidis PM, Thanassoulopoulos CC. Reduced sensitivity of Cercospora beticola isolates to sterol demethylation inhibiting fungicides. Plant Pathology. 2000;49:567-572.
16.Pons N, Sutton B, Gay JL. Sociedad Venezolana de Fitopatología. Ultraestructura de la conidiogenesis en Cercospora beticola. Memorias. 1985.
17.Agrios GN. Plant Pathology, New York, Academic Press, 1969.
18.Cruz-Triana A, Rivero-González D, Martínez-Coca B, Ramírez-Arrebato M, Rodríguez-Pedroso A. Actividad antifúngica in vitro de la quitosana sigma frente a hongos fitopatógenos causantes del manchado del grano en el cultivo de arroz (Oryza sativa L.). Fitosanidad. 2009;13(2):32-38.
19.Singh G, Singh OP, De Lampasona MP, Catalán AN. Studies on essential oils. Chemical and biocidal investigations on Tagetes erecta leaf volatile oil. Flavour Fragr J. 2003;18:62-65.
20.Malaguti G. Apuntes acerca de las enfermedades de las plantas, causas y controles. Maracay, Facultad de Agronomía, Universidad Central de Venezuela, 1997.
21.Weiland J, Koch G. Pathogen profile Sugarbeet leaf spot disease (Cercospora beticola Sacc.). Mol Plant Path. 2004;5(3):157-166.
22.Schmidt K, Pflugmacher M, Klages S, Mäser A, Mock A, Stahl D. Accumulation of the hormone abscisic acid (ABA) at the infection site of the fungus Cercospora beticola supports the role of ABA as a repressor of plant defence in sugar beet. Mol Plant Path. 2008;9(5):661-673.
23.Bolton M, Rivera V, Secor G. Identification of the G143A mutation associated with QoI resistance in Cercospora beticola field isolates from Michigan, United States. Pest Manag Sci. 2013;69:35-39.
24.Mena-Valdés L, Tamargo-Santos B, Salas-Olivet E, Plaza-Paredes LE, Blanco Hernández Y, et al. Determinación de saponinas y otros metabolitos secundarios en extractos acuosos de Sapindus saponaria L. (jaboncillo). Rev Planta Med. 2015;20(1):106-116.
25.Xiao-Shu Z, Jia-Qing C, Chen Z, Xu-de W, Xiao-jun W, Yu-Qing Z. Novel dammarane-type triterpenes isolated from hydrolyzate of total Gynostemma pentaphyllum saponins. Bioorg Med Chem Lett. 2015;25(16):3095-3099.
26.Montes-Belmont R. Diversidad de compuestos químicos producidos por las plantas contra hongos fitopatógenos. Rev Mex Mic. 2009;29:73-82.
Recibido: 26-10-2015.
Aceptado: 22-1-2016.
*Autor para correspondencia: Lily Salcedo. Correo electrónico: liluz2004@gmail.com.