Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de Protección Vegetal
versão impressa ISSN 1010-2752versão On-line ISSN 2224-4697
Rev. Protección Veg. vol.31 no.3 La Habana sept.-dez. 2016
ARTÍCULO ORIGINAL
Consumo y respuesta funcional de Nesidiocoris tenuis Reuter (Hemiptera: Miridae) frente a estadios inmaduros de Bemisia tabaco Gennadius (Hemiptera: Aleyrodidae)
Consumption and functional response of Nesidiocoris tenuis Reuter (Hemiptera: Miridae) feeding on immature stages of Bemisia tabaci Gennadius (Hemiptera: Aleyrodidae)
Heyker L. Baños,I Tay Ruiz Gil,II Marbely del Toro Benitez,I Ileana Miranda Cabrera,I
ILaboratorio de Entomología-Acarología, Dirección de Sanidad Vegetal, Centro Nacional de Sanidad Agropecuaria (CENSA), Apartado 10, San José de las Lajas, La Habana, Cuba.
IIFacultad de Biología, Universidad de la Habana (UH), La Habana, Cuba.
RESUMEN
Con el objetivo de determinar la capacidad de Nesidiocoris tenuis Reuter, para regular poblaciones de Bemisia tabaco Gennadius biotipo B, se evaluó el consumo y la respuesta funcional del depredador frente a huevos y ninfas de la plaga, bajo condiciones de laboratorio; como sustrato se usaron plantas de tomate Solanum lycopersicum L. cv. L43. Se determinó, además, el índice de preferencia para huevos y ninfas: se evidenció mayor preferencia por las ninfas (α = 0,6). El número medio de huevos y ninfas de mosca blanca consumido por el mírido en un día fue 100 y 192, respectivamente. La respuesta funcional de las hembras de N. tenuis para ninfas describió una curva sigmoidea, por lo que se pudo clasificar como tipo III. Las hembras de N. tenuis fueron depredadores voraces para los estados inmaduros de B. tabaci, lo cual convierte a este enemigo natural en una alternativa viable para los actuales métodos de control biológico en tomate en Cuba.
Palabras clave: control biológico, Cuba, mírido, Mosca blanca, tomate.
ABSTRACT
To determine the capacity of Nesidiocoris tenuis Reuter to regulate populations of Bemisia tabaci Gennadius biotype B, the consumption and functional response of the predator to eggs and nymphs of the pest were evaluated on tomato plants as a substrate under laboratory conditions. This predator showed a higher preference for nymphs (α = 0.6) than for eggs. The average of whitefly eggs and nymphs consumed by the mirid in one day was 100 and 192, respectively. The functional response of N. tenuis females to nymphs described a sigmoid curve, which could be classified as type III. The females of N. tenuis were voracious predators for the immature stages of B. tabaci, which makes this natural enemy a viable alternative for the current biological control methods in tomato in Cuba.
Key words: biological control, Cuba, mirid, whitefly, tomatoes.
INTRODUCCIÓN
En la actualidad, se considera Bemisia tabaci Gennadius (Hemiptera: Aleyrodidae) como plaga perjudicial y extendida mundialmente. Debido a su creciente importancia, desde el año 2000 se encuentra incluida en la lista de la Unión Internacional para la Conservación de la Naturaleza (UICN) “100 de las especies exóticas invasoras más dañinas del mundo” (1). A esta especie de mosca blanca se le atribuye la capacidad de transmitir alrededor de 200 diferentes tipos de virus (2). Según su importancia económica, superficie cultivada y niveles de daño, los principales hospedantes son: tomate, frijol, melón, sandía, algodón, pimiento verde, pimiento picante, soya y yuca (3).
De los biotipos existentes de esta plaga, en América Latina el más distribuido es el biotipo B, considerado el más perjudicial, debido a su amplia gama de plantas hospedantes, velocidad reproductiva y generación de resistencia a insecticidas (4,5).
El uso indiscriminado de plaguicidas sintéticos a nivel mundial ha provocado graves daños en los ecosistemas cultivados, dentro de los cuales se puede citar la pérdida de biodiversidad, la contaminación de suelos y cultivos, daños a la salud humana y desarrollo de plagas más resistentes (6,7). En la búsqueda de alternativas menos agresivas y sustentables para la protección de cultivos, en los últimos años se ha incrementado el interés en el uso, desarrollo, evaluación y conservación de enemigos naturales (EN) como Agentes de Control Biológico (ACB).
Actualmente, el interés en la conservación de enemigos naturales aumentó, por lo que el control biológico por conservación se posiciona como una alternativa cada vez más viable para el manejo de insectos plagas y para reducir el efecto de estas sin la liberación de ACB; todo esto basado, fundamentalmente, en la modificación del ecosistema ya existente. Esta estrategia está orientada a incrementar la abundancia y la diversidad de la fauna auxiliar empleando diferentes vertientes, como son el manejo del hábitat y la ecología química. Ambas conducen a estabilizar la relación cultivo-plaga-enemigo natural y mantienen las plagas por debajo del umbral de daño económico (8,9).
A nivel mundial se utilizan diversos enemigos naturales para el manejo de las poblaciones de B. tabaci, entre los que se encuentran algunos depredadores de la familia Miridae (Hemiptera), capaces de controlar, además, diversas plagas como trips, minadores, arañas rojas y estadios inmaduros de lepidópteros (10).
Dentro de esta familia se destacan, principalmente, tres géneros: Nesidiocoris, Macrolophus y Dicyphus. En Cuba se encuentran con mucha frecuencia y abundancia estas especies, sobre todo Nesidiocoris tenuis Reuter, en cultivos de gran importancia como el tomate, el tabaco, el pimiento y otras solanáceas (11). Este depredador se informó como enemigo natural de moscas blancas en cultivos protegidos (12, 13).
Tomando en cuenta la alta eficacia mostrada N. tenuis en el control de B. tabaci, tras sus apariciones de forma natural, tanto en cultivos protegidos como en campo abierto (11), se hace necesario acometer estudios biológicos del depredador que ofrezcan elementos para su utilización en programa de control biológico. El objetivo de este trabajo fue evaluar el consumo, la respuesta funcional y la preferencia de N. tenuis usando como presas estadios inmaduros de B. tabaci.
MATERIALES Y MÉTODOS
Los experimentos se desarrollaron entre enero y abril de 2015, en los Laboratorios de Entomología-Acarología del Centro Nacional de Sanidad Agropecuaria (CENSA), Mayabeque, Cuba.
Los datos de la temperatura y la humedad relativa se obtuvieron con un higrómetro digital marca Testo (EE±0,01) y los valores promedio (±D.E) fueron de 26,7ºC (±1,3ºC) y 66,4% (±8%) respectivamente, con un fotoperiodo natural 10L: 14O.
Se estableció una cría de N. tenuis de acuerdo a la metodología adaptada por Lins (14), a partir de 250 individuos recolectados durante muestreos en parcelas de tomate en el Instituto de Investigaciones Hortícolas “Liliana Dimitrova”, de la misma provincia. Los ejemplares se recolectaron con un aspirador y se colocaron en tubos plásticos de 14 ml para su transportación hacia el destino final.
En el laboratorio, los adultos se liberaron en jaulas acrílicas (30x30x60cm), con plantas de Solanum lycopersicum L. cv. L43, de 25 cm de altura, usadas como sustrato de ovoposición. Una vez en las jaulas, los depredadores se alimentaron ad libitum, dos veces por semana con estadios inmaduros de B. tabaci procedentes de una cría de laboratorio.
Capacidad de consumo y preferencia
El área de forrajeo la constituyó una placa Petri de 5 cm de diámetro con un disco de una hoja de tomate (S. lycopersicum cv.L43) colocado sobre una capa de agar agua (1%). Para evaluar la capacidad de consumo del depredador, frente a estados inmaduros de B. tabaci, se evaluaron seis tratamientos para el caso de los huevos (20, 40, 80, 160, 320, 450 huevos/placa) y cuatro para las ninfas (20, 40, 80,160 ninfas de primer estadio/placa) que se replicaron cinco veces en cada caso.
En cada área de forrajeo se liberó una hembra del depredador, procedente de la cría de laboratorio, y se mantuvo en tubos de vidrio con un algodón con agua y sin acceso a alimento durante las 24 horas previas al experimento. Por cada densidad de presa, se determinó el consumo del depredador a las 24, 48 y 72; para ello se tuvo en cuenta la diferencia entre el número inicial y el final de presas.
Preferencia con opción de escoger presa
Para evaluar la preferencia de N. tenuis frente a huevos y ninfas de B. tabaci, se depositó una hoja de tomate (S. lycopersicum L43) en una placa Petri 9 cm de diámetro, con una capa de agar agua (1%), donde se situaron 20 huevos y 20 ninfas de B. tabaci. Paralelamente, se colocaron ocho hembras del depredador, de manera individual, en tubos de vidrio con un algodón embebido en agua y sin acceso a alimento durante 24 horas previas al experimento. En cada placa se liberó una hembra del depredador, se retiró trascurridas 24 horas con un aspirador manual. Luego, se procedió a contar el número de huevos o ninfas no consumidas por el depredador. El experimento se repitió tres veces.
La preferencia del depredador se analizó utilizando el Índice de preferencia de Chesson (15):
![]()
Donde:
El índice αi es la preferencia del depredador por las presas pertenecientes a la clase i de presa
ri = número de presas consumidas pertenecientes a la clase i
Pi = número inicial de presas pertenecientes a la clase i
m = número de diferentes clases de presas.
Si todas las α son iguales a 1/m, entonces la selección de la presa es completamente al azar. En este caso, donde existen dos tipos de presa, la selección será al azar si α=0,5; donde sea mayor que este valor, habrá selección positiva sobre la presa y, en el caso contrario, la selección será negativa o se producirá una tendencia a evitar la presa.
Respuesta funcional
A partir de los resultados en la evaluación del consumo a diferentes densidades, se determinó la respuesta funcional para las primeras 24 horas de la presa de mayor preferencia. El tipo de respuesta funcional (Tipo II o III) se determinó por análisis de regresión logística de la proporción de presa consumida en relación con el número de presas ofrecidas (16, 17); se usó el paquete estadístico SAS/STAT 9.0 (18). En la regresión logística se utilizó un modelo cúbico:
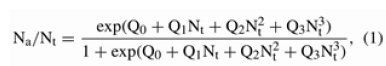
Donde:
Na: Número de presas consumidas
Nt: Número de presa ofrecida
Q0, Q1, Q2 y Q3: Parámetros que se estimaron
Si el parámetro linear Q1 es negativo, entonces la respuesta funcional es del Tipo II, mientras que un parámetro linear positivo indica una depredación denso-dependiente y por tanto una respuesta funcional Tipo III (26).
Al procesar los datos se ajustaron al modelo de respuesta funcional Tipo III para situaciones con disminución de presa (19,20):
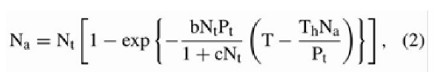
Donde:
Pt: número de depredadores (en este caso Pt=1)
T: tiempo total disponible para la búsqueda (en este caso T=48 h)
Th: tiempo de manipulación (h)
b y c son constantes que describen la relación entre la tasa de búsqueda a´ (h-1) y el número de presas disponibles (21):
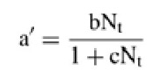
Los estimados para el tiempo de manipulación (Th) y las dos constantes (b y c) se obtuvieron al aplicar un análisis de regresión no linear a los datos (22).
RESULTADOS Y DISCUSIÓN
Consumo y preferencia
Como tendencia general, en el consumo de huevos de B. tabaci por N. tenuis, se observó una relación entre la depredación y la cantidad de presas ofrecidas de 1:2 aproximadamente; además, con mayor consumo en las primeras 24 horas, seguido de un periodo de poco consumo (48 horas) que mostró, posteriormente, un aumento en la capacidad de depredación y consumiendo el número restante de presa ofrecida a las 72 horas (Figura 1 A).
En el caso de las ninfas, las mayores tasas de consumo se produjeron en las primeras 24 horas, aunque en este caso el número de presas restantes se consumió, principalmente, en las 24 horas siguientes. El mayor consumo de presas ocurrió en las densidades más altas, con un valor de consumo máximo de 192 huevos, a partir de un número inicial de 450 huevos/placa; sin embargo, a una densidad inicial de 160 huevos/placa, el valor máximo de consumo de ninfas fue de 100. Para los tratamientos de menor cantidad de presas ofrecidas, los valores máximos de consumo fueron de ocho huevos y 12 ninfas para la densidad inicial de 20 presas/placa, respectivamente (Figura 1B).
Al comparar el consumo de huevos y ninfas durante 24, 48 y 72 horas, se constató que el consumo de ninfas fue mayor en las primeras 24 horas, en contraste con el resto del tiempo evaluado. Sin embargo, para los huevos, en las primeras 24 horas el consumo podría ser debido al ayuno al que fueron sometidos los insectos 24 horas previas al experimento (23). Lo anterior podría explicar que el consumo de N. tenuis en el segundo día (48h) fuese inferior, debido a que solo comió lo esencial para saciar su apetito. Por otra parte, cuando las presas son más pequeñas, el depredador gasta más tiempo y energía para localizar, por lo que nuevamente causó un desperdicio de energía; esto explicaría el aumento general del consumo en el tercer día por la necesidad de alcanzar su umbral energético.
En cuanto a la preferencia por las presas, el índice de Chesson (15) calculado mostró, para el caso de las ninfas B. tabaci, un valor de alfa mayor que para el caso de los huevos (α=0,6). Según este autor, cuando alfa es superior a 0,5 habrá selección positiva sobre la presa. En este caso, α=0,6 sugiere una mayor preferencia por ninfas que por huevos. Es importante señalar que muchos factores pueden estar involucrados en la decisión de selección de un depredador.
Los modelos de forrajeo óptimo, basados en el valor calórico y nutricional de la presa, predicen que la calidad nutricional puede ser el criterio más importante que los depredadores tienen en cuenta durante la selección de la presa (24). Por lo tanto, las presas con un mayor valor nutricional pueden influir en mejores desempeño, salud y eficacia del depredador, por ello son consumidas en una mayor proporción que otras.
Para el caso de N. tenuis, las ninfas de B. tabaci constituyen presas con un nivel nutricional alto, según muestran los resultados experimentales; esto pudiera deberse a la acumulación de nutrientes y agua por parte de las ninfas. También es posible que el depredador pudiera sentirse más atraído por los volátiles emitidos por la planta durante la alimentación de las ninfas (HIPs), que por los que son emitidos durante la puesta de los huevos por las hembras de B. tabaci (OIPs) (14, 25).
Es posible que el tamaño de la presa represente otro criterio implicado en su selección y pueda desempeñar una función en la preferencia de este predador en las condiciones experimentales descritas, ya que la tasa de encuentro puede ser mayor en presas más grandes (14). Por su parte, Jaworski et al. (26) demostraron que en presencia de dos tipos de presas, Tuta absoluta Meyrick y B.tabaci, se observó una mayor población de depredadores y una menor densidad de población de ambas presas que cuando una única presa estaba presente, por lo que aparentemente se produjo competencia.
Según Maselou et al. (27), el comportamiento depredador de los insectos no se altera con el grado de apetito; teniendo en cuenta este criterio, el efecto del ayuno puede ser descartado en este caso. Sin embargo, estos autores demostraron una depredación significativamente mayor en Macrolophus pygmeus Rambur cuando se privó de presa (Mysus persicae Sulzer) y sustrato (hojas de pimiento) durante 48h.
Más que la calidad nutricional, la movilidad puede ser otro criterio importante que usan algunos depredadores en la selección de la presa. En este estudio, ambas presas son sésiles, pero es importante señalar que los depredadores generalistas, como N. tenuis, se orientan visualmente, por lo que pueden emplearse más efectivamente en contra de especies de presas con gran movimiento en programas de control biológico o contra especies presa, relativamente sésiles cuando la presa de mayor movilidad no es abundante (12).
La capacidad del predador N. tenuis de alimentarse de presas en ambos estadios hace que sea capaz de regular poblaciones de B. tabaci; de ahí la importancia de su incorporación y/o preservación en el agroecosistema, incluso antes de la llegada de la plaga.
Respuesta Funcional
La respuesta funcional de las hembras de N. tenuis reflejó un aumento en la actividad depredadora con relación al incremento en la densidad de la presa B. tabaci (Figura 2) hasta alcanzar un valor alrededor de 140 ninfas consumidas en 24 horas.
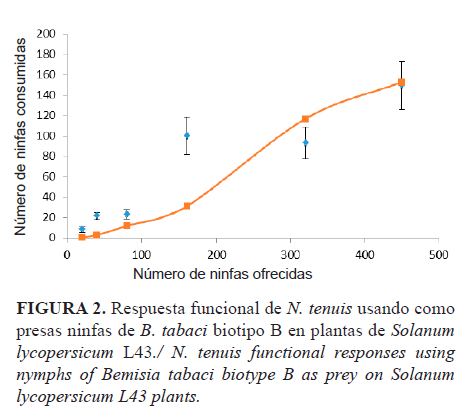
El análisis logístico (modelo Hassell) mostró que las hembras de N. tenuis presentan una respuesta funcional Tipo III frente a ninfas de B. tabaci. En este caso, la tasa de ataque aumenta a medida que se incrementa la densidad de ninfas suministradas al depredador, lo que evidencia un proceso de aprendizaje del depredador frente a las diferentes densidades de presas. En estas condiciones, el tiempo de manipulación es de 11min 4s por presa consumida, con un coeficiente de determinación (R2) del 96%.
Las curvas de consumo para artrópodos depredadores a diferentes densidades de presa frecuentemente se adecuan a una respuesta funcional tipo II. En este tipo de curva los depredadores incrementan su consumo de presas con el aumento de la disponibilidad de presas en una tasa decreciente hasta alcanzar la meseta (28).
Los resultados revelaron que N. tenuis mostró una respuesta positiva densodependiente al incrementar su eficiencia de búsqueda hasta alcanzar su densidad umbral de 64 ninfas de B. tabaci/arena experimental. A altas densidades de presa, la tasa de ataque de este depredador tiende a aumentar (Tabla 1) y sugiere que N. tenuis incrementa su efectividad a medida que la población se incrementa.
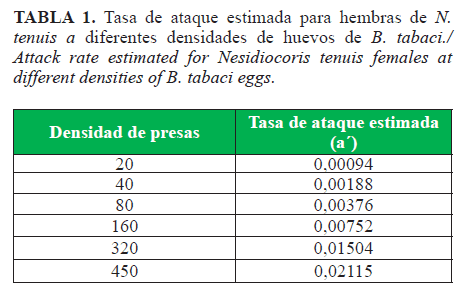
Las diferencias en la forma de las respuestas funcionales de los depredadores pueden depender de las especies presa, su tamaño y apariencia, distribución de la presa, disponibilidad de presas alternativas, preferencia, edad del depredador y el nivel de hambre (29,30).
Resultados similares encontraron Valderrama et al. (31) cuando este parámetro se evaluó frente a dos especies de presas. Como resultado obtuvo una respuesta funcional tipo III con M. persicae como presa; mientras tanto, para T. vaporariorum describió una curva tipo II. Otros autores informaron respuestas funcionales de tipo II para los míridos Dicyphus tamaninii (Knight), Campyloneuropsis infumatus (Carvalho), Macrolophus basicornis (Stal) y M. pygmaeus frente a diferentes presas como T. vaporariorum, Frankliniella occidentalis (Pergande), Tetranychus urticae Koch y T. absoluta (14) que estos depredadores pueden ser efectivos, incluso en densidades de presa bajas.
Sin embargo, Sharifian et al. (32) observaron que, en presencia de T. absoluta y Ephestia kuehniella Zeller como presas, los depredadores N. tenuis y M. pygmeus exhibieron respuestas funcionales del tipo II. Además, el índice de depredación fue significativamente diferente entre los depredadores, aunque N. tenuis fue más eficiente frente a los huevos de T. absoluta que M. pygmaeus.
Lampropoulos et al. (33) demostraron que los depredadores M. pygmaeus y N. tenuis, que se alimentaron con las ninfas de T. vaporariorum, exhibieron respuestas funcionales tipo II. Sin embargo, Cabello et al. (34) observaron que N. tenuis puede cambiar su respuesta funcional en dependencia de la condición de la presa de tipo II (presas no parasitadas) a tipo I (cuando hubo una combinación de presas parasitadas y no parasitadas), con un aumento de la tasa de búsqueda instantánea (a ‘) y una disminución del tiempo de manipulación (Th), lo que indica que el comportamiento de alimentación del depredador puede variar en función de la condición de presa.
Sin embargo, teniendo en cuenta esta clase de respuesta del depredador para B. tabaci, serían necesarias liberaciones frecuentes de depredadores para controlar la plaga. Según Juliano (22), un depredador con una respuesta funcional de tipo III depende de la densidad, aumenta la eficiencia de búsqueda a altas densidades de presa y disminuye el tiempo de manipulación de la misma. La premisa principal de la respuesta tipo III es que el depredador es capaz de intensificar su actividad de búsqueda cuando aumenta la densidad de las presas.
Los estudios realizados mostraron que N. tenuis presentó una respuesta positiva denso-dependiente al incrementar su eficiencia de búsqueda hasta alcanzar su densidad umbral de 140 ninfas de B. tabaci en 24 horas. Aunque aún se deben realizar otros estudios para determinar posibles métodos y tasas de liberación, los resultados de laboratorio demostraron que N. tenuis puede ser un candidato promisorio a tener en cuenta para el control biológico de B. tabaci.
REFERENCIAS
1. Lowe S, Browne M, Boudjelas S, Poorter M. 100 de las Especies Exóticas Invasoras más dañinas del mundo. Una selección del Global Invasive Species Database. Grupo Especialista de Especies Invasoras (GEEI) de la Unión Mundial para la Naturaleza (UICN), 2000, 12pp.
2. Fiallo-Olivé E, Martínez-Zubiaur Y, Hernández-Zepeda C, Carrillo-TripJ, Rivera-Bustamante F. Identificación de nuevos begomovirus en Cuba mediante el empleo de la amplificación por círculo rodante. Rev. Protección Veg. 2009;24(2):2-6.
3. Hilje L, Morales FJ. Whitefly bioecology and management in Latin America. En: Hilje, L. y F. J. Morales. Encyclopedia of Entomology. Springer Netherlands. 2008; 4250-4260 pp.
4. Holguín-Peña RJ, Hernández-Montiel LG, Latisnere-Barragán H. Identificación y Distribución Geográfica de Bemisia tabaci Gennadius y su Relación con Enfermedades Begomovirales en Tomate (Solanum lycopersicum L.) de Baja California, México. Revista Mexicana de Fitopatología. 2010;28(1):58-60.
5. Miller GT. Sustaining the Earth, 6th edition. 2004.Thompson Learning, Inc. Pacific Grove, California. Chapter 9. 211-216pp.
6. Gilden RC, Huffling K, Sattler B. Pesticides and health risks. J Obstet Gynecol Neonatal Nurs. 2010;39(1):103-109.
7. Pino O, Sánchez Y, Rojas M. Plant secondary metabolites as an alternative in pest management. I: Background, research approaches and trends.Rev Protección Veg. 2013;28(2):81-94.
8. Andorno AV. Evaluación del sistema planta hospedera-huésped alternativo como estrategia para el control biológico de pulgones (Hemiptera: Aphididae) en sistemas de producción hortícola en cultivos protegidos. Tesis de Doctorado. Universidad de Buenos Aires, Argentina. 2012; 171pp.
9. Paredes D, Campos M, Cayuela L. Conservation biological control of arthropod pests: techniques and state of art. Ecosistemas. 2013;22(1):56-61.
10. Sánchez JA, Martínez-Cascales JI, Lacasa A. Abundance and wild host plants of predator mirids (Heteroptera : Miridae) in horticultural crops in the Southeast of Spain. Mediterranean Climate IOBC/WPRS Bulletin. 2003,26:147-151.
11. Martínez MA, Duarte L, Baños HL, Rivas, Sánchez A. Predatory mirids (Hemiptera: Miridae) in tomato and tobacco in Cuba. Rev Protección Veg. 2014;29:204-207.
12. Calvo FJ, Lorente MJ, Stansly PA, Belda JE. Preplant release of Nesidiocoris tenuis and supplementary tactics for control of Tuta absoluta and Bemisa tabaci in greenhouse tomato. Entomologia Experimentalis et Applicata. 2012;143(2):111-119.
13. Bueno VHP, van Lenteren JC. Predatory bugs (Heteroptera). En: A.R. Panizzi, J.R.P. Parra (Eds.). Insect Bioecology and Nutrition for Integrated Pest Management. 2012. CRC Press, Boca Raton, FL. 539-569pp.
14. Lins Junior JC. Search capacity, prey preference, predation rates and reaction to prey and predator induced volatiles of predatory mirids of two tomato pests, Tuta absoluta (Lep.: Gelechiidae) and Bemisia tabaci (Hem.: Aleyrodidae). Tese (doutorado), Universidade Federal de Lavras 2014, Lavras. 116pp.
15. Chesson J. Measuring preference in selective predation. Ecology. 1978;59:211-215.
16. Trexler JC, McCulloch CE, Travis J. How can functional response best be determined? Oecologia. 1988;76:206-214.
17. Trexler JC, Travis J. Nontraditional regression analysis. Ecology.1993;74:1629-1637.
18. SAS Institute Inc. 2010. Base SAS® 9.2. Procedures Guide: Statistical Procedures, Third Edition. Cary, NC: SAS Institute Inc.
19. Juliano SA. Nonlinear curve fitting: predation and functional response curves. En: S.M. Scheiner y J. Gurevitch (Eds). Design and analysis of ecological experiments. 2da edc. Chapman & Hall, New York. 2001; 178-196 pp.
20. Rogers D. Random search and insect population models. Journal of Animal Ecology. 1972;41:369-383.
21. Hassell MP. The Dynamics of Arthropod Predator-Prey Systems. Princeton University Press, Princeton, N.J., 1978; 28-50 pp.
22. Di Rienzo JA, Casanoves F, Balzarini MG, González L, Tablada M, Robledo CW. InfoStat versión 2016. Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argentina. Disponible en: http://www.infostat.com.ar.
23. Sabelis MW. How to analyse prey preference when prey density varies? A new method to discriminate between effects of gut fullness and prey type composition. Oecología. 1990;289-298.
24. Stephens DW, Krebs J. Foraging Theory. Princeton, N.J: Princeton Univ. Press.1986; 274 pp.
25. Pérez HM, Bouagga S, Jaques JA, Flors V, Urbaneja A. Tomato plant responses to feeding behavior of three zoophytophagous predators (Hemiptera: Miridae). Biological Control. 2015;86:46-51.
26. Jaworski CC, Chailleux A, Bearez P, Desneux N. Apparent competition between major pests reduces pest population densities on tomato crop, but not yield loss. J Pest Sci. 2015;8:793-803.
27. Maselou D, Perdikis D, Fantinou A. Effect of hunger level on prey consumption and functional response of the predator Macrolophus pygmaeus. Bulletin of Insectology. 2015;68(2):211-218, ISSN 1721-8861.
28. Holling CS. Some characteristics of simple types of predation and parasitism. The Canadian Entomologist, Cambridge. 1959;91(7):385-398.
29. Hemerik L, Yano E. Scaling up from individual behaviour of Orius sauteri foraging on Thrips palmi to its daily functional response. Popul. Ecol. 2011;53(4):563-572.
30. Holling CS. The functional response of predators to prey density and its role in mimicry and population regulation. Mem Entomol Soc Can. 1965;45:3-60.
31. Valderrama K, Granobles J, Valencia E, Sánchez M. Nesidiocoris tenuis (Hemiptera: Miridae) predator in tobacco crops (Nicotiana tabacum). Rev Colomb Entomol. 2007;33(2):141-145.
32. Sharifian I, Sabahi Q, Khoshabi J. Functional response of Macrolophus pygmaeus (Rambur) and Nesidiocoris tenuis (Reuter) feeding on two different prey species. Archives of Phytopathology and Plant Protection. 2015;48:17-20.
33. Lampropoulos P D, Perdikis DCh, Fantinou AA. Are multiple predator effects directed by prey availability? Basic and Applied Ecology. 2013;14:605-613.
34. Cabello T, Bonfil F, Gallego JR, Fernández FJ, Gámez M, Garay J. Can Interactions Between an Omnivorous Hemipteran and an Egg Parasitoid Limit the Level of Biological Control for the Tomato Pinworm? Environ Entomol. 2015;44(1):12-26.
Recibido: 15/10/2016
Aceptado: 2/12/2016
Heyker L. Baños, Laboratorio de Entomología -Acarología, Dirección de Sanidad Vegetal, Centro Nacional de Sanidad Agropecuaria (CENSA).














