INTRODUCCIÓN
La yuca (Manihot esculenta Crantz) constituye una fuente importante de energía en los países tropicales y subtropicales, sobre todo en África. Se estima que se producen unas 152 millones de toneladas por año, donde el 50 % lo aporta África, 30 % Asia y el 20 % los países de América, contribuyendo, significativamente, a la nutrición y al sustento de más de 800 millones de personas (1).
Los begomovirus pertenecen a la familia Geminiviridae y su genoma está constituido por una o dos moléculas de ADN circular de cadena sencilla; la replicación viral ocurre en el núcleo de las plantas hospedantes por un mecanismo de círculo rodante. Sobre la base de la organización del genoma, las identidades moleculares y las propiedades biológicas, la familia se divide en nueve géneros: Becurtovirus, Begomovirus, Eragrovirus, Mastrevirus, Curtovirus, Topocuvirus, Capulavirus, Grablovirus y Turncurtovirus (2,3).
Los miembros del género Begomovirus se consideran los más importantes debido a su amplia distribución mundial, la severidad de las enfermedades y las pérdidas que ocasionan en cultivos de interés agrícola (3). La transmisión se realiza por diferentes biotipos de mosca blanca (Bemisia tabacci Genn). La enfermedad del mosaico africano de la yuca (CMD) es de etiología viral compleja y se asocia a diez especies de virus, entre los que se encuentran el African cassava mosaic virus (ACMV), East african cassava mosaic virus (EACMV) (3), East african cassava mosaico Camerun virus (EACMCV) (4), East african cassava mosaic virus-Uganda (EACMV-UG) (5), East african cassava mosaico Zanzibar virus (EACMZV) (6), East african cassava mosaic Malawi virus (EACMMV) (7), East african cassava mosaic Kenia virus (EACMKV) (8), East african cassava mosaic Burkina Faso virus (EACMBFV) (8), South african cassava mosaico virus (SACMV) (9) y Cassava mosaico Madagascar virus (CMMGV) (10).
De forma general, los síntomas típicos de la enfermedad son muy fuertes en las hojas jóvenes, que presentan áreas cloróticas, verde-claras, combinación de áreas verde-oscuras y distribuidas aleatoriamente en el área foliar. También se evidencia distorsión, reducción del área foliar, enanismo, mosaico amarillo brillante, moteados cloróticos, clorosis foliar marginal, enrollamiento foliar, deformaciones foliares y arrugamientos de las hojas. Los síntomas pueden variar entre las hojas y ramas de una misma planta debido, fundamentalmente, a la presencia de diferentes aislados del virus, la variedad, la edad de la planta y los factores ambientales, como son la fertilidad del suelo, la humedad relativa, la radiación y la temperatura (2).
Angola es uno de los principales países productores de yuca en África, con una producción de 14,1 t.haˉ¹, aproximadamente; las mayores pérdidas se le atribuyen a la enfermedad del mosaico africano de la yuca (CMD), a través de la diseminación y propagación de estacas infestadas entre los productores (11).
En los estudios realizados sobre CMD en las provincias Malanje, Cuanza-Norte y Sur, Uíge, Bengo, Benguela y en la región de Okavango (Cunene) zona sur de Angola, usando variedades como Precoce de Angola, Ngana rico, Thiti, TMS-30142 y TMS-40125, se identificaron tres especies involucradas en la enfermedad. En la provincia Uíge, la mayor incidencia encontrada fue el ACMV con 84,6 %, EACMV con 63 % y el EACMV-UG con 18,5 % (12,13).
Diversos factores, como variaciones en el vector, el virus y el ambiente, son importantes en la sobreexpresión y dispersión de las enfermedades virales
El objetivo de este trabajo fue evaluar los factores epidemiológicos que influyen en la enfermedad del mosaico de la yuca (CMD) en la provincia Huila, República de Angola.
MATERIALES Y MÉTODOS
Se encuestaron 20 campos de producción en los municipios Caluquembe y Kuvango, por ser los de mayores áreas sembradas y a nivel de la provincia (14,15). Los muestreos se realizaron en los periodos de junio/2016, febrero y junio de 2017 y febrero/2018.
Los aspectos generales, considerados en las encuestas a cada campo, fueron los siguientes:
Descripción general de la parcela y entrevista al productor
Se tomaron los datos de altitud, temperatura, humedad, velocidad y dirección de los vientos, precipitación, meses de siembra, edad de las plantas, hospedantes alternativos de mosca blanca, tácticas de manejo del cultivo, detalles de la plantación y del cultivo, uso de insecticida, historia de la parcela, fecha de siembra de la yuca y detalles sobre la producción de plántulas.
Observaciones en la parcela
Se realizó la descripción de los síntomas y el grado de expresión de estos, utilizando una escala de 1-3, a partir de la observación del 1 % del total de plantas distribuidas en cinco puntos; para ello se utilizó el método de diagonal cruzada.
La escala de la severidad de los síntomas se describe a continuación:
A1- Plantas sin síntomas
A2- Plantas con síntomas ligeros de mosaico
A3-Plantas con síntomas severos de mosaico, encrespamientos y enanismo
Los índices de severidad e incidencia se determinaron para cada campo visitado siguiendo las fórmulas siguientes:
Para el cálculo de la densidad de moscas blancas en cada planta, se contaron los adultos presentes, así como la sumatoria de la cantidad en cada punto, dividido por el número total de plantas analizadas en cada punto, teniendo en cuenta la dirección de los vientos predominantes.
Los resultados se analizaron y compararon utilizando un ANOVA (SC tipo III). La influencia de las variables climáticas se calculó mediante un análisis de componentes principales y, para ello, se empleó el paquete estadístico InfoStat (16).
El riesgo de los factores no asociados a clima sobre la severidad de la enfermedad se determinó mediante un análisis de regresión logística. Los riesgos se identificaron según el cálculo de los odds ratio y se determinó la fracción atribuible al riesgo (FAE). Se empleó el paquete SPSS 21.0.
RESULTADOS Y DISCUSIÓN
La enfermedad incidió en todos los periodos y campos analizados, sin diferencias estadísticas, con valores entre 89,5 % y 93 %; estos resultados coinciden con los informados en países de África afectados por severas pandemias de CMD: 85 % de incidencia para los países del Centro de África (17).
Sin embargo, los índices de severidad media de la enfermedad y de densidad de mosca blanca fluctuaron en los diferentes periodos analizados y las localidades encuestadas. (Tabla 1)
En Caluquembe, se apreció una tendencia al incremento significativo de la enfermedad, sin diferencias entre los meses de junio 2017 y febrero 2018. Es importante destacar que el pico de severidad obtenido en la media del mes de febrero de 2017 estuvo condicionado por la elevada severidad obtenida en solo dos campos del total evaluado, lo que posteriormente se asocia a la convergencia, en estos campos, de factores que favorecieron el desarrollo de la enfermedad. La densidad de la mosca blanca, en esta localidad, solo fue significativamente mayor en el mes de junio de 2016; en el resto de los periodos no se observaron diferencias.
En Kuvango, en los meses de junio en los años 2016 y 2017, se observó una menor severidad de la enfermedad que en los meses de febrero de 2017 y 2018, aunque febrero de 2018 no mostró diferencias significativas con junio 2017. De igual manera, la densidad de la mosca blanca fue significativamente menor en junio de 2016; mientras que, en el año 2017, no tuvo diferencias en los periodos analizados.
Se demuestra lo descrito por Legg et al. (18), quienes plantearon que, a pesar que la transmisión de la enfermedad se logra con bajas densidades de mosca blanca, los elevados índices de densidad del vector son importantes para la dispersión e incidencia de la enfermedad.
TABLA 1 Media de la severidad de la enfermedad y de la densidad de mosca blanca por localidades./ Means of disease severity and whitefly density by localities
| Caluquembe | Kuvango | |||
|---|---|---|---|---|
| I.S±E.E | D.M±E.E | I.S±E.E | D.M/E.E | |
| Jun-16 | 0,11c±0,07 | 0,86a±0,09 | 0,17c±0,1 | 0,26c±/0,03 |
| Jun-17 | 0,42b±0,08 | 0,42b±0,08 | 0,33bc±0,09 | 0,41ab±0,03 |
| Feb-17 | 0,79a±0,1 | 0,34b±0,08 | 0,70a±0,09 | 0,38b±0,03 |
| Feb-18 | 0,36b±0,04 | 0,41b±0,08 | 0,60ab±0,09 | 0,48a±0,03 |
Leyenda: E.E Error estándar, I.S: Índice de severidad, D.M: Densidad de la mosca blanca.
Medias con letra diferentes, en una misma columna, difieren significativamente (p≤0,05)
El 38,1 % de la variabilidad encontrada en el primer componente (CP1) tuvo una incidencia de las temperaturas máximas, media y mínima, así como las precipitaciones. El componente 2 (CP2) expresó el 22,5 % de la variabilidad encontrada con la influencia de la humedad relativa mínima, media y máxima, y la altitud. La densidad de la mosca blanca (DM) no influyó en la severidad de la enfermedad y mostró una correlación negativa con las temperaturas, la humedad y las precipitaciones, mientras que se observó una correlación positiva con la velocidad de los vientos en estas localidades. (Fig. 1)
En ambas localidades, las temperaturas y la humedad del mes de febrero fueron más favorables para el desarrollo de la enfermedad que las presentadas en el mes de junio; sin embargo, la humedad presentada en estos meses fue desfavorable para el desarrollo de la mosca. Esto puede indicar la necesidad de que se realice un manejo intensivo del vector a partir del mes de junio, con el objetivo de disminuir las poblaciones del insecto y contribuir a evitar la alta diseminación de la enfermedad.
Los insectos requieren un intervalo favorable de condiciones climáticas para su óptimo desarrollo y reproducción, fuera de este se impiden los procesos o se suprimen, lo que pudiera influir en el desarrollo, crecimiento, incidencia, distribución y dispersión de los insectos herbívoros (19). Se ha planteado que la influencia de los factores climáticos pueden llevar a la adaptación del insecto al ambiente favorable de la temperatura y la disponibilidad del agua, los cuales influyen en el desarrollo y la reproducción, pueden inducir los cambios en la densidad de la población, dinámica, composición genética, duración de la vida, habilidad de dispersión, tamaño individual y en las estructuras del consumo, efectos que pueden ser diferentes para las distintas especies (20).
El estudio de otros factores sobre la distribución geográfica de la enfermedad, en cuatro agroecosistemas diferentes, refleja que existe una estrecha relación entre la incidencia y severidad, superior durante periodos de calor y alta altitud, donde la actividad del vector es más activa. Al comparar los diferentes momentos, se observó que la incidencia y la severidad eran mayores en los bosques húmedos (entre 64-97 %), seguido de bosques de transición en 45 bosques con montañas (38 %) y en las sabanas húmedas con 29 %; se demuestra así la influencia de factores epidemiológicos, como la temperatura, humedad y altitud en la incidencia y severidad de la enfermedad (21,22).
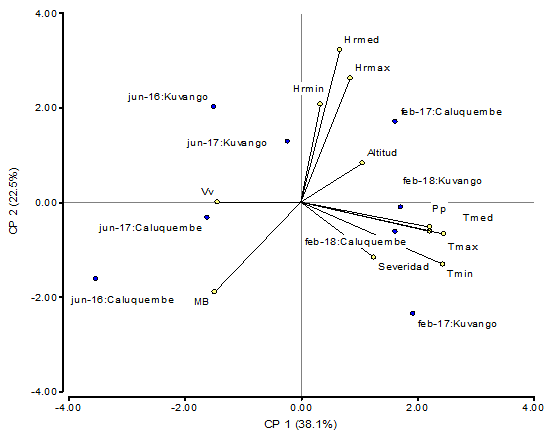
FIGURA 1 Relación de las variables climáticas sobre la severidad e incidencia de la enfermedad. / Relationship between the climatic variables and the disease severity and incidence.
Los resultados confirman que la densidad de mosca blanca influye en la tasa de propagación de la enfermedad en los campos de yuca; estas poblaciones pueden aumentar o disminuir en dependencia de las condiciones climáticas locales, como son la humedad, la temperatura, la dirección de los vientos, la presencia de hospedantes. Elementos similares se han descrito para esta enfermedad (23).
Generalmente, las poblaciones de mosca blanca son favorecidas por altas temperaturas, alta humedad relativa y precipitaciones anuales moderadas (24). Sin embargo, Robertson (25) describió que, a lo largo de la zona costera de Kenya, la abundancia de mosca blanca estuvo relacionada con altas temperaturas y con el aumento de la capacidad de vuelo de mosca blanca, después de la finalización del periodo lluvioso. Recientemente en Tanzania, se demostró que el aumento de mosca blanca también puede estar relacionado con altas temperaturas y bajas precipitaciones anuales, así como con otros factores ambientales (26).
Factores de riesgo para la severidad de la enfermedad
En el análisis del riesgo, para la severidad de CMD, los factores relacionados con las prácticas culturales, el tamaño de las parcelas y las características generales de las parcelas mostraron una mayor influencia en los campos de Caluquembe (76,31 %) que en Kuvango (55,26 %). En la Tabla 2 se muestran los factores de mayor significación.
TABLA 2 Riesgode los factores culturales para el incremento de la severidad de CMD en las localidades Caluquembe y Kuvango, Angola. / Risk of cultural factors for increasing the severity of CMD in the localities Caluquembe and Kuvango, Angola.
| Factores de riesgo | ᵡ2 | Sig. | |||
|---|---|---|---|---|---|
| Inferior | Superior | ||||
| Edad de los esquejes | 6,366 | ,012 | 1,029 | 1,006 | 1,051 |
| Edad de la Plantación | 5,245 | ,022 | 1,061 | 1,009 | 1,116 |
| Superficie de la parcela | 8,229 | ,004 | 2,256 | 1,294 | 3,932 |
| Plantación anterior con Yuca | 6,365 | ,012 | 1,383 | 1,075 | 1,778 |
| Plantaciones de yuca en los alrededores | 5,234 | ,022 | 1,405 | 1,050 | 1,879 |
| Presencia en la parcela de arvenses hospedantes potenciales | 6,550 | ,010 | 1,374 | 1,077 | 1,753 |
| Procedencia de los Esquejes | 8,150 | ,004 | 1,461 | 1,126 | 1,898 |
| Sin Protección Física | 6,587 | ,010 | 1,775 | 1,145 | 2,750 |
| Distancia del área al borde del campo | 4,500 | ,034 | 1,426 | 1,027 | 1,979 |
| Colindancia y presencia en la parcela del cultivo de col | 7,055 | ,008 | 1,847 | 1,174 | 2,905 |
| Colindancia y presencia en la parcela del cultivo tomate | 6,765 | ,009 | 1,837 | 1,162 | 2,904 |
| Colindancia con cultivo de cucurbitáceas con y sin síntomas | 3,154 | ,076 | 1,391 | ,966 | 2,002 |
| Presencia de euforbiáceas en la colindancia | 5,476 | ,019 | 1,464 | 1,064 | 2,013 |
| Ausencia de prácticas culturales | 6,616 | ,010 | 1,322 | 1,069 | 1,635 |
Letras señaladas en negrita señalan los factores de mayor riesgo/bold letters major risk factors.
Se distinguen cinco elementos de riesgo relativo con significación estadística (p≤0,05) y límite inferior por encima de 1, que influyeron en la severidad de la enfermedad. Entre los elementos de riesgo se encuentra la superficie de las parcelas, pues en aquellas menores una hectárea, donde se presentó mayor severidad de la enfermedad, se confirmó que cuando se utiliza el policultivo asociando la yuca con hospedantes del insecto vector, como lo son la col de repollo, el tomate y las plantas pertenecientes a Cucurbitacea y Euphorbiaceae, se incrementa el riesgo de la enfermedad. Igualmente, resultó de alto riesgo el uso de esquejes procedentes de los propios campos infectados o de campos a distancias menores de 1 km y obtenidos sin ningún tipo de protección física.
Otros factores con rangos de riesgo entre 1-1,4 y significación estadística se detectaron con menor influencia en la severidad de la enfermedad y estuvieron relacionados con la edad de la plantación. En las plantaciones jóvenes los síntomas fueron más severos, así como la ausencia de prácticas culturales, la explotación intensiva de las áreas en producción de yuca, la colindancia con cultivos hospedantes del vector y el momento de plantación de los esquejes. Este resultado demuestra que la coexistencia de varios factores, mutuamente relacionados que determinan el comportamiento de otros, requieren ser dilucidados para precisar la contribución real de cada uno de ellos en la severidad de la enfermedad.
La FAE (Figura 2), que indica el porcentaje de campos expuestos a los factores de riesgo evaluados, demuestra que más del 66 % de los campos evaluados están expuestos a los cinco factores de mayor riesgo detectados. Más del 95 % se expusieron a la presencia dentro del campo, o en la colindancia, a los cultivos de col y tomate, ambos hospedantes del vector. De igual forma, el 94 % de los campos se sembraron con esquejes sin protección. Este resultado permite sugerir las medidas inmediatas necesarias a considerar para el manejo de la enfermedad, las cuales deben estar relacionadas con minimizar el riesgo de exposición de las parcelas a estos factores.
Los elevados índices de incidencia y severidad de la enfermedad, condicionada por las diversas características de los agroecosistemas estudiados, demuestran que la ocurrencia de la enfermedad se debe a varios factores que, entrelazados, provocan una complicada situación epidemiológica que necesita ser conocida y analizada a fin de programar eficientes tácticas de manejo del complejo mosca blanca-geminivirus en la provincia y en el país.
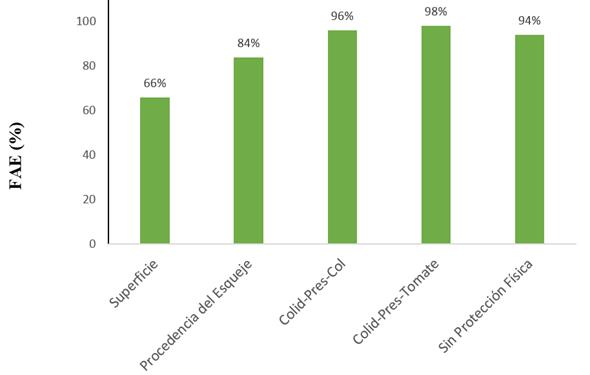
FIGURA 2 Fracción Atribuible al Riesgo (FAE) para la severidad de la enfermedad, en relación con los factores de mayor riesgo. / The risk attributable fraction (FAE) for the severity of the disease, in relation to the major risk factors.
Los resultados confirman que, aunque la fuente primaria de inóculo en la mayoría de la enfermedad de mosaico de la yuca (CMD) aún no está completamente dilucidada, las fuentes externas de inóculo son tan o más importantes que las fuentes internas, así como los componentes ambientales para favorecer la propagación de las enfermedades con impacto en la salud del cultivo de la yuca, aspectos que se han señalado previamente en otras enfermedades virales (27).














