Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Archivo Médico de Camagüey
versión On-line ISSN 1025-0255
AMC vol.10 no.2 Camagüey mar.-abr. 2006
ARTÍCULOS ORIGINALES
Purificación del antígeno específico prostático con alto grado de pureza mediante el método de electroelusión
Purification of prostatic specific antigen of high purity level through the electroelusión method
Yadira Falcón Almeida; Oscar Hernández Betancourt; Blanca Santana Guerra; Lellanis Rodríguez Cardoso
Instituto Superior de Ciencias Médicas. Centro de Inmunología y Productos Biológicos. Camagüey, Cuba.
RESUMEN
Se evaluó la utilidad de la técnica de electroelusión en la obtención del antígeno específico prostático con actividad biológica para su empleo en sistemas basados en el reconocimiento antígeno-anticuerpo (ELISA, RIA, SUMA). Para la muestra se partió del semen de pacientes voluntarios, precipitados con sulfato de amonio al 70 %. Las corridas electroforéticas en geles de poliacrilamida no reducidos se llevaron a cabo a 4º C. Se procedió a electroeluir el fragmento de acrilamida cortado en la talla deseada (33 KDa) y para ello se utilizaron marcadores adecuados de peso molecular. La metodología empleada permitió obtener un antígeno con un grado de pureza próximo al 70 %. El método de electroelusión constituye un procedimiento rápido y poco costoso para su uso en laboratorios con bajos recursos. Los resultados aquí obtenidos no mostraron diferencias significativas (p=0, 181) con el PSA purificado por el método cromatográfico, lo que sugiere su uso en obtención del antígeno específico prostático y otras moléculas para tales fines.
DeCS: ELECTROFORESIS EN GEL DE POLIACRILAMIDA; ENSAYO DE CAMBIO DE MOVILIDAD ELECTROFORÉTICA; ANTÍGENO PROSTÁTICO ESPECÍFICO/ aislamiento/purificación; NEOPLASMAS DE LA PRÓSTATA.
ABSTRACT
This paper deals with the usefulness of electroelusión in yielding prostatic specific antigen with biologic activity, intended to be used in systems based on antigen antibody recognition (ELISA, RIA, and SUMA). The sample was chosen from patients who volunteered to donate their semen, which was precipitated in 70 % ammonium sulphate. Electrophoretic runs in non reduced polyacrilamide gels took place at 4 o C. The acrilamide fragment, once it was cut at the size desired (33KDa), was electoeluded. To do so, markers of adegnate molecular weight were used. The methodology followed allowed for the obtainment of an antigen with a purity level that nears 70 %. Electroelution is a fast and uncouthly procedure that fits poorly equipped laboratories. Results so achieved were not significantly different from those derived from chromatography- purified PSA, which suggests that electroelution is viable in obtaining PSA and other molecules to such an end.
DeCS: ELECTROPHORESIS POLYACRYLAMIDE GEL; ELECTROPHORETIC MOBILITY SHIFT ASSAY; PROSTATE SPECIFIC ANTIGEN /isolation/purification; PROSTATIC NEOPLASMS.
INTRODUCCIÓN
El antígeno específico prostático (PSA) es una proteína glicosilada de 33 KDa 1, está considerado uno de los marcadores más importantes disponibles actualmente en el diagnóstico, pronóstico y seguimiento del cáncer de próstata 2. Los métodos diagnósticos empleados en la actualidad para tales fines (RIA y ELISA), necesitan biomoléculas (anticuerpos monoclonales y antígenos) con alto grado de pureza, que les permita lograr una sensibilidad y especificidad óptima. El PSA es utilizado en una curva patrón que permite la cuantificación de los niveles de esta proteína en la sangre. Existe una demanda nacional de cantidades de PSA para sustituir el antígeno comercial por su alto precio en el mercado internacional. Dado el elevado costo del proceso de purificación cromatográfico, tradicionalmente empleado para la obtención del PSA, nos propusimos evaluar la factibilidad del método de electroelusión de proteínas incluidas en geles de poliacrilamida utilizados por otros autores con diversos fines. 3, 4 Resultó de gran importancia conocer el grado de pureza brindado por este método aplicado a proteínas totales obtenidas del semen y evaluar su utilidad en el ELISA como un método alternativo adecuado cuando no se presentan las condiciones requeridas para realizar la purificación cromatográfica por su alto costo.
MÉTODO
Fuente de antígeno
El antígeno fue obtenido a partir del semen, purificado según el método descrito por Wang, et al, 5
Electroforesis de acrilamida no reducida (PAGE discontinuo) y western-blot.
La preparación de la muestra, así como las electroforesis (cinco en total) y la técnica de Western–blot se realizaron según el método descrito por Sambrook, et al, 6. Las electroforesis se corrieron a 20mA y se llevaron a cabo a 4ºC. Terminada la misma se cortó el gel en la región correspondiente a la talla esperada para el PSA (33 KDa), utilizando los marcadores de peso molecular conocidos.
Electroelusión
Se siguió el procedimiento descrito por Sambrook, et al, 6, el cual se llevó a cabo a 30mA, y a 4ºC de temperatura. Posteriormente se procedió a dializar el producto en PBS 1X durante 24 h. La muestra se concentró hasta el volumen deseado (1-1, 5ml).
Cuantificación del PSA y estimación del grado de pureza
El rendimiento final del proceso fue calculado mediante un RIA comercializado por el CENTIS (CIS-BIO), específico para determinar los niveles de PSA en sangre de pacientes afectadas. El grado de pureza se estimó con la ayuda de un densitómetro Digiscan ATOM 434.
Anticuerpos empleados
Se utilizaron los anticuerpos monoclonales anti-PSA CMC-H9 y CMC-A5, obtenidos en el CENIPBI, así como el anticuerpo policlonal en conejos, este último para el recubrimiento de las placas de ELISA y en la técnica de Western-blot.
ELISA tipo sandwich
Se realizó según el método descrito por Voller, et al, 7 (1976). Se utilizaron 5µgs del anticuerpo policlonal en conejo purificado para recubrimiento. Se emplearon dos antígenos en la comparación con la proteína corrida y electroeluida a 4ºC (elect), uno comercial utilizado por la firma CIS-BIO, y uno obtenido por el método cromatográfico en nuestro laboratorio. Como segundo anticuerpo se emplearon los AcM H9 y A5. Cada ensayo se realizó en duplicado con cada anticuerpo (n=4).
Análisis estadístico
Se utilizó el paquete estadístico Systat versión V del 97. Se realizó el ANOVA simple utilizando como variable las DO obtenidas en los ensayos de ELISA. Para comparar las diferencias entre los grupos se utilizó el método de Duncan.8
RESULTADOS
Pureza de antígeno específico prostático (PSA) y rendimiento del proceso.
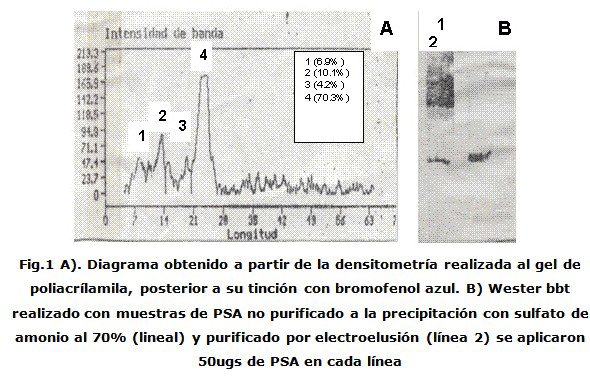
La lectura en el densitómetro arrojó algunas bandas contaminantes como resultado del método, el pico mayor con un 70 % de pureza se correspondió con el PSA (Fig. 1B) mediante la técnica del Western-blot utilizando el AcP. La línea 1, muestra las múltiples bandas de una muestra precipitada con sulfato de amonio y no electroeluida, mientras que en la línea 2 se muestra una banda mayoritaria en la talla esperada (33 Kda) correspondiente al peso del antígeno específico prostático. Como anticuerpo se utilizó un policlonal levantado en conejo contra el PSA comercial (Figura 1).
Comparación de la molécula electroeluida con otras moléculas de PSA en ELISA. El ELISA permitió la comparación de tres moléculas de PSA obtenidos por métodos diferentes. El valor medio de DO para cada antígeno (n=4) así como la diferencias estándar .El resultado del ANOVA realizado para p<0, 05 mostró que existieron diferencias significativas en el reconocimiento (p= 0, 023). La prueba de Duncan mostró que el PSA comercial (CIS-BIO) difiere significativamente de los antígenos obtenidos por el método cromatográfico y el PSA electroeluido. En cambio, entre estos dos antígenos no existió diferencias significativas (p=0, 181).
La presencia de significación se refleja empleando una letra junto a la media. Letras diferentes indican significación diferencial entre las muestras según Duncan (p<0, 05). Se utilizó el AcM (CMC-H9) como anticuerpo primario. El conjugado antiratón utilizado estuvo asociado a la enzima peroxidasa diluido 1/2000.
DISCUSIÓN
El uso de técnicas para el inmunodiagnóstico in vitro de múltiples enfermedades conlleva la utilización de antígenos que permitirán el reconocimiento por parte de los anticuerpos específicos. Varios son las fuentes y métodos destinados a su obtención que generan diferentes grados de pureza, así como la conservación en mayor o menor grado de sus propiedades biológicas necesarias para llevar a cabo el ensayo deseado. En ocasiones no se requiere moléculas con grados de pureza superior al 80 % por lo que es posible hacer uso de métodos no cromoatográficos que abaratan y agilizan el proceso.
Mediante el RIA se conoció la concentración inicial de PSA aplicado en todos los geles (400µgs), así como la concentración final de la misma (330 µgs) posterior a la electroelusión, lo que representó un 80 % de recrobado, superior al 50-60 % obtenido por otros autores. 9, 10
El método descrito permitió obtener una proteína con un 70 % de pureza evaluada por densitometría. La presencia de pequeñas cantidades de proteínas contaminantes de diferentes tallas, pudieron deberse a la aplicación de concentraciones proteicas por encima del límite de óptima resolución (0, 3 υgs⁄mm2) descrito para geles de acrilamida de 12, 5 % 11, por lo que se sugiere que niveles de pureza superior al aquí descrito pueden obtenerse aplicando concentraciones óptimas de la mezcla inicial de proteínas. En la literatura revisada no se reportan datos que indiquen el grado de pureza obtenido con este método.
En este trabajo, la proteína de interés (PSA) se encuentra circulando a muy bajas concentraciones (ng/ml) en los fluidos corporales (sangre y semen), de ahí que el uso de la cromotografía encarece la obtención de pequeñas cantidades del antígeno. Para dar solución a esta problemática se evaluó la factibilidad práctica de obtener el antígeno utilizando la electroelusión como un método alternativo posterior a la precipitación con sales, teniendo en cuenta que la técnica se ha empleado en varios laboratorios con diversos fines 12, 13 Guillén, et al, 3 (1998), emplearon el método para la obtención de la hormona de crecimiento recombinante de tilapia. Su uso en un bioensayo de actividad demostró que la proteína electrofluida es capaz de incrementar de forma significativa la talla y peso de larvas de peces. Un ensayo de actividad enzimática empleando este método, mostró que el mismo mantiene su actividad biológica mediante el corte de la semenogelina, uno de lo sustratos biológicos del PSA. 14
La presencia de proteínas contaminantes en el producto final, no interfirió con el reconocimiento específico demostrado por ELISA, cuando se comparó al PSA purificado por un método cromatográfico. La diferencia significativa mostrada por la molécula comercial y el antígeno electroeluido, puede deberse al empleo de un sistema de purificación altamente complejo y por consiguiente costoso. El presente trabajo demostró la utilidad del procedimiento y sugiere que este método puede ser utilizado para la purificación del PSA, necesario en los sistemas in vitro con fines diagnósticos.
REFERENCIAS BIBLIOGRÁFICAS
1. Sensabaugh GF. Isolation and characterization of a semen-specific protein from human seminal plasma: a potential new marker for semen identification. J Forensic Sci. 1978; 23:106-15.
2. Yu H, Giai M, Diamandis E, Katsaros D, Southerland D, Levasque M, et al. Prostate specific antigen is a new favorable prognostic indicator for woman wiht breast cancer. Cancer Res. 1995; 55: 2104-10.
3. Guillen I, Lleonart R, Agramonte A, Morales A, Hernández O. Physiological change in the juvenile euryaline teleost the tilapia Oreochromis hornorum injected with E. coli derived homologuous hormone. J Mar Biotech. 1998;6(3):142-51.
4. Dunn MJ. Electroelution of protein from polyacrylamide gels. Methods Mol Biol. 2004;244:339-43.
5. Wang MC, Valenzuela LA, Murphy GP, Chu TM. Purification of human specific membrane antigen. Invest Urol. 1979;17:159-63.
6. Sambrook KJ, Fritsch EF, Maniantis T. Molecular cloning: a laboratory manual. 2ed. New York: Col Spring Harbor Lab; 1989.
7. Voller A, Bidwell DE, Bartlett A. Enzyme inmunoassays in diagnostic medicine. Theory and practice. Bull World Health Organ. 1976;53(1): 55-65.
8. Sigarroa A. Biometría y diseño experimental. Ciudad de la Habana: Editorial Pueblo y Educación; 1985.
9. Ward LD, Reid GE, Moritz RL, Simpsom RJ. Strategies for internal amino acid sequence analysis of protein separated by poyacrilamide gel electrophoresis. J Chromatogr. 1990;519(1):199-216.
10. Liang SP, Lee TT, Laursen RA. Single-step electroelution of proteins from SDS-polyacridamide gels and inmobilization on diisothiocyanate-glass beads in prepacked capillary columns for solid-phase microsequencing. Anal Biochem. 1991;197(1):163-7.
11. Pico MC, Giraldino I, Otero A. Inmunología experimental. La Habana: Editorial Félix Varela;1997.
12. García HM. Electroforesis en geles de poliacrilamida: fundamentos, actualidad e importancia. Univ Diag. 2000;1(2):31-41.
13. Harty RN, O Callaghan DJ. Isolation and purification of specific, overlapping mRNA species by electroelution from agarose gels. Biotechniques. 1991;10(6):728-30.
14. Tessmer U, Quack T, Donn F, Leuner A, Dernick R. Biological of prostate- specific antigen isolated by sodium dodecyl sulfate-polyacridamide gels electrophoresis and electroelution. Electrophoresis 1995;16(5): 793-9.
Recibido: 13 de abril de 2004
Aceptado: 22 de noviembre de 2005
Yadira Falcón Almeida. Ingeniera Química. Investigador Agregado. Profesor Instructor del ISCM-C. Instituto Superior de Ciencias Médicas. Centro de Inmunología y Productos Biológicos. Camagüey, Cuba.
yafalcon@finlay.cmw.sld.cu