Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Archivo Médico de Camagüey
versión On-line ISSN 1025-0255
AMC vol.18 no.4 Camagüey jul.-ago. 2014
ARTÍCULOS ORIGINALES
Enterococcus faecalis en dientes con periodontitis apical asintomática
Enterococcus faecalis in teeth with apical assintomatic periodontitis
Dr. Carlos Martin Ardila Medina; Dra. Silvana Maggiolo Villalobos; Dr. Erik. Dreyer Arroyo; Dra. Jacqueline Armijo Pérez; Dra. Nora Silva Steffen
Universidad de Antioquia. Medellín, Colombia.
RESUMEN
Fundamento: la periodontitis apical asintomática (PAA) abarca un grupo de enfermedades inflamatorias con patogénesis compleja que incluyen microrganismos asociados con la respuesta inmune del huésped.
Objetivo: determinar si existe asociación entre Enterococcus faecalis (Ef)y PAA y la condición bucal de los pacientes.
Métodos: se realizó un estudio descriptivo desde octubre de 2010 a noviembre de 2011. El universo estuvo constituido por un total de 18 pacientes con infección endodóntica y diagnosticados con PAA, sin enfermedad periodontal que solicitaron tratamiento en la Escuela Dental de la Universidad de Chile. Los pacientes fueron seleccionados según los siguientes criterios de inclusión: pacientes entre 18 y 70 años, con dientes uniradiculares con infección endodóntica primaria y PAA, con suficiente estructura dental que permitiera aislamiento operatorio; dientes con surco gingival inferior a 3 mm y pacientes que no reportaran ingestión de antibióticos en los últimos tres meses. Se excluyeron los sujetos con enfermedades sistémicas crónicas y embarazadas.
Resultados: nueve pacientes presentaron Ef. Por otra parte, la muestra estudiada presentó un índice dental cariado, obturado, perdido (COP) promedio de 18.17 ± 3.59; en los sujetos Ef positivos este índice fue de 18.22 ± 4.41, mientras que para los Ef negativos fue 18.11 ± 2.80 (p = 0.754).
Conclusiones: el Enterococcus faecalis es un microrganismo muy prevalente en las infecciones periodontales por lo cual se recomienda medidas asepticas estrictas durante la terapia endodóntica.
DeCS: PERIODONTITIS PERIAPICAL; ENTEROCOCCUS FAECALIS; ENFERMEDADES PERIODONTALES/terapia; ADULTO; EPIDEMIOLOGÍA DESCRIPTIVA.
ABSTRACT
Background: asymptomatic apical periodontitis (AAP) covers a group of inflammatory diseases with complex pathogenesis including microorganisms associated with the host immune response.
Objective: to determine if there is association between Enterococcus faecalis (Ef) and AAP and the oral condition of patients.
Methods: a descriptive study was conducted from October 2010 to November 2011. The universe was composed of a total of 18 patients with endodontic infection and diagnosed with AAP without periodontal disease who requested for treatment at the Dental School of the University of Chile. Patients were selected according to the following inclusion criteria: patients between 18 and 70 years, with uniradicular teeth with primary endodontic infection and AAP, with enough tooth structure that would allow surgical isolation; teeth with gingival sulcus inferior to 3 mm and patients who did not report ingestion of antibiotics in the last three months. Patients with systemic chronic diseases and pregnant women were excluded.
Results: nine patients presented Ef. On the other hand, the studied sample had a decay, missed, filled, surfaces index (DMFS) averaged 18, 17 COP ± 3, 59; in the case of positive Ef patients this rate was 18, 22 ± 4, 41 while for negative Ef was 18, 11 ± 2, 80 (p= 0.754)
Conclusions: Enterococcus faecalis is a very prevalent microorganism in periodontal infections that is why strict aseptic measures are recommended during endodontic therapy.
DeCS: PERIAPICAL PERIODONTITIS; ENTEROCOCCUS FAECALIS; PERIODONTAL DISEASES/therapy; ADULT; EPIDEMIOLOGY, DESCRIPTIVE.
INTRODUCCIÓN
La periodontitis apical se clasifica en aguda y crónica o sintomática y asintomática, caracterizadas por diferentes signos, síntomas clínicos y radiográficos. Las características clínicas de la infección crónica asintomática incluyen la presencia de un diente asintomático con pulpa dental necrótica y radiolucidez apical.1
La periodontitis apical asintomática (PAA) abarca un grupo de enfermedades inflamatorias con patogénesis compleja que incluyen microrganismos asociados con la respuesta inmune del huésped.2 Estos procesos inician después de la necrosis pulpar debido a caries y trauma dental o por procedimientos iatrogénicos que permiten la invasión y colonización bacteriana del conducto radicular, que genera un ambiente que facilita un crecimiento microbiano mixto, constituido principalmente por anaerobios;3 finalmente, las bacterias se organizan en una biopelícula que se adhiere a las paredes de los conductos radiculares.4-7
Dentro de los microrganismos asociados con PAA se encuentra el Enterococcus faecalis (Ef), un coco grampositivo; aun cuando su hábitat regular es intestinal, también se ha aislado de la mucosa oral, lengua, bolsas periodontales y conductos radiculares.8,9 Diferentes autores han aislado esta bacteria entérica en estudiantes con altos índices de caries (60 %) y en el 70 % de infecciones endodónticas.10,11
La literatura científica documenta una relación entre la prevalencia de Ef proveniente de infecciones endodónticas y su presencia en otros sitios de la boca, como el surco gingival, la lengua y tonsilas del mismo paciente, además se sugiere que estos sitios anatómicos se convierten en un reservorio que facilita la invasión de este microrganismo hacia los conductos radiculares.12 Se tiene presente que la principal fuente de la infección endodóntica es la caries dental, la presencia de Ef podría relacionarse con el estado de salud bucal del paciente.
El objetivo de esta investigación es determinar la relación entre la presencia de Ef en los conductos radiculares de dientes con PAA y el estado de salud bucal de las personas evaluado por el índice dental cariado, obturado, perdido (COP).13
MÉTODOS
En el presente estudio descriptivo el universo estuvo constituido por 18 pacientes, aplicando un muestreo no probabilístico en sujetos con infección endodóntica y diagnosticados con PAA, sin enfermedad periodontal que solicitaron tratamiento en la Escuela Dental de la Universidad de Chile, entre octubre de 2010 y noviembre de 2011. Los pacientes fueron seleccionados según los siguientes criterios de inclusión: pacientes entre 18 y 70 años, con dientes uniradiculares con infección endodóntica primaria y PAA, con suficiente estructura dental que permitiera aislamiento operatorio; dientes con suco gingival inferior a 3 mm y pacientes que no reportaran ingestión de antibióticos en los últimos tres meses. Se excluyeron los sujetos con enfermedades sistémicas crónicas y embarazadas.
Los sujetos incluidos en el estudio, recibieron información relacionada con los objetivos del estudio, firmaron el consentimiento informado voluntariamente. Esta investigación fue aprobada por el Comité de Ética Institucional. Se realizó una evaluación clínica y radiográfica de todos los participantes, además del índice COP.13
Antes de realizar la cavidad de acceso dental, se realizó una profilaxis de los dientes infectados, removiendo caries y restauraciones presentes. Posteriormente, se anestesió localmente y se realizó aislamiento del campo operatorio con dique de goma previamente esterilizado.
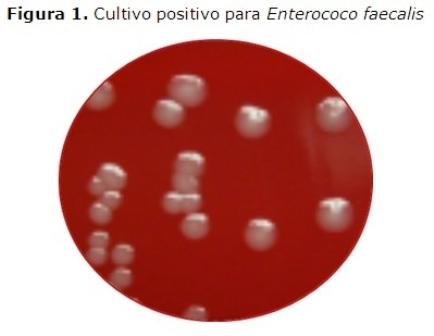
Las muestras microbiológicas se tomaron conforme al protocolo documentado por Shimauchi, et al. 14 Las puntas de papel previamente introducidas en los conductos radiculares infectados fueron introducidas en los viales de transporte reducidos y enviados inmediatamente al laboratorio de microbiología oral de la Escuela Dental de la Universidad de Chile para su procesamiento. Las muestras fueron diluidas a 101 y 102 en un pH de fosfato de sodio de 7.4. Alicuotas de 100 µl se sembraron en agar con el fin de cultivar y aislar el Ef. Las muestras se incubaron en CO2 al 5 % durante 48 horas. (Figura 1)
La extracción del ADN de las muestras microbiológicas se realizaron según el protocolo de Ashimoto, et al.15 se incluyó la especie de referencia del Ef ATCC 29212 mediante un producto comercial (Favorgen mini kit™) de acuerdo con las recomendaciones del fabricante. La concentración de ADN se determinó mediante espectrometría de absorción a 260 nm.16
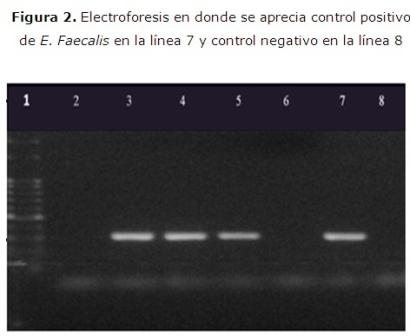
La identificación por Reacción en Cadena de la Polimerasa (RCP) se realizó según el protocolo de Siqueira & Rôças.16 La RCP se realizó en un volumen final de of 25 μl. Se realizó un análisis a través de electroforesis en agarosa al 1.5 % y visualizado bajo transiluminador de luz ultravioleta (Gel Logic™ 2200 pro Cae strenan). (Figura 2)
Se realizaron las pruebas estadísticas pertinentes de acuerdo a la naturaleza de la variable, se tuvo en cuenta los resultados de las pruebas de normalidad de las variables continuas; se estableció la significancia estadística con valores p < 0.05 a través de un paquete estadístico.
RESULTADOS
De los 18 pacientes con PAA, nueve presentaron Ef. Por otra parte, la muestra estudiada presentó un índice COP promedio de 18.17 ± 3.59; en los sujetos Ef positivos este índice fue de 18.22 ± 4.41, mientras que para los Ef negativos fue 18.11 ± 2.80 (p = 0.754). (Tabla)
DISCUSIÓN
Diferentes estudios epidemiológicos que han estudiado la microbiota de los canales radiculares han revelado que el Ef es el microrganismo más detectado comúnmente.17
Aun cuando la información obtenida en el presente estudio se basó en un pequeño número de muestras, la prevalencia fue del 50 %, resultado que no difiere significativamente de otros estudiosen los que se usaron las mismas técnicas de identificación, que sugieren esta especie puede jugar un papel relevante en la etiología de las infecciones periodontales.18,19 Adicionalmente, es importante destacar que este microrganismo presenta factores de virulencia cruciales en la patogénesis de las infecciones periapicales.18
Previamente se ha indicado que los microrganismos encontrados en los conductos radiculares se derivan de aquellos que colonizan la cavidad bucal.20 Sin embargo, es una hipótesis que debe estructurarse ya que al igual que los resultados encontrados en el presente estudio, mientras Ef estuvo presente en pacientes tratados endodónticamente, esta bacteria se detectó raramente en bocas saludables.20 Es importante aclarar que en el presente estudio y a diferencia del realizado por Sedgley, et al.19 no se tomaron muestras de saliva que permitieran establecer una correlación entre microrganismos de la boca e infecciones periodontales, sin embargo los índices COP encontrados en la presente investigación podrían indicar un estado bucal relativamente adecuado de los sujetos incluidos en este estudio.
Como es indicado por Wang, et al, 20 se requieren más estudios clínicos para probar la hipótesis de que la cavidad bucal provee de Ef a los conductos radiculares.
CONCLUSIONES
El Enterococcus faecalis es un microrganismo muy prevalente en las infecciones periodontales por lo cual se recomienda medidas asepticas estrictas durante la terapia endodóntica. Se requieren más estudios clínicos que permitan elucidar si la presencia de este microrganismo proviene de nichos ubicados en la cavidad bucal.
REFERENCIAS BIBLIOGRÁFICAS
1. Gutmann JL, Baumgartner JC, Gluskin AH, Hartwell GR, Walton RE. Identify and define all diagnostic terms for periapical/periradicular health and disease states. J Endod. 2009 Dec;35(12):1658-74.
2. Siqueira JF Jr, Rôças IN. Microbiology and treatment of acute apical abscesses. Clin Microbiol Rev. 2013 Apr;26(2):255-73.
3. Ray JJ, Kirkpatrick TC. Healing of apical periodontitis through modern endodontic retreatment techniques. Gen Dent. 2013 Mar-Apr;61(2):19-23.
4. Sousa EL, Gomes BP, Jacinto RC, Zaia AA, Ferraz CC. Microbiological profile and antimicrobial susceptibility pattern of infected root canals associated with periapical abscesses. Eur J Clin Microbiol Infect Dis. 2013 Apr;32(4):573-80.
5. Ricucci D, Siqueira JF Jr. Biofilms and apical periodontitis: study of prevalence and association with clinical and histopathologic findings. J Endod. 2010 Aug;36(8):1277-88.
6. Baldasso FE, Stürmer CP, Luisi SB, Petruzzi MN, Scarparo RK, De Figueiredo JA. Microflora associated with primary endodontic infections: correlations among SEM evaluation, clinical features, and radiographic findings. Microsc Res Tech. 2012 Nov;75(11):1557-63.
7. Hsiao WW, Li KL, Liu Z, Jones C, Fraser-Liggett CM, Fouad AF. Microbial transformation from normal oral microbiota to acute endodontic infections. BMC Genomics. 2012 Jul;13:345.
8. Endo MS, Martinho FC, Zaia AA, Ferraz CC, Almeida JF, Gomes BP. Quantification of cultivable bacteria and endotoxin in post-treatment apical periodontitis before and after chemo-mechanical preparation. Eur J Clin Microbiol Infect Dis. 2012 Oct;31(10):2575-83.
9. Ozok AR, Persoon IF, Huse SM, Keijser BJ, Wesselink PR, Crielaard W, et al. Ecology of the microbiome of the infected root canal system: a comparison between apical and coronal root segments. Int Endod J. 2012 Jun;45(6):530-41.
10. Vidana R, Sullivan A, Billström H, Ahlquist M, Lund B. Enterococcus faecalis infection in root canals - host-derived or exogenous source? Lett Appl Microbiol. 2011 Feb;52(2):109-15.
11. Haller C, Berthold M, Wobser D, Kropec A, Lauriola M, Schlensak C, et al. Cell-Wall Glycolipid Mutations and Their Effects on Virulence of E. faecalis in a Rat Model of Infective Endocarditis. PLoS One. 2014 Mar;9(3):e91863.
12. Nair PN. On the causes of persistent apical periodontitis: a review. Int Endodont J. 2006 Apr;39:249-81.
13. Nourijelyani K, Yekaninejad MS, Eshraghian MR, Mohammad K, Rahimi Foroushani A, Pakpour A. The influence of mothers' lifestyle and health behavior on their children: an exploration for oral health. Iran Red Crescent Med J. 2014 Feb;16(2):e16051.
14. Shimauchi H, Miki Y, kayama S, Imai T, Okada H. Development of a quantitative sampling method for periapical exudates from human root canals. J Endod. 1996 Nov;22(11):612-5.
15. Ashimoto A, Chen C, Bakker I, Slots J. Polimemerase chain reaction detection of 8 putative periodontal pathogens in subgingival plaque of gingivitis and advanced periodontitis lesions. Oral Microbiol Immunol. 1996 Aug;11:266-73.
16. Siqueira JF Jr, Rôças IN. Polymerase chain reaction based analysis of microorganisms associated with failed endodontic treatment. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2004 Jan;97(1):85-94.
17. Poptani B, Sharaff M, Archana G, Parekh V. Detection of Enterococcus faecalis and Candida albicans in previously root-filled teeth in a population of Gujarat with polymerase chain reaction. Contemp Clin Dent. 2013 Jan;4(1):62-6.
18. Kouidhi B, Zmantar T, Mahdouani K, Hentati H, Bakhrouf A. Antibiotic resistance and adhesión properties of oral Enterococci associated to dental caries. BMC Microbiol. 2011 Jun 29;11:155.
19. Sedgley C, Buck G, Appelbe O. Prevalence of Enterococcus faecalis at multiple oral sites in endodontic patients using culture and PCR. J Endod. 2006 Feb;32(2):104–9.
20. Wang QQ, Zhang CF, Chu CH, Zhu XF. Prevalence of Enterococcus faecalis in saliva and filled root canals of teeth associated with apical periodontitis. Int J Oral Sci. 2012 Jan;4(1):19-23.
Recibido: 25 de junio de 2014
Aprobado: 8 de julio de 2014
Dr. Carlos Martin Ardila Medina. Ph.D en Epidemiologia. Grupo Estomatología Biomédica. Profesor Titular. Facultad de Odontología. Universidad de Antioquia. Medellín, Colombia. Email: martinardila@gmail.com