Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Archivo Médico de Camagüey
versión On-line ISSN 1025-0255
AMC vol.18 no.6 Camagüey nov.-dic. 2014
CASOS CLÍNICOS
Hipercalcemia en el curso de la enfermedad de Graves
Hypercalcemia associated to Graves’ disease
Dr. Rafael Pila Pérez; Dr. Pedro Rosales Torres; Dr. Rafael Pila Peláez; Dr. Javier Artola González
Hospital Universitario Manuel Ascunce Domenech. Camagüey, Cuba.
RESUMEN
Fundamento: entre las causas de tirotoxicosis espontánea, la enfermedad de Graves (EG) es la más común y representa 60-90 % de todas las causas de tirotoxicosis en diferentes regiones del mundo. Es considerada uno de los prototipos de enfermedad autoinmune organoespecífica. La hipercalcemia es un evento infrecuente en la EG; si bien puede ser resultado de un exceso de entrada de calcio en el líquido extracelular o de insuficiente excreción, en la EG no se conoce el mecanismo exacto para su aparición.
Objetivo: presentar un caso de EG asociado a hipercalcemia severa, lo cual es inusual en esta enfermedad. Se describe un caso de tirotoxicosis con múltiples manifestaciones propias de esta entidad, los cuales se asocian a síntomas y signos de hipercalcemia severa (crisis hipercalcémica).
Caso clínico: paciente de 26 años de edad que comienza con manifestaciones propias de tirotoxicosis e hipercalcemia asociada no sospechada. Las pruebas funcionales del tiroides, los exámenes de laboratorio y la clínica confirman el diagnóstico de EG con una crisis hipercalcémica. La terapéutica empleada resulta satisfactoria, encontrándose la paciente asintomática con persistencia del exoftalmos.
Conclusiones: las manifestaciones clínicas fueron fundamentales para sospechar la EG. La hipercalcemia es un elemento infrecuente en esta enfermedad endocrina. La aparición de una crisis hipercalcémica puede desencadenar graves complicaciones en el paciente, siendo esta un evento excepcional en pacientes con tirotoxicosis. La prueba de supresión de la hipercalcemia con esteroides es de gran utilidad clínica en su asociación con tirotoxicosis, para descartar un hiperparatiroidismo concurrente.
DeCS: HIPERCALCEMIA; TIROTOXICOSIS; CORTICOESTEROIDES; ADULTO JOVEN; INFORMES DE CASOS.
ABSTRACT
Background: among the causes of spontaneous thyrotoxicosis, Graves’ disease is the most common and represents a 60-90 % of all causes of thyrotoxicosis in different regions in the world. It is considered one of the prototypes of organspecific autoimmune disease. Hypercalcemia is an infrequent event in Graves’ disease; although it can result from an excess of calcium entrance in the extracelular fluid or from insufficient excretion, in the case of Graves disease the exact mechanism for its appearance is unknown.
Objective: to present the case of a patient with Graves’ disease associated to serious hypercalcemia, unusual for this disease. A case of thyrotoxicosis with multiple manifestations of this disease, associated to signs and symptoms of serious hypercalcemia (hypercalcemic crisis) is described.
Clinical case: a twenty-six-year-old patient who starts presenting common manifestations of thyrotoxicosis and non-suspect associated hypercalcemia. Functional tests of the thyroid, laboratory tests and the tests from the clinic confirmed the diagnosis of Graves’ disease with a hypercalcemic crisis. The therapeutics employed turned out to be satisfactory, being the patient asymptomatic with persistence of exophthalmos.
Conclusions: clinical manifestations were fundamental to suspect Graves’ disease. Hypercalcemia is an infrequent element in this endocrine disease. The appearance of a hypercalcemic crisis can trigger serious complications for the patient, being an exceptional event in patients with thyrotoxicosis. The hypercalcemia suppression test with steroids is very useful from the clinical point of view in its association with thyrotoxicosis to rule out the possibility of concurrent hyperparathyroidism.
DeCS: HYPERCALCEMIA; THYROTOXICOSIS; ADRENAL CORTEX HORMONES; YOUNG ADULT; CASE REPORTS.
INTRODUCCIÓN
La reabsorción ósea, como una manifestación de hipertiroidismo, fue reconocida hace más de cien años por Von Recklinghausen en su primera descripción de la osteítis fibrosa quística.1 Aub, et al, 2 demostraron en los enfermos hipertiroideos un aumento de la pérdida de calcio por las heces y la orina, con un balance cálcico negativo. En 1949, Stanley y Fazekas3 describen el primer caso de hipercalcemia asociada a hipertiroidismo y su remisión con terapéutica antitiroidea. Después de estos reportes, se ha señalado esta asociación con variable frecuencia en la literatura médica. Por lo regular, esta asociación no muestra situaciones graves en relación con la hipercalcemia.
La causa más común de tirotoxicosis por hipertiroidismo es la enfermedad de Graves (EG) (50-60 %), esta es una enfermedad inmune, caracterizada por la presencia de anticuerpos circulantes, incluyendo anticuerpos estimulantes del tiroides (TSI), antiperoxidasa tiroidea (ANTI-TPo) y antitiroglobulina (anti-Tg). El más importante autoanticuerpo es el TSI, el cual se une al receptor de la TSH (hormona estimulante del tiroides), estimulando la proliferación celular y la producción de hormonas tiroideas. Se trata de uno de los más claros ejemplos de los autoanticuerpos patogénicos.4 Las otras dos causas fundamentales son el bocio multinodular tóxico (enfermedad de Plummer, 15-20 %) y el adenoma tóxico (3-5 %).5,6
El objetivo de este trabajo es presentar un caso de una paciente con hipercalcemia asociada a hipertiroidismo por EG, la cual presentó manifestaciones clínicas importantes que requirieron terapéutica sistémica para su control inmediato.
CASO CLÍNICO
Paciente femenina de 26 años de edad, sin antecedentes patológicos personales o familiares de interés, que después del parto (hace 4 meses) comienza a presentar astenia, pérdida progresiva de peso (aproximadamente 5 kg), palpitaciones, fatiga muscular, temblor permanente y alteraciones del ritmo intestinal. Desde hace 15 días refiere náuseas, vómitos a repetición sin relación prandial, dolor abdominal, polidipsia, diaforesis, disnea a los grandes esfuerzos y poliuria. La paciente fue remitida al Hospital Universitario Manuel Ascunce Domenech, donde se hospitalizó.
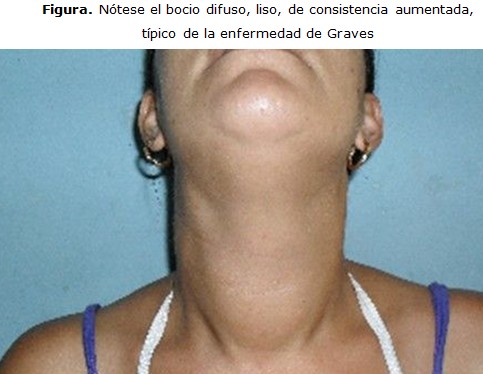
Examen Físico: piel caliente, húmeda y pálida; signos de contracción de volumen, afebril, disminución del panículo adiposo. Se aprecia bocio difuso, liso, de consistencia aumentada, no doloroso, sin soplos ni signos compresivos. (Figura)
En la exploración respiratoria: frecuencia respiratoria: 28 respiraciones/minuto, auscultación normal. Sistema cardiovascular: frecuencia cardíaca central: 124 latidos/minuto, tensión arterial: 150/72 mm Hg; ruidos cardíacos rítmicos y taquicárdicos con soplo sistólico III/VI (Levine) en el segundo espacio intercostal izquierdo con borde paraesternal que se irradia hacia la derecha. Abdomen: dolor a la palpación superficial en epigastrio, no se aprecian tumoraciones ni visceromegalias. Sistema nervioso: somnolencia alternando con orientación taquipsíquica, disminución de la masa muscular, temblor generalizado, hiperreflexia osteotendinosa (+3), no se evidencia defecto motor ni signos meníngeos; aumento de la hendidura palpebral, con presencia de exoftalmos bilateral leve con disminución del parpadeo.
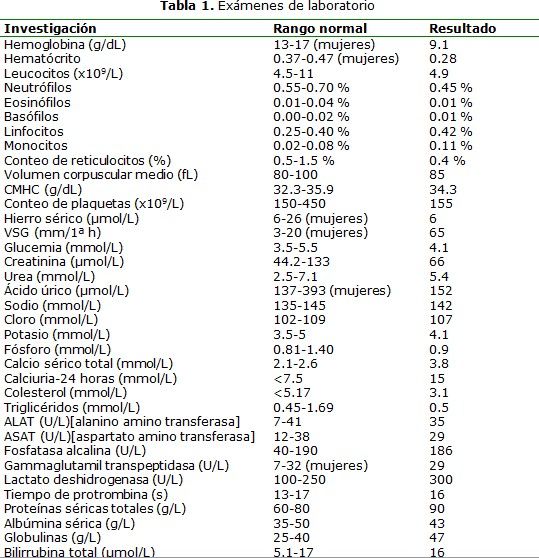
Investigaciones complementarias: en los exámenes de laboratorio realizados, se destacó la presencia de anemia normocítica normocrómica, leucocitos normales con linfomonocitosis relativa ligera, velocidad de sedimentación globular acelerada, hipercalcemia con hipercalciuria, hiperglobulinemia y niveles bajos de lípidos séricos. Sedimento urinario mediante conteo de Addis (2 horas): sin hematuria, leucocituria ni cilindruria. Estudios serológicos para (Veneral Disease Research Laboratory), VIH (Virus de la Inmunodeficiencia Humana) negativos. Estudios hormonales tiroideos: T3(Triodotironina): 3,8 mmol/L(milimol/litro) (VN[valor normal]: 1,4-3,27 mmol/L), T4 (Tetraiodotironina): (total): 360 mmol/L (VN: 55-155 nmol/L), TSH: 0,15 mUI/L (VN: 0,27-3,75 mUI/L). Radiografía de tórax: silueta cardíaca en límites normales. Electrocardiograma: taquicardia sinusal con PR prolongado y QRS ancho. Ultrasonografía abdominal: sin alteraciones. Ultrasonografía de tiroides: aumento de volumen difuso de ambos lóbulos que incluye el istmo, de aspecto normoecogénico. Panendoscopia: sin alteraciones. Serie ósea para huesos largos (survey): sin anormalidades en la densidad ósea. (Tabla 1)
CHCM: Concentración de hemoglobina corpuscular media; ASAT: aspartato amino transferasa; ALAT: Alanino aminotransferasa; GGT: Gamma-glutamil transpetidasa.
Evolución
Se concluyó el estudio como un estado de hipertiroidismo por EG con hipercalcemia asociada. El tratamiento antitiroideo se basó en el índice de Wayne modificado por Gurney, et al, 4 conocido con el nombre de índice de Newcastle. Se empleó hidrocortisona, 100 mg por vía intravenosa cada 8 horas durante 14 días consecutivos, y propranolol, a dosis de 20 mg cada 8 horas, lográndose la normalización de la calcemia y de la calciuria y la desaparición de la sintomatología. A continuación se inició una disminución paulatina de los corticosteroides y el calcio sérico volvió a elevarse a 3,5 mmol/L con reaparición de las náuseas, los vómitos, el dolor epigástrico, la poliuria, la polidipsia y las manifestaciones neurológicas. Posteriormente se administró metimazol, 40 mg diarios; y se observó normalización del calcio en suero y en orina a las 4 semanas. La paciente fue egresada sin manifestaciones clínicas, excepto por el exoftalmos bilateral, razón por la que se remite a consulta de oftalmología. Mantiene seguimiento en consulta externa.
DISCUSIÓN
En pacientes de piel blanca las enfermedades autoinmunes del tiroides están relacionadas con los siguientes loci: AITD1, CTLA4, GD1, GD2, GD3, HT1 y HT2. Diferentes loci han sido reportados y vinculados con enfermedades autoinmunes del tiroides en personas de otras razas.6-9 Como en la mayoría de las enfermedades inmunes, en la EG hay un aumento de susceptibilidad en las mujeres con relación a los hombres (relación de 7-8:1), lo que resulta propio de mujeres jóvenes, caucásicas, hispánicas y con menor frecuencia en la población negra, con una incidencia mayor entre los 20-40 años, pero puede ocurrir en mujeres en edades entre 30-60 años.5 La EG es la forma más común de hipertiroidismo (60-80 % de los casos).6 La incidencia anual fue reportada en 0,5 casos por mil habitantes por año durante un período de 20 años.7 En un estudio realizado por Furszyfer, et al,10 se reportó una frecuencia de 30 casos por 100 000 habitantes por año. El caso expuesto es el de una mujer blanca, de 26 años de edad, sin antecedentes familiares de enfermedades endocrinas.
La EG puede asociarse con anemia perniciosa, vitíligo, diabetes mellitus tipo 1, insuficiencia adrenal autoinmune, esclerosis sistémica progresiva, miastenia gravis, síndrome de Sjögren, artritis reumatoide y lupus eritematoso sistémico.4-6,11,12 Boelaert, et al,13 en un estudio de 2 791 pacientes con EG y 495 con tiroiditis de Hashimoto reportaron otros desórdenes autoinmunes en el 9,67 % y en el 14,3 %, respectivamente, donde la artritis reumatoide fue la enfermedad encontrada con mayor frecuencia. En la paciente no se evidenciaron otros fenómenos autoinmunes.
La clínica del hipertiroidismo es muy variada en la forma de presentación. A pesar de ello tiene un gran valor para ayudar a establecer el diagnóstico, particularmente cuando los exámenes de laboratorio muestran resultados no concluyentes. Los síntomas y signos iniciales son expresión del impacto del exceso de hormonas tiroideas circulantes en uno o más órganos o sistemas (tirotoxicosis). Entre los síntomas están: el nerviosismo (99 %), la hiperhidrosis (91 %), las palpitaciones (89 %), la astenia (88 %), la pérdida de peso (85 %), la polidipsia (82 %), la disnea (75 %), la debilidad muscular (70 %), los síntomas oculares (54 %) y la hiperdefecación (33 %); donde los signos más importantes son: la taquicardia (100 %), el bocio (100 %), la piel caliente (97 %), el temblor (97 %), el soplo en regiones tiroideas (77 %), los signos oculares (71 %), la fibrilación auricular (10 %), entre otros.5-7, 11, 12 La relación hombre-mujer para el mixedema pretibial es de 3,5:1, y solo el 7 % de los pacientes con mixedema pretibial tienen acropaquia tiroidea.9
La paciente presentó varios de los síntomas y signos propios de esta enfermedad. En muchos casos de tirotoxicosis el diagnóstico de la EG es obvio cuando al cuadro clínico se añaden la presencia de un bocio difuso y/o las manifestaciones oftalmológicas.13 La caracterización del aumento de volumen de la tiroides en difuso o nodular, no sólo tiene valor como signo de tirotoxicosis, sino también como método indispensable para diferenciar el trasfondo etiopatogénico más importante.7 La oftalmopatía tiroidea en la EG tiene rasgos variables e incluye: aumento de la hendidura palpebral (signo de Dabrymple), disminución del parpadeo (signo de Stellvag), retraso del párpado superior al mirar hacia abajo (signo de Graefe), temblor fibrilar de los párpados (signo de Jellinek), proptosis, afección de los músculos oculares con insuficiencia en la convergencia (signo de Moebius), daño corneal por exposición, y lesión del nervio óptico por compresión. Particularmente, cuando son de inicio temprano, sugieren una EG ya que son exclusivas de esta y están directamente relacionadas con las alteraciones autoinmunes subyacentes y no con la tirotoxicosis.6 En este caso se apreciaron signos de Dabrymple y Stellvag positivos con proptosis leve.
Los exámenes de laboratorio pueden demostrar: aumento moderado de la velocidad de sedimentación globular; anemia microcítica hipocrómica (30-50 %), señalándose tres hipótesis patogénicas para esta asociación: presencia de gastritis atrófica, efecto de la tirotoxicosis sobre el metabolismo del hierro (lo que mejora con el tratamiento del hipertiroidismo) o trastornos en la utilización de los depósitos de hierro.10 También puede presentarse anemia normocítica de los procesos crónicos y carencia de vitamina B12, la cual se considera excepcional. Puede observarse un conteo normal-bajo a ligeramente disminuido del total de leucocitos con linfocitosis y monocitosis relativas y conteo de plaquetas normal a ligeramente disminuido.6,11 El colesterol y los triglicéridos están muy disminuidos, y puede empeorar de manera considerable el control de la diabetes.6,7,11,12 En esta paciente se observaron varios de estos elementos en las investigaciones de laboratorio: anemia normocítica normocrómica, leucocitos normales con linfomonocitosis relativa ligera, VSG acelerada y niveles bajos de lípidos séricos.
Para el diagnostico definitivo de la EG, habitualmente es suficiente con la combinación de las manifestaciones clínicas y la determinación de la concentración de los niveles de T4 libre, que estará aumentada y de la TSH, que estará inhibida, 7 tal y como se observó en esta paciente. La determinación de los anticuerpos antitiroideos tiene poco interés práctico para el diagnóstico de la enfermedad. La determinación de anticuerpos antirreceptor de la TSH no es absolutamente necesaria para el diagnóstico, pero es útil en las siguientes situaciones: a) en el diagnóstico diferencial con otras formas de hipertiroidismo; b) como criterio de remisión de la enfermedad; c) en el diagnóstico de la oftalmopatía de Graves, y d) en el diagnóstico y el control evolutivo del hipertiroidismo neonatal.6,7,11
Otros hallazgos de laboratorio están dados por la presencia de moderada hipercalcemia con normofosfatemia o hiperfosfatemia leve.7,11,12,14 La paciente presentó niveles de calcio de 3,8 mmol/L (crisis hipercalcémica) y de fosfato en 0,9 mmol/L (rango normal de 0,81-1,40 mmol/L).
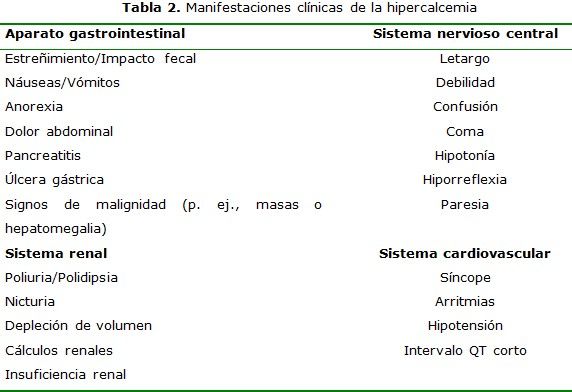
El mantenimiento de un nivel normal de calcio sérico depende de la interrelación de tres sistemas hormonales: vitamina D, calcitonina y hormona paratiroidea (PTH), donde cada una de ellas es controlada directa o indirectamente por el calcio sérico ionizado mediante un mecanismo de retroalimentación negativa.15 El calcio es un regulador de importantes funciones celulares. Los pacientes con niveles séricos elevados pueden presentar una gran variedad de manifestaciones derivadas de la afección de múltiples órganos;(tabla 2) éstas pueden ser debidas directamente a la hipercalcemia, a la incrementada excreción de calcio y fosfato, o a los cambios esqueléticos.14-16
Se ha señalado la presencia de queratopatía en banda, como resultado de la precipitación de calcio en una banda horizontal a través de la córnea en la apertura palpebral.15 El curso clínico de la hipercalcemia es dependiente de su causa y de la sensibilidad individual a altos niveles de calcio, esto significa que los individuos con hipercalcemia prolongada leve, pueden o no tener síntomas leves, o pueden presentar problemas recurrentes, tales como cálculos renales. Aquellos con hipercalcemia severa de comienzo súbito, pueden experimentar síntomas dramáticos, incluyendo confusión y letargo, conduciendo rápidamente a la muerte.15-17 En la exploración física, la mayoría de pacientes no tienen hallazgos específicos, excepto en la hipercalcemia secundaria a malignidad, en la cual es factible encontrar elementos del tumor primario.15
La hipercalcemia puede ser clasificada, depende de los niveles de calcio sérico total e ionizado,15,16 en: (1) leve: total entre 2,5-3 mmol/L o ionizado entre 1,4-2 mmol/L, (2) moderada: total entre 3-3,5 mmol/L o ionizado entre 2-2,5 mmol/L, y (3) crisis hipercalcémica: total entre 3,5-4 mmol/L o ionizado entre 2,5-3 mmol/L. El nivel sérico no se correlaciona siempre con la gravedad de los síntomas, si bien, los enfermos con crisis hipercalcémica están siempre sintomáticos.14-16 Puesto que el calcio se une a la albúmina y sólo el calcio libre o ionizado es biológicamente activo, el nivel sérico total debe ser ajustado de acuerdo con los valores anormales de albúmina, así: por cada 1 g/dL de disminución en la albúmina sérica por debajo de 4 g/dL, el calcio sérico aumenta 0,2 mmol/L (0,8 mg/dL), lo que es equivalente a la fórmula: calcio corregido (mmol/L) = ([4 – albúmina plasmática en g/dL] x 0,.2 + calcio sérico total). Sin esta corrección, un calcio anormalmente alto puede parecer normal.15
El diagnóstico diferencial de la hipercalcemia ofrece en grandes dificultades. Aproximadamente el 90 % de los casos de hipercalcemia son causados por malignidad o hiperparatiroidismo.15-17 Entre el 20-30 % de los pacientes con cáncer tienen hipercalcemia durante el curso de la enfermedad, y su detección puede significar un pronóstico desfavorable.15 De los casos debidos a malignidad, el 20 % se deben a metástasis óseas, mientras que el 80 % se relaciona con efectos de péptidos relacionados con la (paratohormona) PTH.15-17 El restante 10 % de los causas generales de hipercalcemia se relaciona con diferentes condiciones e incluyen trastornos asociados a la vitamina D, enfermedadess debidas a rápido recambio óseo, uso de tiazidas o insuficiencia renal, y en raros casos, formas familiares, hipertiroidismo y tratamiento con PTH recombinante humana para osteoporosis postmenopáusica.15 En el hiperparatiroidismo primario, los niveles intactos de PTH están elevados o inapropiadamente normales en el marco de una hipercalcemia. La PTH está casi siempre suprimida en pacientes con hipercalcemia debida a otras causas, excepto en la hipercalcemia hipocalciúrica familiar, en el hiperparatiroidismo terciario, y con el uso de litio.18 En el caso expuesto fue imposible determinar los niveles de PTH sérica.
La hipercalcemia debido a hipertiroidismo está bien documentada, pero el mecanismo preciso de las alteraciones del metabolismo del calcio es desconocido. Existe modificación del ciclo de remodelación en el hipertiroidismo. Se piensa que la T3 estimula la diferenciación de los osteoclastos, lo cual conduce a acelerada resorción ósea relativa a la mineralización ósea.19 Algunos investigadores al emplear calcio isotópico demostraron la presencia de formación y destrucción ósea incrementadas en pacientes con tirotoxicosis.14 Sin embargo, este mecanismo por sí solo no explica la falta de relación entre la concentración de la hormona tiroidea y el calcio sérico en otros pacientes.14,20 Se ha sugerido que una pequeña cantidad de pacientes tendrían un colágeno óseo particularmente sensible a la hormona tiroidea y este grupo sería el que desarrollaría hipercalcemia.20,21
Para diferenciar la hipercalcemia debido a tirotoxicosis de aquella debido a hiperparatiroidismo, resulta útil la prueba de supresión con cortisona,22 modificada después de la sustitución por hidrocortisona,23 aún, cuando el hallazgo de adenomas paratiroideos en los enfermos hipertiroideos es más frecuente que en la población normal.17 Igualmente, la prednisona induce la disminución de la calcemia cuando esta es debida a tirotoxicosis.24,25 Ocasionalmente la hipercalcemia del hiperparatiroidismo puede ser suprimida por la terapia esteroidea.20 El hallazgo de hipofosfatemia acompañando a la hipercalcemia en pacientes con tirotoxicosis sugiere un hiperparatiroidismo coincidental.14,16,17
La sugerencia de una relación estrecha entre las hormonas tiroideas y paratiroideas no parece probable, ya que la hipercalcemia por exceso de hormonas tiroideas también se ha descrito en pacientes con hipoparatiroidismo asociado.14
La hipercalcemia tirotóxica se controla bien con drogas antitiroideas, si bien el período de tiempo necesario para lograr tal control es una variable imprevisible.14,20 Se han utilizado otras medidas terapéuticas como calcitonina, plicamicina (mitramicina), nitrato de galio y los bifosfonatos, con resultados variables,14-18, no obstante, los bifosfonatos inducen hipocalcemia en pacientes con hipertiroidismo.19 Debe recordarse que las tionamidas causan severos efectos hematológicos (cualquiera de ellos y con reactividad cruzada) y hepáticos (fundamentalmente el propiltiouracilo).5,6
En el caso expuesto, la respuesta normocalcémica con la administración de hidrocortisona e hidratación con cristaloides, se alcanzó después de dos semanas y su control estable con el empleo de metimazol, demostró el origen de la hipercalcemia en el hipertiroidismo.
CONCLUSIONES
Las manifestaciones clínicas fueron fundamentales para sospechar el estado de tirotoxicosis por hipertiroidismo de Graves-Basedow, confirmados después por las investigaciones de laboratorio. La hipercalcemia es un elemento infrecuente en esta enfermedad endocrina, los síntomas se solapan con el hipertiroidismo y su identificación primaria requiere un alto índice de sospecha. La aparición de una crisis hipercalcémica puede desencadenar graves complicaciones en el paciente, siendo esta un evento excepcional en pacientes con tirotoxicosis. La prueba de supresión de la hipercalcemia con esteroides es de gran utilidad clínica en su asociación con tirotoxicosis para descartar un hiperparatiroidismo concurrente.
REFERENCIAS BIBLIOGRÁFICAS
1. von Recklinghausen F. Die fibröse oder deformirende Ostitis, die Osteomalacie und die osteoplastische Carcinose in ihren gegenseitigen Beziehungen. Berlin: G. Reimer; 1891.
2. Aub JC, Bauer W, Heath C, Ropes M. Studies of calcium and phosphorus metabolism. III. The effects of the thyroid hormone and thyroid disease. J Clin Invest. 1929;VII(1):97-137.
3. Stanley MM, Fazekas J. Thyrotoxicosis simulating hyperparathyroidism. Am J Med. 1949 Aug;7(2):262-8.
4. Gurney C, Hall R, Harper M, Owen SG, Roth M, Smart GA. Newcastle thyrotoxicosis index. The Lancet. 1970 Dec 19;296(7686):1275-78.
5. Ziel FH, Talavera F, Griffing GT, editors. Hyperthyroidism [Internet]. New York: www.emedicine.com; 2012 [Last Updated: 2011 Oct 27]. Available from: http://emedicine.medscape.com/article/121865-overview
6. Gambert SR, Talavera F, Wehmeier K, Cooper M, Griffing GT, editors. Graves Disease [Internet]. New York: www.emedicine.com; 2012 [Last Updated: 2011 Sep 30]. Available from: http://emedicine.medscape.com/article/120619-overview
7. Lucas Martín AM, Foz Sala M, Sanmartí Sala A, Bueno Jiménez C. Enfermedades de la glándula tiroides. En: Rozman C, editor. Medicina Interna Farreras-Rozman. 16ª ed. Madrid: Ediciones Harcourt S.A; 2008. p. 2060-94.
8. Iwama S, Ikezaki A, Kikuoka N, Kim HS, Matsuoka H, Yanagawa T, et al. Association of HLA-DR, -DQ genotype and CTLA-4 gene polymorphism with Graves' disease in Japanese children. Horm Res. 2005 Jan 3;63(2):55-60.
9. Chu X, Pan CM, Zhao SX, Liang J, Gao GQ, Zhang XM, et al. A genome-wide association study identifies two new risk loci for Graves' disease. Nat Genet. 2011 Aug 14;43(9):897-901.
10. Furszyfer J, Kurland LT, McConahey WM, Elveback LR. Graves' disease in Olmsted County, Minnesota, 1935 through 1967. Mayo Clin Proc. 1970 Sep;45(9):636-44.
11. Weetman AP, Jameson JL. Disorders of the Thyroid Gland. In: Longo DL, Kasper DL, Jameson JL, Fauci AS, Hauser SL, Loscalzo J, editors. Harrisons Principles of Internal Medicine [CD-ROM]. 18th ed. New York: McGraw-Hill; 2012.
12. Kim M, Ladenson P. Thyroid. In: Goldman L, Schafer AI, editors. Goldmans Cecil Medicine. 24th ed. Philadelphia: Saunders Elsevier; 2012. p. e233-1-e233-14.
13. Boelaert K, Newby PR, Simmonds MJ, Holder RL, Carr-Smith JD, Heward JM, et al. Prevalence and relative risk of other autoimmune diseases in subjects with autoimmune thyroid disease. Am J Med. 2010 Feb;123(2):183.e1-9.
14. Guyer PB. Hypercalcaemia in Thyrotoxicosis. Brit Med J. 1965 Jan;1:169.
15. Brosius FC, Talavera F, Thomas CP, Schmidt RJ, Batuman V, editors. Hypercalcemia [Internet]. New York: www.emedicine.com; 2012 [Last Updated: 2012 May 17]. Available from: http://emedicine.medscape.com/article/240681-overview
16. Torres Ramírez A. Alteraciones del metabolismo del calcio, del fósforo y del magnesio. En: Rozman C, editor. Medicina Interna Farreras-Rozman. 16ª ed. Madrid: Ediciones Harcourt S.A; 2008. p. 1866-75.
17. Jüppner H, Potts JT. Disorders of the Parathyroid Gland and Calcium Homeostasis. In: Longo DL, Kasper DL, Jameson JL, Fauci AS, Hauser SL, Loscalzo J, editors. Harrisons Principles of Internal Medicine [CD-ROM]. 18th ed. New York: McGraw-Hill; 2012.
18. Sambandam K, Vijayan A. Fluid and Electrolyte Management. In: Cooper DH, Krainik AJ, Lubner SJ, Reno HEL, editors. The Washington Manual of Medical Therapeutics. 32nd ed. Washington: Lippincott Williams & Wilkins; 2007. p. 54-101.
19. Clark L, Mohammed A, Pillai A, Klotsas A, Masters P, Lawson N. Hyperthyroidism, an overlooked cause of severe hypercalcaemia. Grand Rounds. 2010;10:110-112.
20. Richards AJ. Hypercalcaemia in thyrotoxicosis with and without hyperparathyroidism. Postgrad Med J. 1970 Jul;46(537):440-6.
21. Askenasi R, Demeester-Mirkine N. Urinary excretion of hydroxylysyl glycosides and thyroid function. J Clin Endocrinol Metab. 1975 Feb;40(2):342-4.
22. Dent CE. Cortisone Test for Hyperparathyroidism. Br Med J. 1956 Jan 28;1(4960):230.
23. Dent CE, Watson L. Hyperparathyroidism and Sarcoidosis. Br Med J. 1966 Mar 12;1(5488):644-2.
24. Bortz W, Eisenberg E, Bowers CY, Pont M. Differentiation between thyroid and parathyroid causes of hypercalcaemia. Ann Intern Med. 1961;54:610.
25. Harper PS, Hughes RO. Severe hypercalcaemia from hyperthyroidism with unusual features. Br Med J. 1970 January 24;1(5690):213–214.
Recibido: 5 de julio de 2014
Aprobado: 9 de octubre de 2014
Dr. Rafael Pila Pérez. Especialista de II Grado en Medicina Interna. Profesor Titular y Consultante. Hospital Universitario Manuel Ascunce Domenech. Camagüey, Cuba. Email: rvpila@finlay.cmw.sld.cu