Introducción
Los tumores carcinoide son tumores malignos que surgen de las células neuroendocrinas. Ocurren con más frecuencia en el tracto gastrointestinal (48 %), pulmón (25 %) y páncreas (9 %), pero también pueden desarrollarse en muchos otros órganos, incluidos las mamas, la próstata, el timo y la piel. 1
La incidencia de estos tumores en el intestino delgado está en aumento. 2 En Japón se ha demostrado un aumento en la incidencia a nivel del intestino anterior (estómago y duodeno) de 1,05 (2005) a 1,67 (2010) por 100 000 habitantes. 3 La localización duodenal es poco frecuente, el representa 2 % de los tumores neuroendocrinos gastrointestinales. 4
Para el diagnóstico del tumor carcinoide es importante reconocer sus características endoscópicas, ya que a menudo se detectan de forma accidental en el examen de endoscopia gastrointestinal superior. Suelen presentarse como lesiones polipoides pequeñas, o más frecuente, como lesiones submucosas hemisféricas lisas, de color amarillo o rojo. 5
En la mayoría de los casos los carcinoides pueden pasar desapercibidos ya que los pacientes pueden permanecer asintomáticos hasta las etapas avanzadas, sin embargo, existen casos en los cuales se manifiestan a través del síndrome carcinoide. El cuadro clínico de este síndrome es causado por el efecto mecánico del tumor como cualquier otro tumor gastrointestinal o las hormonas secretadas por el tumor. 6) Los síntomas excitadores autónomos de las hormonas secretadas se identifican de manera ocasional y sirven como pista para el diagnóstico. 7
La historia típica dada por los pacientes incluye síntomas gastrointestinales como diarrea y calambres abdominales. Los síntomas dermatológicos se manifiestan por lo general como enrojecimiento debido a la liberación de histamina. Los signos ocasionales incluyen la presencia de telangiectasias. Otros síntomas sistémicos también pueden incluir sibilancias como resultado de la broncoconstricción debido a la liberación de histamina por el tumor. Además, algunos tumores pueden secretar otras hormonas peptídicas como la insulina, el glucagón, el péptido intestinal vasoactivo, la secretina o la gastrina, lo que puede producir otras manifestaciones clínicas. 8
Tanto la European Neuroendocrine Tumor Society (ENETS) como la North American Neuroendocrine Tumor Society (NANETS) han publicado pautas consensuadas para el diagnóstico y manejo de los tumores neuroendocrinos del intestino delgado. 9
Una prueba diagnóstica inicial útil para el síndrome carcinoide es la excreción urinaria durante 24 horas de ácido acético 5-hidroxi-indol (5-HIAA). Tiene 90 % de sensibilidad y especificidad para el diagnóstico de carcinoides intestinales. Otras pruebas menos utilizadas incluyen la concentración de cromogranina A y la medición de la excreción urinaria de serotonina. 10)
El síndrome carcinoide es poco frecuente en pacientes con carcinoides duodenales, rectales, del SNC, gástricos, colónicos o apendiculares (menos de 1 %), mientras que es más de ocho veces frecuente en los carcinoides de otras áreas. 11
El tratamiento del tumor carcinoide intestinal localizado es la resección quirúrgica con un margen negativo. La cirugía es la base del tratamiento y la única forma de lograr una cura completa. Sin embargo, la mayoría de los pacientes tienen tumores metastásicos sincrómicos o metástasis hepáticas en el momento de la presentación debido a la naturaleza indolente del tumor. El alcance de la resección quirúrgica depende del tamaño, la ubicación y la propagación local de la enfermedad. Se sigue el mismo principio de control locorregional utilizado en el tratamiento quirúrgico de los tumores malignos del intestino medio. Un tumor pequeño de 1 cm de tamaño puede extirparse localmente.
Esto es importante en los tumores duodenales donde se puede evitar la resección más amplia y la duodenectomía pancreática. Cuando se presentan complicaciones como la obstrucción intestinal el tratamiento quirúrgico está indicado para revivir la obstrucción intestinal de forma urgente. La resección intestinal segmentaria con el mesenterio afectado y la anastomosis primaria es un tratamiento suficiente para el control primario y el alivio de las complicaciones. 12
La tasa de supervivencia global a los cinco años de los pacientes con tumores carcinoides (al excluir el apendicular), es alrededor del 90 %. Incluso para los tumores del intestino delgado con metástasis hepáticas, la cifra es superior al 50 %. Sin embargo, la enfermedad generalizada, suele causar la muerte. 13
Se considera que de todas las presentaciones del tumor carcinoide, la localización duodenal es la menos frecuente, el hallazgo de un caso en el Hospital Clínico Quirúrgico Joaquín Albarrán ha resultado de interés para su comunicación.
Presentación del caso
Paciente masculino de 86 años de edad, con antecedentes de hipertensión arterial y diabetes mellitus tipo II, para lo cual lleva tratamiento con atenolol (25 mg) una tableta diaria y glibenclamia (5 mg) una tableta cada ocho horas.
Exploración física:
Presión arterial: 140/90 mm/ Hg; frecuencia cardíaca: 130 por minuto; frecuencia respiratoria: 34 por minutos; temperatura: 38,9 °C. Paciente consciente, inquieto, voz entrecortada, cianosis ungueal y peribucal con utilización de músculos accesorios de la respiración; ingurgitación yugular grado II; el tórax con disminución de los movimientos de amplexión y amplexación, evidencia de estertores crepitantes y subcrepitantes generalizados en ambos campos pulmonares. Abdomen ligero globuloso a expensas de panículo adiposo, blando y depresible. Extremidades inferiores hiperémicas. En la radiografía de tórax posteroanterior, se observaron infiltrados bilaterales multifocales confluentes. Los estudios analíticos se pueden apreciar (Tabla 1).
Tabla 1 Estudios de laboratorio realizados al ingreso
| Estudios | Resultados |
|---|---|
| Leucocitos | 22,47 [10^3uL] |
| Neutrófilos | 89,90% |
| Hemoglobina | 11,5 [g/dl] |
| Hematocrito | 37,40% |
| Plaquetas | 427 000 |
| Glucosa | 101 mg/dl |
| Ph | 7,19 |
| pCO2 | 43 mmHg |
| pO2 | 69 mmHg |
| HCO3 | 16,4 mmol/L |
Ante el cuadro descrito se realizó el diagnóstico de bronconeumonía bacteriana extrahospitalaria complicada y se decidió su ingreso en la terapia de cuidados intensivos; para lo cual se administró, oxígeno por máscara a razón de seis litros por minutos y ceftriaxona (1 gr) un bulbo endovenoso cada 12 horas. Luego de una evolución de cinco días, el paciente fallece. Se realizó la autopsia lo que arrojó como causa de muerte, una bronconeumonía bilateral abscedada.
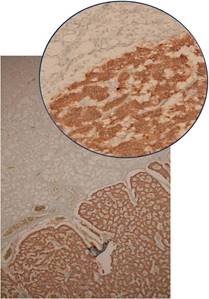
Además, en el estudio macroscópico del intestino, se observó a nivel de la primera porción del duodeno lesión de consistencia firme, ligeramente elevada de la superficie de aspecto polipoidea de 1 cm de diámetro, con una superficie de corte de color amarillo claro; al realizar el estudio histológico, se observó una lesión a nivel de la submucosa con revestimiento de la mucosa indemne (Figura 1).
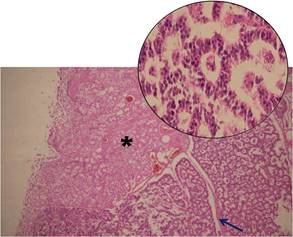
Figura 1 Lesión tumoral a nivel de la submucosa con superficie mucosa intacta (*), formada por islotes separados por tabiques fibrovascular (fecha) (10X). Círculo superior vista 40X.
Dicha lesión estaba compuesta por islotes separados por un estroma fibrovascular, las células adoptaban una disposición en forma de rosetas, aunque hacia la periférica se observaron áreas más sólidas; las células eran uniformes con núcleos pequeños y redondeados, con una cantidad moderada de citoplasma eosinófilo; no se observan mitosis ni necrosis (Figura 2).
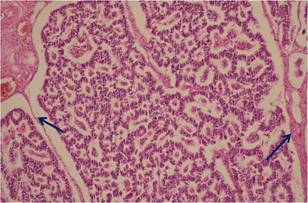
Figura 2 Disposición de las células en forma de en rosetas y de tabiques fibrovascular (fecha) (20X).
Al realizar tinción de inmunohistoquímica la lesión fue positiva para cromogranina. Se corresponde con el diagnóstico de tumor carcinoide de duodeno (Figura 3).
Discusión
La primera descripción histológica de los tumores carcinoides fue hecha, por Lubarsch en 1888; donde Oberndorferen 1907 quien los llamó Kleinen dünndar carcinome (pequeños carcinomas del intestino delgado) y al considerar su poca agresividad, acuñó el nombre de Karzínoide para tales tumores. Lubarsch demostró que estos tumores se originaban en las criptas de las glándulas de Lieberkuhn y luego Masson comprobó que en lo específico se originaban en las células de Kulchitsky. 13
Los tumores carcinoides son neoplasias neuroendocrinas que se encuentran con mayor frecuencia en el tracto gastrointestinal, ovarios, pulmones, bronquios, testículos y laringe. Suelen ser tumores más benignos que los carcinomas epiteliales en los mismos sitios anatómicos, aunque el término carcinoide abarca un amplio grupo de neoplasias que surgen de una variedad de células neuroendocrinas caracterizadas por diversos grados de agresividad. Dentro del tracto gastrointestinal los tumores carcinoides se encuentran más usual en el apéndice, seguidos del íleon, el recto y el estómago. 14
La localización duodenal del tumor carcinoide ocurre con menor frecuencia que en el estómago o el recto, 15 lo que representa 2 % de los tumores neuroendocrinos gastrointestinales (TNEG): con una incidencia anual de 0,07/100 000 habitantes y es más frecuente en varones de raza negra y edades entre 20-90 años. 4) Sin embargo, por su clínica se presentan en adultos a los 50 años, también en niños; son más comunes en el íleon (incluido el divertículo de Meckel); también yeyuno y en el duodeno se encuentran más frecuente en la primera porción y su frecuencia disminuye de forma progresiva hacia las partes distales del duodeno. Estos tumores son indolentes, en especial cuando son pequeños y se limitan a la submucosa y los síntomas por lo general son inespecíficos. 14
Por su características son pequeños (tamaño medio de 0,93 cm) con 77 % menos de 1,0 cm de diámetro y solitarios, sin embargo, 10-25 % tienden a ser múltiples. 16) Son tumores restringidos a la submucosa duodenal. 17
Se asocian con enfermedad celíaca, duplicación intestinal, pólipos inflamatorios, 14) síndromes como Zollinger-Ellison, MEN-1 y neurofibromatosis tipo 1, en especial si hay múltiples focos tumorales. 18
Por su histología se caracterizan por la presencia de células enterocromafines, es decir, esta estirpe tumoral se define por: propiedades argentafines a la tinción, producción de serotonina y gránulos secretorios pleomórficos. Son de tamaño medio, muestran leve o moderada atipia, la tasa de crecimiento es lenta (menor a 2 mitosis/10 campos de alto poder) y no presentan necrosis tumoral. Se han establecido diferentes patrones de crecimiento tumoral: nodular o insular, trabecular, acinar, tubular y atípico. En los pacientes con TNEG localizado en duodeno, yeyuno distal, íleon y apéndice predomina el patrón insular. En tumores de duodeno y yeyuno se encuentran en orden descendente de frecuencia: gastrinomas, somatostatinomas y paragangliomas gangliocíticos. En los tumores localizados en esófago, hígado y vesícula biliar se encuentra el patrón pleomórfico con atipia celular. 18
La nueva clasificación de carcinoides sugerida por la OMS clasifica los carcinoides duodenales, ampulares y yeyunales superiores como tumores endocrinos bien diferenciados, carcinomas endocrinos bien diferenciados o carcinomas endocrinos poco diferenciados. 19 Los tumores carcinoides se clasifican como típicos o atípicos según su actividad mitótica y la presencia de necrosis. 20) Los tumores carcinoides típicos exhiben menos de dos figuras mitóticas por cada 10 campos de alta potencia y ausencia de áreas necróticas.
En contraste, los tumores carcinoides atípicos exhiben más de dos figuras mitóticas por cada 10 campos de alta potencia o la presencia de focos necróticos. Solo un paciente en el estudio de casos, cuyo tumor era mayor de 6 cm y ubicado en la tercera parte del duodeno con invasión de T3, exhibió un tumor carcinoide atípico. El paciente desarrolló metástasis hepáticas y murió seis meses después de una resección de carcinoides duodenal. 14
La confirmación con inmunohistoquímica (positivos para sin cromogranina, sinaptofisina, Leu-7, enolasa, ki-67 y citoqueratina). 4) Lo cual es posible en virtud que los tumores carcinoides sintetizan gran cantidad de aminas bioactivas como 5-hidroxitriptamina o serotonina (5-HT), péptidos como la cromogranina A, taquicininas y varios factores de crecimiento, entre ellos, el factor de crecimiento transformante beta (TGF-β). 18 Lo cual a su vez determina en la generación del síndrome carcinoide (4 %), de Cushing y la acromegalia los cuales son infrecuentes. 4
El diagnóstico diferencial de un carcinoide duodenal incluye hamartoma de la glándula de Brunner, tejidos pancreáticos y gástricos heterotópicos, adenoma, adenocarcinoma, paraganglioma gangliocítico, tumor del estroma gastrointestinal (GIST), hiperplasia linfoide, síndrome de poliposis, enfermedad metastásica y neoplasias mesenquimales, como neurofibromas y schwannomas. 21
El tamaño mayor de 2 cm compromiso de la muscular propia y el bajo grado de diferenciación celular son los factores de riesgo para metástasis. 4 Estas se producen con más frecuencia en los ganglios linfáticos, mesenterio, hígado, pulmón y peritoneo. 22
Expresan una alta densidad de receptores específicos de somatostatina, que muestran una alta afinidad por el análogo de la somatostatina, octreotide. Por lo tanto, estas lesiones pueden visualizarse in vivo al usar octreótido marcado, que detecta las lesiones carcinoides y predice el efecto terapéutico de los análogos de la somatostatina contra estos tumores. 23
Por otro lado, los tumores carcinoides gastrointestinales que tienen menos de 10 mm de diámetro y están limitados a la capa submucosa muestran una baja frecuencia de ganglios linfáticos y metástasis a distancia, son buenos candidatos para terapias menos invasivas, como la resección endoscópica. Estas ofrecen al paciente una mejor calidad de vida en comparación con la resección quirúrgica. 15
De manera que el tratamiento puede ser endoscópico o quirúrgico. La resección endoscópica se recomienda en lesiones menor de 1 cm bien diferenciadas, fuera de la región periampular y sin compromiso de la muscular, caso contrario, debe operarse. 15 La resección quirúrgica se puede realizar cuando los tumores carcinoides son más grandes que 2 cm, cuando el índice mitótico es más alto que dos figuras mitóticas por campo de alta potencia el ultrasonido revela invasión de la pared profunda o afectación ganglionar peritumoral y la tomografía computarizada o la resonancia magnética indica la sospecha de afectación ganglionar. En estos casos, se recomienda una resección de espesor total con una linfadenectomía regional.
Al respecto Waisberg J et al. 14 comunicaron sobre un paciente que se sometió a una duodenectomía de la tercera y cuarta partes del duodeno con una linfadenectomía debido a la presencia de una lesión grande (6 cm) que invadió el retroperitoneo, mostró un alto índice mitótico y el examen de los ganglios linfáticos que se incluyeron en el espécimen quirúrgico reveló afectación neoplásica.
La supervivencia global de los pacientes con carcinoides duodenales es excelente en 80 a 90 % de los casos con tumores bien diferenciados, sin embargo, la supervivencia es menor entre los pacientes con neoplasias menos diferenciadas. La mayoría de los pacientes con tumores carcinoides duodenales mueren por otra causa, un hecho que se observó en la serie de casos y confirma la naturaleza indolente de la enfermedad. 24
Conclusiones
El carcinoide duodenal es un tumor raro cuyo diagnóstico endoscópico o histológico se realiza en la gran mayoría de los casos de forma incidental; se asocia por lo general con una progresión benigna, aunque se recomienda la extracción endoscópica de tumores menores de 1 cm sin localización periampular o evidencia de invasión de la capa de propia muscular evaluada mediante histología o ecografía endoscópica