Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Vaccimonitor
versão impressa ISSN 1025-028Xversão On-line ISSN 1025-0298
Vaccimonitor v.16 n.1 Ciudad de la Habana jan.-abr. 2007
Estudios de estabilidad de vida de estante en condiciones de estrés de la vacuna antileptospirósica vax-SPIRAL®
Maylén Machado, Tatiana Mahy, Elizabeth Pérez, Martha Noroña, Esther María Fajardo y Luis Izquierdo
Instituto Finlay. Centro de Investigación -Producción de Vacunas. Ave. 27 No.19805.
Los estudios de estabilidad constituyen requisito fundamental para avalar el Registro Médico Sanitario de un nuevo medicamento. Por tal motivo se diseñó y llevó a cabo un proyecto de estudio de estabilidad de vida de estante y en condiciones de estrés térmico a la vacuna antileptospirósica cubana vax-SPIRAL®, donde se evaluaron las propiedades físicoquímicas y biológicas fundamentales del producto (características organolépticas, pH, concentración de tiomersal, inocuidad inespecífica, potencia y esterilidad), con el objetivo de recomendar las condiciones de almacenamiento que garantizarán su calidad y se propone la fecha de vencimiento. Para esto, parte de las muestras se conservaron a temperatura de 2-
Palabras clave: Leptospira interrogans, vacuna antileptospirósica, estabilidad, vida de estante, estrés térmico, Cuba.
Introducción
Los estudios de estabilidad permiten conocer la capacidad que tiene un medicamento para conservar a lo largo del tiempo la integridad de sus propiedades físicas, químicas y biológicas necesarias para ejercer en el organismo el efecto para el cual ha sido diseñado. En el caso de los productos de origen biológico, como las vacunas, debido a la naturaleza compleja de su estructura, y a la elevada influencia que los métodos de producción y el almacenamiento pueden tener sobre ella, estos estudios revisten especial importancia. Por ejemplo la vacuna antileptospirósica cubana vax-SPIRALÒestá constituida por células enteras, inactivadas, de los serovares canicola canicola, icterohaemorrhagiae copenhageni y pomona mozdok de Leptospira interrogans, adsorbidas en gel de hidróxido de aluminio. En productos biológicos los métodos de ensayo influyen en los resultados obtenidos. Además estos productos son particularmente sensibles a los factores ambientales tales como los cambios de temperatura, la oxidación, la luz y el contenido iónico entre otros, por lo que para preservar la actividad biológica y evitar la degradación, se deben mantener en estrictas condiciones de almacenamiento.
Para dichos productos, la información que avala el tiempo y las condiciones de almacenamiento debe partir de estudios de estabilidad realizados a largo plazo en tiempo y condiciones de almacenamiento reales, (estudios de estabilidad de vida de estante). No obstante, los estudios acelerados y de estrés son también necesarios, pues permiten tener un mejor conocimiento del medicamento sometido a condiciones anormales de almacenamiento; estos estudios aportan valiosa información sobre múltiples elementos, muchos de los cuales deben tener su seguimiento en los estudios a largo plazo (1).
Por ejemplo, los estudios de estrés pueden aportar información sobre parámetros de ensayos específicos que constituyen indicadores de la estabilidad, sobre patrones de degradación, así como del comportamiento del producto ante períodos cortos fuera de las condiciones de almacenamiento establecidas, lo que ayuda en la predicción de sus afectaciones ante fallos durante el embarque o el almacenamiento.
El objetivo del presente trabajo es conocer la estabilidad de la vacuna antileptospirósica trivalente vax-SPIRALÒdurante el almacenamiento en condiciones normales (vida de estante) y en condiciones de estrés térmico.
Materiales y Métodos
Se diseñó y se ejecutó un proyecto de estudio de estabilidad, donde se evaluaron las principales propiedades fisicoquímicas y biológicas de la vacuna mediante un estudio de vida de estante y en condiciones de estrés térmico, con el objetivo de obtener información sobre el comportamiento de su estabilidad en el período de tiempo y condiciones recomendadas para su conservación y satisfacer la información solicitada para su Registro Médico Sanitario.
Muestras. Se estudiaron tres lotes de la vacuna antileptospirósica trivalente vax-SPIRAL® producidos en el Instituto Finlay e identificados con los números 6018, 6019 y 6021, con presentación de 10 dosis (5 mL por frasco).
Cepas de reto. Para el ensayo de potencia se emplearon cepas virulentas de Leptospira interrogans de los serovares canicola canicola, icterohaemorrhagiae copenhageni y pomona mozdok conservadas apropiadamente (2, 3).
Animales. Se utilizaron ratones OF1 (Oncins France cepa 1) con un peso entre 17 y
Análisis estadístico. Se hizo un análisis de datos de las muestras en estudio. Se realizó el análisis de varianza (ANOVA) en bloques al azar para comparar los parámetros cuantitativos entre los lotes en estudio. Los factores utilizados para el análisis fueron: 1. Lote, 2. Tiempo. Se utilizó el programa computadorizado Statística 98 Edition, Release 5.1.
Diseño de los estudios de estabilidad
Condiciones normales de almacenamiento (vida de estante). Las muestras de cada lote se obtuvieron aleatoriamente y se almacenaron a temperatura de
Condiciones de estrés térmico. Diferentes muestras de cada uno de los lotes en estudio, conservadas a temperaturas de
Ensayos físico-químicos
pH. Se utilizó un medidor de pH (RADIOMETER modelo PHM 83, Dinamarca) y soluciones de referencia de pH 4.005 y 7.000 (RADIOMETER analytical, France). El ensayo se consideró satisfactorio si la muestra tuvo un pH de
Concentración de tiomersal. Se empleó el método espectrofotométrico (4). El ensayo se consideró satisfactorio si la concentración era de 005-0,2 mg/mL.
Características organolépticas. Se realizó la evaluación sensorial de apariencia (suspensión), color (blanco opalescente) y olor (característico a tiomersal). Dicha evaluación se realizó a cuatro bulbos durante la ejecución de
Ensayos Biológicos
Inocuidad inespecífica. Se utilizaron 2 curieles y 6 ratones por cada lote de vacuna en estudio. Los ratones fueron inoculados con una dosis de 0,5 mL de vacuna por vía intraperitoneal, mientras que los curieles recibieron 1 mL por igual vía. Estos animales fueron observados diariamente y pesados al inicio y al final del ensayo, 7 días posteriores a la inoculación (5, 6). Para considerarse satisfactorio el ensayo, los animales deben observarse en buen estado de salud (5) e incrementar el peso corporal durante el tiempo establecido.
Potencia. Se utilizaron 18 hámsters por cada lote, que se inmunizaron con una dilución 1:5 de la vacuna por vía intramuscular, con una dosis de 0,5 mL. Por cada ensayo se separaron, además, 15 animales no inmunizados como controles. Después de 14 días los animales (6 inmunizados y 5 controles para cada serovar) fueron retados respectivamente con las tres diferentes cepas virulentas de Leptospira interrogans, en inóculos que contenían de 1 000–500 000 DL50. Los animales se observaron durante 14 días y se registraron las muertes ocurridas.
El ensayo se consideró válido cuando la supervivencia de los animales inmunizados y la mortalidad de los controles fue mayor o igual a 80%.
Preparación de la dosis de reto y determinación de la Dosis Letal media (DL50)
Para ello se partió del lote semilla de trabajo de las cepas anteriormente mencionadas; se cultivaron en medio Ellinghausen (2) durante 6 días a
Ensayo de esterilidad. Se empleó el método de filtración por membrana (8). Se realizó solamente al inicio y al final del estudio.
Resultados y Discusión
El comportamiento de los parámetros físicoquímicos correspondientes a cada uno de los lotes a lo largo del estudio de estabilidad de vida de estante, en condiciones de estrés, se mantuvo dentro de los límites de aceptación, como puede observarse en
Tabla 1. Resultados de los ensayos de determinación de pH y tiomersal realizados a la vacuna vax-SPIRAL® en el estudio de vida de estante.
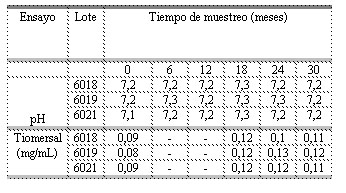
- Ensayo no realizado
Tabla 2. Resultados de los ensayos de determinación de pH y tiomersal realizados a la vacuna vax-SPIRAL® en el estudio en condiciones de estrés.
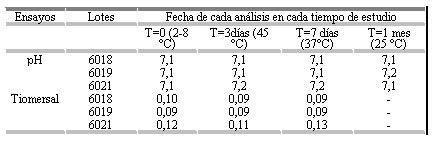
- Ensayo no realizado
El ensayo de inocuidad inespecífica fue satisfactorio para todos los lotes en todos los tiempos de muestreos y para ambos estudios realizados. Todos los lotes pasaron satisfactoriamente el ensayo de esterilidad.
Los resultados del ensayo de potencia de ambos estudios en términos de la supervivencia de los animales inmunizados se muestran en las Tablas 3 y 4, respectivamente.
Tabla 3. Resultados del ensayo de potencia de la vacuna vax-SPIRAL®. Muestras almacenadas a temperatura de 2 – 8 ºC.
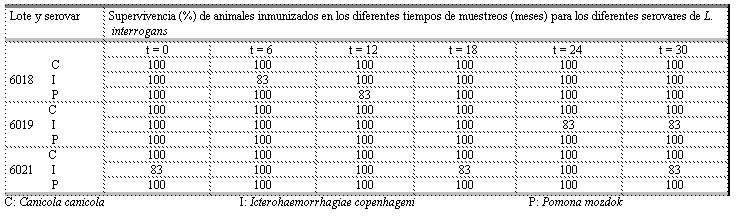
C: Canicola canicola I: Icterohaemorrhagiae copenhageni P: Pomona mozdok
Tabla 4. Resultados del ensayo de potencia de la vacuna vax-SPIRAL®. Muestras sometidas a estrés térmico.

C: Canicola canicola I: Icterohaemorrhagiae copenhageni P: Pomona mozdok
Un comportamiento similar a lo anterior en los por cientos de protección al serovar icterohaemorrhagiae copenhageni, lo observamos, independientemente de la temperatura de exposición, en los animales inmunizados con las muestras de los lotes sometidos a condiciones de estrés (Tabla 4). En ese caso hubo un lote cuya potencia no fue apropiada después de estar sometido durante un mes a la temperatura de 20–25 ºC. Por tanto, se recomienda no exponer la vacuna a temperaturas superiores a
A pesar de que la virulencia del inóculo (DL50) sobrepasó la dosis mínima de reto establecida para la evaluación de las variantes de muestras de la vacuna contra la leptospirosis (1000-500000 DL50, [Instituto Finlay. Procedimiento Normalizado de Operación (PNO 12-236). Ensayo de Potencia de la vacuna antileptospirósica trivalente vax-SPIRAL®, 2005)], se observaron, por lo general, que los por cientos de supervivencia fueron superiores al 83% en todos los lotes y durante todo el estudio, en contraste con los por cientos de mortalidad de los animales controles que se mantuvieron en valores superiores al 80% (datos no mostrados). Sólo en dos ocasiones y para lotes diferentes en cada caso, se observaron valores de supervivencia de 67% en animales inmunizados con esta vacuna. Esto puede estar relacionado con la influencia negativa que tienen las condiciones de estrés sobre la vacuna.
Conclusiones
· Se considera que la vacuna vax-SPIRALâ es estable cuando se conserva de 2-
· Se propone un período de validez de 24 meses, siempre que se almacene a la temperatura de 2–8 ºC .
· En términos de potencia, característica fundamental en una vacuna, el producto no es estable cuando se expone a temperaturas superiores a 37 ºC por tiempos que excedan a una semana. Por lo que consideramos que estos resultados aportan la información requerida acerca de la estabilidad de vax-SPIRALâ para su Registro Médico Sanitario.
Agradecimientos
Les agradecemos a Bernardo Ortíz, Eduardo Álvarez, Yaumara Hernández, Iyalili Labrador y Juan Francisco González, por haber brindado su valiosa ayuda en la realización de este estudio.
Referencias
1. Centro para el Control Estatal de los Medicamentos (CECMED). Regulación No. 25-2000. Requerimientos de los estudios de estabilidad para el registro de productos biológicos y biotecnológicos. La Habana, Cuba, 2004. (Documento regulatorio).
2. Ellinghausen HC, McCullough WG. Nutrition of Leptospira pomona and growth oh 13 other seroptypes: fractionation of oleic albumin complex and a medium of bovine albumin and polysorbate 80. Am J Vet Res 1965;26:45-51.
3. Fajardo EM, Ortíz B, Chávez A, y col. Normalización de la dosis letal 50% de cepas de Leptospira interrogans utilizadas en el control de la vacuna antileptospirósica cubana para uso humano. Rev Cub Med Trop 1998;50 (1):22-26.
4. World Health Organization, Geneva, BLG/UNDP/82.1. Manual of details of tests required on final vaccines used in the WHO Expanded Program of Immunization. Test for Thiomersal, p. 22, 1982.
5. USP 26 NF-21 (Suplemento 2), Safety test, 2003:1703 (Documento regulatorio).
6. Normas Cubanas. 1389)NC 26-67:91. Medicamentos. Prueba de inocuidad. Métodos de ensayos.
7. Habel KH. Habel test for potency, Annex: Calculating 50% end point dilutions by the method of Reed and Muench. En: Meslin FX, Kaplan MM, Koprowski H, eds. Laboratory techniques in rabies,4 ,ed,Geneva:WHO,1996:371-2.
8. USP 26 NF-21 (Suplemento 2), Sterility Test, 2003; 71:1686-1690, (Documento regulatorio).
Stability studies of shelflife and in stress conditions of Leptospirosis vaccine vax-SPIRAL®
Abstract
Stability studies are mandatory for Registration Applications of a new drug substance. Shelf life and stress temperature stability studies were designed and carried out to the Cuban leptospirosis vaccine vax-SPIRAL®, in which main physico-chemical and biological properties of the product (organoleptic characteristics, pH, thiomersal concentration, unspecific innocuity, potency and sterility) were evaluated in order to recommend storage conditions and expiration date. For this purpose, part of the samples were stored between 2-
Keywords: Leptospira interrogans, leptospirosis vaccine, stability, shelflife, stress temperature,
Recibido: Diciembre de 2006 Aprobado: Abril de 2007














