My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Vaccimonitor
Print version ISSN 1025-028XOn-line version ISSN 1025-0298
Vaccimonitor vol.16 no.2 Ciudad de la Habana May-Aug. 2007
Maylen Machado, Mariela Naranjo, Marta González, Niurka Batista, Andrés González, Yolanda Abreu, Vismark Torres, Viviana Pérez Amat, Juan F. Infante.
Instituto Finlay. Centro de Investigación-Producción de Vacunas. Ave. 27 No. 19805 e/ 198 y 202.
La Lisa, Ciudad de La Habana. Cuba.
Correo electrónico: marielanar@finlay.edu.cu
Los componentes de membrana externa (CME) de Leptospira son candidatos potenciales para la producción de vacunas contra la leptospirosis. En este trabajo se inmunizaron hámsters y conejos con variantes de vacunas de CME solubilizados en SDS y adsorbidas en gel de hidróxido de aluminio. Se emplearon dos dosis por vía intramuscular, con un intervalo de 6 semanas. Las dosis empleadas fueron de 25, 5 y 2,5 µg para hámsters y 25 µg para conejos. La respuesta humoral se evaluó mediante microaglutinación (MAT) y el ensayo inmunoabsorbente de unión a la enzima (ELISA). Se evaluó además el carácter protector de la respuesta inducida por estas preparaciones mediante el reto de los hámsters inmunizados, contra 20 000 dosis letal 50% (DL50) de la cepa homóloga altamente virulenta y mediante inmunización pasiva. Para ello se utilizó el suero de los conejos obtenidos en la semana 8 frente a 10 000 DL50. La MAT y el ELISA evidenciaron el poder inmunogénico de las preparaciones evaluadas. Las preparaciones vacunales empleadas no solo fueron capaces de proteger al 100% de los hámsters contra el reto de la cepa homóloga, sino que también, en el caso de los hámsters inmunizados pasivamente, fueron capaces de prevenir la infección renal y el establecimiento de leptospiras en órganos, evitando así el estado de portador, a diferencia de los controles no inmunizados, donde se obtuvo un 100% de mortalidad y se observaron serias lesiones a nivel de los órganos estudiados.
Palabras clave: Leptospira, proteínas de membrana externa, PME, inmunogenicidad, protección, lipopolisacárido, LPS.
Introducción
Se ha establecido de forma clara que el desarrollo de una respuesta inmune humoral durante la leptospirosis es importante en la resistencia a la infección (1). Dicha inmunidad parece depender de la producción de anticuerpos aglutinantes y opsónicos, dirigidos contra determinantes antigénicos serovar o serogrupo específicos (2).
Hasta hace algunos años todos los antígenos protectores que se habían logrado identificar eran de naturaleza glicolipídica. Aunque han sido llamados de diferentes formas (F4, TM, PE, Pag, LLS, LPS), está claro que todos derivan del lipopolisacárido de Leptospira y presentan características distintivas en cuanto a actividad biológica y endotóxica. La protección conferida por estos lipopolisacáridos es serovar específico (3-5) y muchos de los genes relacionados con su biosíntesis ya han sido dilucidados (6).
Se piensa que el LPS sea la base de la eficacia protectora de las vacunas de células enteras de leptospiras que son usadas en animales domésticos y en humanos. Desafortu-nadamente, los antígenos LPS tienen una gran variación entre las serovariantes. En contraste con el LPS, se cree que las proteínas de membrana leptospirósicas sean altamente conservadas (7). Por esta razón, hay un gran interés en dichas proteínas, para el desarrollo de pruebas de serodiagnósticos confiables y vacunas efectivas para la protección contra riesgos individuales (8).
No fue hasta el año 1994 que empezaron a descubrirse antígenos protectores de naturaleza proteica, siendo descritas tres clases de proteínas de membrana externa [OMPs, (siglas en inglés)]: proteínas de transmembrana, lipoproteínas y las proteínas periféricas (9,10).
OmpL1, una de las primeras en ser descubiertas, parece tener al menos 10 segmentos de transmembrana, los que posiblemente son responsables de su movilidad electroforética. En cambio Omp52, una de las más recientemente encontradas, de 52,6 kDa, posee un dominio consenso OmpA C-terminal y al parecer interviene en la interacción entre la célula hospedera y el patógeno durante la infección (11).
La segunda clase de OMP se encuentra anclada a la envoltura externa por ácidos grasos unidos a una cisteína amino terminal y se estima que existan al menos en un número de cinco en las membranas externas. Un estudio reciente sobre la identificación del conjunto de OMPs existente en la célula bacteriana, encontró que la misma está constituida mayoritariamente por un pequeño número de proteínas ya caracterizadas, en el siguiente orden relativo de abundancia: LipL32>LipL21>LipL41. De ellas, solo LipL32 no había sido identificada como una proteína expuesta en la superficie (12). Es bien conocido que LipL32 es la más notable en el perfil proteico y que es un antígeno inmunodominante durante la leptospirosis humana (13). De LipL41 se sabe que provee inmunoprotección sinérgica con OmpL1, lo que las hace candidatos potenciales para una vacuna (9). Otras lipoproteínas han sido reportadas en la literatura como Q1p42, LipL36, expresada in vitro, pero no in vivo y Loa22, localizada en la envoltura externa de las cepas patógenas, por lo que se asocia a la virulencia (9, 14-16).
De las OMPs del tercer grupo, se conoce desde hace poco que P31Lip45 es exportada como una lipoproteína de 45-kDa y procesada a la forma de 31 kDa C-terminal que se asocia a la envoltura externa (9).
En general, las OMPs son fragmentos inmunogénicos, a los que en el caso de las cepas patógenas de Leptospira se enlazan anticuerpos exitosos reconocidos por anticuerpos de enfermos, por lo que han sido útiles en el diagnóstico de la leptospirosis (17). Son capaces de inducir una respuesta inmune contra las leptospiras patógenas comparable con la inducida frente a una inmunización con células completas (2,18) y lo que es más importante, previenen la infección renal. Además se ha demostrado que algunas de ellas son género específico (19), (sólo están presentes en el género Leptospira interrogans y no en el de L. biflexa) y están involucradas en la infección, transmisión, virulencia, supervivencia y adaptación a las condiciones ambientales de Leptospira, además de ser excelentes candidatos para las vacunas de ADN (11, 12, 14, 15, 17,20).
No obstante, hay que señalar que nuevas investigaciones sugieren que no solo la membrana externa es atractiva desde el punto de vista inmunológico, sino que la membrana interna también lo es, por contener elementos relacionados, al parecer, con la virulencia. Tal es el caso de la llamada Lag42, proteína de 42 kDa, cuya localización del gen que la codifica se conserva entre las leptospiras patógenas y no entre las no patógenas (21)
Por la importancia inmunológica de la envoltura externa, nos hemos propuesto como objetivo evaluar el carácter inmunogénico y protectogénico de la respuesta inducida por los CME de Leptospira pomona serovar mozdok, así como su habilidad para prevenir la infección renal, requisitos indispensables que debe tener un agente inmunizante para que pueda considerarse eficaz en el control de la leptospirosis (22).
Materiales y Métodos
Preparación del inmunógeno
Se prepararon dos variantes inmunogénicas consistentes en CME obtenidos de L. pomona serovar mozdok en dos momentos diferentes del proceso de solubilización con SDS según el método descrito por Auran y col. (23) y modificado por Nunes-Edwards (24). La variante A incluyó componentes obtenidos de la segunda centrifugación (Ffracción I) y la variante B, componentes obtenidos después de la ultracentrifugación (Ffracción IV), según lo reportado por Machado y col. (25). El precipitado de cada una de las fracciones se resuspendió en 10 mL de Tampón Fosfato Salino (TFS) y seguidamente se determinó la concentración de proteínas por el método de Lowry (26). Luego fueron adyuvados en gel de hidróxido de aluminio previamente ajustado a una concentración de 5 mg/mL en TFS pH 7,2 y esterilizado a 121 °C/15 min a 1 atmósfera.
Cada variante se ajustó a una concentración de 50 µg/mL de CME y se adsorbió en gel de hidróxido de aluminio (AlhidrogelÒ) (1 mg/mL). Como preservo se utilizó tiomersal (Merck) a una dilución de 1:10 000. v:v. Las variantes formuladas se dejaron en agitación durante la noche a 28 °C. El control de la adsorción se realizó mediante la determinación de proteínas en la fase superior de la suspensión del inmunógeno, preparado después del tiempo de adsorción establecido, mediante la lectura de la Densidad Óptica (D.O) a 280 nm.
Estudio de la inmunogenicidad de las variantes A y B
La capacidad inmunogénica se desarrolló en dos modelos animales: conejos Nueva Zelanda y hámster Sirio Dorado (Misocricetus aureatus); en este último, además se evaluó la protección inducida, tanto activa como pasiva, mediante la prueba de potencia e inmunización pasiva, respectivamente.
Se inmunizaron 4 conejos (machos) de 1,5–1,9 kg de peso corporal y 12 semanas de nacidos, procedentes del Centro Nacional para la Producción de Animales de Laboratorio (CENPALAB, Cuba), mantenidos en cajas plásticas INPUD bajo condiciones convencionales de manejo y alimentación. Al suero de estos animales se les realizó MAT, con el objetivo de comprobar la ausencia de anticuerpos aglutinantes contra L. pomona serovar mozdok. Dos conejos fueron inmunizados con la variante A y los dos restantes con la variante B. La dosis en cada caso fue de 0,5 mL por vía intramuscular (IM) profunda en una de las extremidades posteriores. El intervalo entre dosis fue definido según la respuesta humoral obtenida en cada caso. Para esto se realizaron muestreos semanales mediante la extracción de sangre de la vena marginal de la oreja. La sangre fue centrifugada a 3000 rpm durante 15 min en centrífuga de mesa JOUAN y el suero fue conservado a –20 oC.
Se utilizaron un total 110 hámsters de 50-60 g de peso corporal procedentes del CENPALAB, avalados por el correspondiente certificado de calidad genética y sanitaria expedida por el centro suministrador. Los animales se mantuvieron en cajas T2 a razón de 5 animales por caja, bajo condiciones convencionales de manejo y alimentación. De forma similar a los conejos se les realizó MAT, con el objetivo de comprobar la ausencia de anticuerpos aglutinantes contra L. mozdok. Se aplicaron diferentes volúmenes del inmunógeno (0,5, 0,1 y 0,05 mL), lo que correspondió con 25, 5 y 2,5 µg, respectivamente. Fueron inmunizados 90 hámsters. Sesenta animales (20 por cada concentración) recibieron una dosis del inmunógeno de la variante B, mientras que los 30 restantes (10 por cada concentración) recibieron dos dosis, con un intervalo entre dosis de 6 semanas. Ambos esquemas se aplicaron por vía IM profunda en la cara interna del músculo de una de las extremidades posteriores. Como controles se utilizaron 20 hámsters no inmunizados. Se realizaron muestreos de sangre semanales del plexo retroorbital durante 8 semanas y los sueros se conservaron a -20 ºC hasta su posterior utilización. A continuación se muestra el diseño del estudio:
Diseño Experimental
| Grupos | No. de animales por Grupo | Antígeno por dosis (µg) |
| I | 30* | 25,0 |
| II | 30* | 5,0 |
| III | 30* | 2,5 |
| IV | 20** | - |
* 15 animales fueron utilizados para evaluar la potencia del inmunógeno, después de la aplicación de una (10 animales) y dos dosis (5 animales); mientras que los 15 restantes fueron utilizados para definir la dinámica de la respuesta humoral.
** Animales no inmunizados usados como controles de la cepa de reto. Cinco de ellos fueron utilizados como controles en la evaluación de la respuesta humoral.
Prueba de potencia
Cinco animales de cada grupo fueron retados a diferentes intervalos de tiempo: 2, 6 y 8 semanas con 20 000 DL50 de la cepa de reto altamente virulenta de L. pomona serovar mozdok.
La potencia del suero de los conejos inmunizados con las variantes A y B de CME fue evaluada mediante la técnica de inmunización pasiva en hámsters por ser los conejos una especie resistente a la leptospirosis; para esto se prepararon 5 mL de las siguientes muestras:
o Muestra I: Suero de conejo inmunizado con la variante A.
o Muestra II: Dilución 1/2 en TFS del suero de conejo inmunizado con la variante A.
o Muestra III: Suero de conejo inmunizado con la variante B.
o Muestra IV: Dilución 1/2 en TFS del suero de conejo inmunizado con la variante B.
o Muestra V: Suero de conejo no inmunizado.
o Muestra VI: Dilución 1/2 en TFS del suero de conejo no inmunizado.
Para este ensayo se emplearon un total de 30 hámsters con un peso corporal promedio entre 50-60 g provenientes del CENPALAB, mantenidos bajo condiciones similares a las ya descritas. A estos animales se les inoculó por vía intraperitoneal (IP) 1 mL de las muestras antes mencionadas. Se utilizaron además 5 animales como controles no inmunizados. Los animales fueron retados entre las 18–24 h de administrado el suero, con un inóculo que contenía 10 000 DL50 de la cepa 108 altamente virulenta de L. mozdok. Los animales se observaron durante 14 días (18) y se registraron las muertes.
Preparación de la dosis de reto y definición de la DL50
Para ello se partió de la cepa 108 de L. mozdok, cultivada en medio Tween más albúmina (TA) durante 5-7 días a 28 ºC, garantizando que la misma tuviera buena motilidad y uniformidad celular (de 5 a 6 leptospiras por campo). La dosis inicial (dosis de reto) correspondió con la dilución 1:10 de la dilución del cultivo cuya observación al microscopio de campo oscuro mostró la presencia de 10 a 12 células por campo, evaluado con un lente de 40x. La concentración celular de la dosis inicial fue determinada mediante conteo en cámara de Petroff Hausser. Se inocularon 60 animales en grupos de a 5 con 12 diluciones (10-1 a 10-12) de la cepa, partiendo de la dilución de reto. Los hámsters se observaron durante 14 días y se registraron las muertes. La determinación de la DL50 se realizó mediante el método descrito por Reed y Muench (27).
Prevalencia de Leptospira en órganos
Se tomaron muestras de hígado y riñón de los animales que sobrevivieron al reto tanto de la prueba de potencia como del ensayo de inmunización pasiva, con el objetivo de realizar estudios histopatológicos y cultivo. Para los estudios histopatológicos las muestras de los órganos fueron fijadas en formol neutro al 10% para tinción con Hematoxilina-Eosina y Warthyn Starry (28). Para aislamiento, las muestras fueron sembradas en medio líquido TA e incubadas a 28 ºC durante 14 días, evaluando el crecimiento mediante observación al microscopio de campo oscuro.
Evaluación de la respuesta inmune humoral
La respuesta inmune humoral se evaluó mediante las técnicas de MAT (29) y ELISA (30).
MAT: Se utilizó como antígeno la cepa virulenta del serovar mozdok 108, cultivada según las condiciones antes descritas, garantizando que la misma, al ser observada bajo el microscopio óptico, tuviera un crecimiento homogéneo (de 5 a 6 leptopspiras por campo ), no tuviera contaminantes que provocan la presencia de aglutinaciones inespecíficas y ajustadas a una concentración de 100-200 x 106 células/mL (D.O 0,070-0,090). Se realizaron diluciones dobles seriadas de los sueros a evaluar desde 1:4 hasta 1:4096 en (TFS) pH 7,2 para un volumen final de 50 µL, utilizando para ello placas de poliestireno de 96 pocillos (DinatechÒ). Como controles positivos se emplearon antisueros de Referencia, procedentes del Laboratorio de Control de Calidad del Instituto Finlay, y como control negativo los mismos antígenos diluidos en TFS. Las muestras fueron mezcladas con 50 µL del antígeno e incubadas a 37 ºC durante 1 h. Transcurrido este tiempo fueron observadas al microscopio de campo oscuro. El título de los sueros se definió como la mayor dilución a la que se obtuvo un 50% de aglutinación con respecto al control negativo.
ELISA: La respuesta de anticuerpos se evaluó mediante un sistema ELISA de células fijadas a la placa, utilizando como antígeno de recubrimiento una suspensión de células lavadas de L. mozdok (cepa 108) ajustada a 200 x 106 células/mL. Las placas de poliestireno de fondo plano de 96 pocillos (DinatechÒ) fueron recubiertas con 100 µL del antígeno e incubadas toda la noche a 50 ºC hasta la completa desecación del antígeno. Luego las placas fueron bloqueadas con TFS pH 7,2 conteniendo leche descremada (Merck) al 1% e incubadas 1 h a 37 ºC en cámara húmeda. Después de tres lavados en TFS pH 7,2 que contenía 0,05% Tween 20 (solución de lavado), se realizó una dilución 1:320 de las muestras a evaluar en TFS pH 7,2 que contenía 1% leche más 0,05% Tween 20, se añadió 100 µL por pocillo. Posteriormente las placas fueron incubadas 3 h a 37 °C en cámara húmeda y posteriormente lavadas cuatro veces con solución de lavado; 100 µL del conjugado proteína A-peroxidasa peroxidasa, elaborado en el Centro de Ingeniería Genética y Biotecnología (CIGB), a una dilución 1:6 000 en el mismo tampón, se aplicaron en las placas y estas se incubaron 1 h a 37 ºC. Seguidamente las placas fueron lavadas según se describe arriba. La reacción antígeno-anticuerpo fue detectada utilizando como sustrato la ortofenilendiamina (Sigma) y finalmente se realizó la lectura de la D.O a 492 nm en un lector ELISA (Titertek MultiskanÒ, Plus).
El título fue definido como la mayor dilución cuyo valor de D.O es el 50% del valor máximo (32).
Resultados y Discusión
Como se planteó anteriormente, a partir de las fracciones I y IV fueron preparadas las variantes A y B, respectivamente, ajustadas a la misma concentración, no detectándose ninguna proteína no absorbida a hidróxido de aluminio.
La variante B fue seleccionada para ser aplicada a las dos especies de animales porque contiene los CME obtenidos por la metodología descrita por Nunes-Edward, y era también objetivo de este trabajo investigar si la pérdida de antígenos que se produce usando esta metodología, según lo reportado por Machado y col.(25) y que están involucrados con la inducción de la respuesta inmune, podría tener efectos negativos en la protección de dicha respuesta.
Los resultados obtenidos del estudio de la capacidad inmunogénica realizado en las dos especies animales: conejo y hámster, se muestran en las Tablas 1 y 2, respectivamente. Para ambas variantes la segunda dosis se aplicó a las 6 semanas de iniciado el esquema. En la variante B se aplicó además un booster intravenoso en la semana 7; los animales se sacrificaron después de evaluada la respuesta.
Tabla 1. Resultados de la evaluación de la inmunogenicidad de las variantes A y B en conejos, mediante MAT.
| Variante de vacuna | Conejo No. | Tiempos de extracción de sangre (semanas) | ||||||||
| T0 | T1 | T2 | T3 | T4 | T5 | T6 | T7 | T8 | ||
| A | 1 | - | * | 1/8 | * | 1/64 | 1/64 | 1/64 | 1/256 | * |
| 2 | - | * | 1/16 | * | 1/16 | 1/32 | 1/32 | 1/1024 | * | |
| B | 1 | - | * | - | * | - | - | - | 1/8 | 1/64 |
| 2 | - | * | - | * | - | 1/4 | 1/4 | 1/4 | 1/64 | |
Tabla 2. Resultados de la evaluación de la inmunogenicidad de la variante B en hámsters mediante MAT.
| Variante B (dosis) µg | Tiempos de extracción de sangre (semanas) | ||||||||
| T0 | T1 | T2 | T3 | T4 | T5 | T6 | T7 | T8 | |
| 25 µg | - | 1/4 | 1/16 | 1/32 | 1/64 | 1/64 | 1/64 | * | 1/4096 |
| 5 µg | - | 1/4 | 1/8 | 1/16 | 1/32 | 1/32 | 1/32 | * | 1/1024 |
| 2,5 µg | - | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | * | 1/64 |
| Controles | - | - | - | - | - | - | - | - | - |
Leyenda: * No evaluado T6 = Momento de aplicación de la segunda dosis
La aplicación de la segunda dosis en los conejos, fue definida sobre la base de los resultados obtenidos semanalmente de la evaluación de los sueros por MAT, los cuales mostraron que entre las semanas 5 y 6 de iniciado el esquema de inmunización los títulos de aglutininas se mantuvieron estables, por lo que se decidió aplicar una segunda dosis en este último tiempo. Con ello logramos el efecto booster en forma apreciable en los conejos inmunizados con la variante A, quienes llegaron a alcanzar títulos de 1:256 y 1:1024. No ocurrió así con los inmunizados con la variante B, a los que una semana más tarde les fue administrada una tercera dosis por vía intravenosa para obtener niveles superiores en la respuesta, llegándose a alcanzar en ambos conejos títulos de 1:64.Para analizar las causas de estas diferencias realizamos un estudio comparativo de cada uno de los preparados vacunales, basándonos en el perfil electroforético de las fracciones I y IV reportado por Machado y col. (25). Si tenemos en cuenta que no se evidenciaron diferencias cualitativas, sino cuantitativas entre el patrón electroforético de ambas fracciones y que las variantes A y B fueron ajustadas a la misma concentración, es lógico pensar que la representación de estas proteínas comunes es menor en la variante B. Por lo que pudiéramos decir que las diferencias inmunogénicas entre ambos preparados vacunales reflejados en la MAT pueden deberse a la presencia en el inmunógeno A de una mayor cantidad de estas proteínas, presentes también en el inmunógeno B, pero en menor cuantía. Estos resultados corroboran lo planteado por Machado y col (25) acerca de la pérdida de antígenos involucrados en la respuesta inmune, usando la metodología descrita por Nunes–Edward para la obtención de CME, utilizada en este trabajo.
Los títulos de aglutininas observados por MAT al evaluar los sueros de los hámsters inmunizados mostraron un incremento de los mismos tras la aplicación de la primera dosis, los cuales están en correspondencia con la dosis de CME empleada. Estos títulos se incrementan ligeramente con la administración de la segunda dosis hasta alcanzar valores de 1:4 096; 1:1 024 y 1:64 para las dosis de 25, 5 y 2,5 µg, respectivamente, en la última semana evaluada.
Si analizamos de forma comparativa los títulos de aglutininas obtenidos en las dos especies trabajadas frente al inmunógeno B con la misma dosis (25 µg), podemos apreciar que hay una respuesta significativamente superior en la especie hámster. Esto puede estar relacionado con que la dosis aplicada, de acuerdo con el peso corporal de ambos fue 30 veces mayor para el hámster. Además en esta respuesta pudiera influir la diferente susceptibilidad a la enfermedad de estas dos especies. El conejo es resistente a la leptospirosis, mientras que el hámster es el modelo animal de referencia para los estudios de vacuna dada su alta sensibilidad a esta patología (28).
Los resultados de la evaluación de la respuesta humoral por medio del ELISA en ambas especies se pueden apreciar en las Figuras 1 y 2. En la primera se observa la respuesta humoral obtenida en los conejos. En este caso se evidencia un incremento gradual en la respuesta IgG durante las 6 semanas siguientes a la aplicación de la primera dosis, tiempo en que se administra una segunda dosis que conlleva a un nuevo incremento en la respuesta. En la Figura 2 en cambio se representan los resultados en hámster, para quienes la magnitud de la respuesta está en correspondencia con la dosis de CME aplicada, siendo mayor para 25 mg y menor para 2,5 mg. Los niveles de anticuerpos se incrementan desde la primera dosis y alcanzan su mínima expresión en la semana 6, momento en que es aplicada una segunda dosis, obteniéndose un incremento en los niveles de la respuesta cuya magnitud es mayor que la que se obtiene tras la administración de la primera dosis, evidenciándose el efecto booster en la respuesta.
Una dinámica similar se obtuvo empleando la vacuna humana vax-SPIRALÒ en este mismo modelo animal (27).
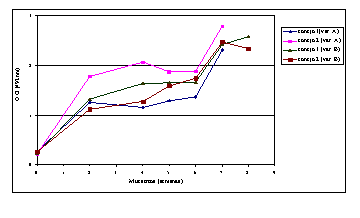 | 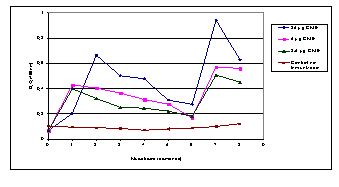 |
| Figura 2. Evaluación mediante ELISA de la respuesta humoral en hámsters inmunizados con CME (variante B) de L. mozdok.
|
En la Tabla 3 aparecen reflejados los resultados del estudio de protección de animales vacunados y controles, en los diferentes tiempos de reto. Estos resultados evidencian de 100% a un 80% de sobrevivencia de los animales vacunados con las dosis de 25 y 5 µg en comparación con un 100% de mortalidad en los controles no vacunados. Tras la administración de la primera dosis, el porcentaje de sobrevivencia de los animales disminuye con la concentración de CME al 80%. Este porcentaje se mantiene igual o superior al 80% en los animales retados a las 6 y 8 semanas, respectivamente; para las concentraciones de 25 y 5 µg de CME lo que habla de un mantenimiento de la magnitud de la respuesta capaz de neutralizar los microorganismos patógenos; demostrándose así la existencia de una protección específica establecida en los hámsters vacunados con la preparación de CME de la cepa homóloga. Resultados similares se obtuvieron cuando se realizó el reto con el serovar mozdok de hámsters, vacunados con vax-SPIRALÒ (compuesto por los serovares canicola, copenhageni y mozdok), que se logró un 100% de sobrevivencia (30).
Tabla 3. Resultados de la prueba de potencia de los hámsters inmunizados con preparaciones de los compomentes de membrana externa y retados en las semanas 2, 6 y 8 de iniciado el esquema de inmunización.
| Dosis de Vacuna | No. de animales | Tiempo de reto | Resultados | |
| % S | % M | |||
| 25 µg | 5 | 2 semanas | 100 | 0 |
| 5 | 6 semanas | 100 | 0 | |
| 5 | 8 semanas | 100 | 0 | |
| 5 µg | 5 | 2 semanas | 80 | 20 |
| 5* | 6 semanas | * | ||
| 5 | 8 semanas | 80 | 20 | |
| 2.5 µg | 5 | 2 semanas | 80 | 20 |
| 5* | 6 semanas | * | ||
| 5 | 8 semanas | 60 | 40 | |
| Controles no inmunizados | 5 5 5 | 2semanas 6 semanas 8 semanas | 0 0 0 | 100 100 100 |
Para la concentración de 2,5 µg solo se obtuvieron resultados satisfactorios (³ 80% de sobrevivencia) a las 2 semanas de aplicada la primera dosis.
El cálculo del número de DL50 que caracterizó el inóculo del ensayo de potencia arrojó un total de 20 000 DL50, lo cual está por encima de la dosis de reto establecida para la evaluación de variantes de vacuna (1). Esto nos hace pensar que si hubiéramos utilizado la mitad de la dosis de reto 10 000 DL50 se hubiera obtenido resultados satisfactorios también para la dosis de 2,5 µg.
Para el caso de la evaluación de la potencia en hámsters inmunizados pasivamente con el suero de conejos vacunados con las variantes A y B se partió de la mitad de la dosis de reto evaluada en el ensayo de potencia anterior. Los resultados obtenidos en este ensayo mostraron un 100% de sobrevivencia en los animales inmunizados pasivamente con el suero hiperinmune de ambas variantes, en contraste con un 100% de mortalidad en los animales controles (tanto los que recibieron por vía intraperitoneal el suero de conejo antes de la inmunización como los no inoculados). Se demostró además que la respuesta humoral arriba descrita (Figura 1 y Tabla 1) se caracterizó por la presencia de anticuerpos protectores, debido a que los animales inmunizados pasivamente con el suero hiperinmune de estos conejos fueron capaces de sobrevivir al reto con 10 000 DL50 de la cepa altamente virulenta del serovar mozdok.
Los resultados de las observaciones anatomopatológicas realizadas a los hámsters vacunados y retados 15 días después de la segunda dosis pueden observarse en la Tabla 4. Se evidencian alteraciones principalmente en el hígado de los animales que sobrevivieron al reto. Entre estas alteraciones podemos encontrar focos de necrosis con infiltrados inflamatorios y desorganización de los cordones hepáticos. Sin embargo no se pudo observar la presencia de Leptospira por la tinción de Walthym Starryn, la cual fue negativa en todos los casos.
Tabla 4. Resultados obtenidos en los estudios anatomopatólogicos y de aislamiento de Leptospira en animales inmunizados activamente y retados.
| Dosis de vacuna | Estudios anatomopatológicos | Aislamiento | ||||||||
| Macroscópico | Microscópico 200 x HE | Tinción de WS | ||||||||
| Hígado | Riñón | Hígado | Riñón | Hígado | Riñón | Hígado | Riñón | |||
| 25 µg | S.A.A | S.A.A | Focos de necrosis con infiltrado inflamatorio a predominio de células redondas focal pero situados en diferentes zonas del lobulillo. | S.A.A | - | - | - | + | ||
| 5 µg | S.A.A | S.A.A | Focos de necrosis con infiltración inflamatoria a predominio mono-nuclear. | Nefritis intersticial grave | - | - | - | + | ||
| 2,5 µg | S.A.A | S.A.A | Desorganización de los cordones y múltiples focos inflamatorios distribuidos en el parenquima for-mados por células redondas | S.A.A | - | - | - | + | ||
Por otra parte el ensayo de siembra de órganos mostró la presencia de Leptospira con buen crecimiento y buena viabilidad en los cultivos que contenían riñón de los hámsters que sobrevivieron al reto, lo que demuestra que a pesar de establecerse un nivel de protección calificado de satisfactorio para las dosis de 25 y 5 µg (80-100%), estas preparaciones no fueron capaces de eliminar el estado de portador. Es bueno señalar que la dosis de reto empleada en este ensayo de potencia estuvo muy por encima de la dosis que se reporta para la evaluación de preparados vacunales de Leptospira que corresponde con los 10–10 000 DL50 de la cepa de reto a utilizar por lo que podríamos inferir en este caso que la dosis de reto sobrepasó el umbral de inmunidad establecido en los animales inmunizados.
A diferencia de lo observado en el ensayo de prevalencia de Leptospira en órganos, para los animales que sobrevivieron al ensayo de potencia, los resultados de la siembra de órganos para los animales sobrevivientes al reto en el ensayo de inmunización pasiva, no mostraron presencia de Leptospiras en los cultivos, en contraste con lo observado para el caso de los controles no inmunizados, donde se apreció la presencia de 2 a 10 células por campo en 20 campos con un lente de 40x. Este resultado pone de manifiesto la eliminación del estado de portador, aspecto muy importante si tenemos en cuenta que algunas de las vacunas existentes actualmente no son capaces de eliminar la infección renal, convirtiendo a estos animales inmunizados en transmisores de la enfermedad.
Estos resultados corroboran la interpretación de lo planteado anteriormente acerca de que la prevalencia de Leptospira en los órganos de los hámsters retados en el ensayo de potencia antes descrito se debió a que la dosis de reto empleada sobrepasó el umbral de protección conferido por las dosis de antígenos inoculadas y no que la preparación evaluada no fuera capaz de inducir un nivel de protección suficiente para eliminar el estado de portador.
Conclusiones
Estos resultados permiten corroborar lo planteado en la literatura (2,18) en cuanto a que los CME, en los que se incluyen tanto LPS como proteínas de membrana externa, constituyen excelentes agentes inmunogénicos y protectogénicos capaces de prevenir la infección renal, lo que los convierten en excelentes candidatos para nuevas formulaciones vacunales de segunda generación contra la leptospirosis humana.
Referencias
1. WHO. Report of the Discussion of the WHO working group on leptospiral vaccine development and vaccinology. Nagoya. Japan, 1993.
2. Russell FB and Russell CJ. Immunogenicity and Humoral and Cell-mediated immune responses to leptospiral whole cell, outer envelope and protoplasmic cilinder vaccines in hamsters and dogs. Am J Vet. Res 1982; 43(5):835-840.
3. Chapman AJ, Everard COR, Faine S and Adler B. Antigens recognized by the human immune response to severe leptospirosis in Barbados. Epidemiol Infect 1991; 107:143-155.
4. Masuzawa T, et al. Protective activity of glycolipid antigen against infection by Leptospira interrogans serovar canicola. J Gen Microbiol 1990; 136(2):227-30.
5. Midwinter A, Faine S. and Adler B. Vaccination of mice with lipopolysaccharide (LPS) and LPS-derivated conjugates from Leptospira interrogans. J Med Microbiol 1990; 33(3):199-204.
6. De la Pena-Moctezuma A, DM. Bulach, and B Adler. Genetic differences among the LPS biosynthetic loci of serovars of Leptospira interrogans and Leptospira borgpetersenii. FEMS Immunol Med Microbiol 2001; 31:73-81.
7. Biswas D, Roy S, Vijachari P, Sugunan AP, Nararajaseenivasan K, Sehgal SC. Comparison of immunoreactive proteins of commonly circulating serogroups of Leptospira in Andaman Islands, India.Indian J Med Res 2005; 121:151-8.
8. Haake D A, Matsunaga J, Leptospiral membrane proteins- variation on a them? India. Indian J Med Res 2005.
9. Haake DA, Matsunaga J. Characterization of the leptospiral outer membrane and description of three novel leptospiral membrane proteins. Infect Immun 2002; 70(9):4936-45.
10. Branger C, C. Sonrier, B. Chatrenet, B. Klonjkowski, N. Ruvoen-Clouet, A. Aubert, G. Andre-Fontaine, and M. Eloit. Identification of the hemolysis-associated protein 1 as a cross-protective immunogen of Leptospira interrogans by adenovirus-mediated vaccination. Infect. Immun 2001; 69:6831-6838.
11. Hsieh WJ, Chang YF, Chen CS, Pan MJ. Omp52 is a growth-phase-regulated outer membrane protein of Leptospira santarosai serovar shermani. FEMS Microbiol Lett 2005; 243 (2):339-45.
12. Cullen PA, XU X, Matzunaga J, Sanches Y, Ko AI, Haake DA, et al. Surfaceome of Leptospira spp. Infect Immun 2005; 73(8):4853-63.
13. Flannery BD, Costa FP, Carvalho H, Guerreiro J., Matsunaga ED, Da Silva AG, et al. Evaluation of recombinant Leptospira antigen-based enzyme-linked immunosorbent assays for the serodiagnosis of leptospirosis. J Clin Microbiol 2001; 39:3303-3310.
14. Nally JE, Whitelegge JP, Aguilera R, Pereira MN, Blanco DR, Lovett MA. Purification and proteomic analysis of outer membrane vesicles from a clinical isolate of Leptospira interrogans serovar copenhageni. Proteomics 2005; 5(1):144-52.
15. Koizumi N, Watanabe H. Molecular cloning and characterization of a novel leptospiral lipoprotein with OmpA domain. FEMS Microbiol Lett 2003; 226 (2):215-9.
16. Cullen PA, Cordwell SJ, Bulach DM, Haake D A and Ben Adler. Global Analysis of Outer Membrane Proteins from Leptospira interrogans Serovar Lai. Infect Immun 2002; 70(5): 2311–2318.
17. Okuda M, Sakai Y, Matsuuchi M, Oikawa T, Watanabe M, Itamoto K et al. Enzyme-linked immunoabsorbent assay for the detection of canine Leptospira antibodies using recombinant OmpL1 protein. Vet Med Sci 2005; 67(3):249-54.
18. Russell FB and Russell CJ. Humoral immune response of cattle vaccinated with leptospiral pentavalent outer envelope and whole culture vaccine. Am J Vet Res 1978; 39(7):1109-1113.
19. Luo YH, Yan J, Mao YF, Li SP. Determination of the genus-specific antigens in outer membrane proteins from the strains of Leptospira interrogans and Leptospira biflexa with different virulence. Zhejiang Univ Sci 2004; 5 (4):462-6.
20. Gamberini M, Gomez RM, Atzingen MV, Martins EA, Vasconsellos SA, Romero EC et al. Whole-genome analysis of Leptospira interrogans to identify potencial vaccine candidates against leptospirosis. FEMS Microbiol Lett 2005; 244(2):305-13.
21. Koizumi N, Watanabe H. Identification of a novel antigen of pathogenic Leptospira spp. that reacted with convalescent mice sera. J Med Microbiol 2003; 52 (Pt7):585-9.
22. Glosser JW, Johnson RC, Sulzer CR, Auran NE. Immunogenic properties of a leptospiral outer envelope bacterin in hámsters and foxes. Amer J Vet Res 1974; 35(5):681-684.
23. Auran NE, Jonson RC, Ritzi DM. Isolation of the outer envelope of Leptospira and its immunogenic properties in hamsters. Infect Immu 1972; 65:968-975.
24. Nunes-Edward PL, Thierman AB, Bassford PJ and Stramam LV. Identification and characterization of the protein antigens of Leptospira interrogans serovar hardjo. Infect Immun 1985; 48:492-497.
25. Machado M, Naranjo M, González M, Medina R, Abreu E, Abreu J et al. Preliminary characterization of the antigen recognized by sera from vax-SPIRAL® vaccinees in outer membrana preparations of Leptopira Pomona serovar mozdoK 2006;Biotecnología Aplicada 23:34-49.
26. Lowry OH. Protein measurement with the folin phenol reagent. J Biol Chem 1951; 193:265.
27. Reed LJ and Muench H. A simple method of estimating fifty percent endpoints. Am J Hyg 1938; 27:493-497.
28. Oliva R. et al. Pathologic-Clinical characterization of Leptospirosis in a Golden Sirian Hamster Model. Archives of Medical Research 1994; 25(2):165-170.
29. Cole JR, Sulzer CR, Pursell AR. Improved microtechnique for the microscopic agglutination test. Appl Microb 1973; 5:65-69.
30. González M, Naranjo M, Rodríguez Y, Oliva R, Batista N, González I, Izquierdo L, Sierra G. Vacuna antileptospirósica trivalente adsorsobida para uso humano. Primer ensayo evaluativo de reactogenicidad e inmunogenicidad en un grupo de voluntarios adultos. VacciMonitor 1997; 6:12:2-10.
31. Abreu JC y Abreu ER. Purificación del LPS de Leptospira interrogans serovar mozdok.[Disertación.]Ciudad de la Habana. Instituto de Farmacia y Alimentos 1999.
32. González M et al. vax-SPIRAL, vacuna antileptospirósica trivalente (canicola, copenhageni y mozdok) para uso humano. Certificado de inscripción No. 1050, CEDMED. República de Cuba, Ministerio de Salud Pública. 1998, RM: 846/98.
Leptospira pomona serovar mozdok obtained by Sodium Dodecyl Sulfate (SDS) solubilization
Abstract
The outer membrane components (OMC) might be useful as potential vaccine candidates. In this study rabbits and hamsters were immunized with OMC preparations obtained by SDS solubilization and adsorbed onto Aluminium hydroxyde gel. A two- doses schedule was used with an interval between doses of six weeks The animals were inoculated by intramuscular route .Doses of 25, 5 and 2,5 µg were used for hamsters and 25 µg for rabbits. The humoral response was evaluated by microagglutination (MAT) test and enzyme-linked immunoabsorbent assay (ELISA). In addition, the protective effect of the immune response induced was evaluated by challenge of the inoculated hamsters against 20 000 DL50 of homologous high virulent strain and by passive immunization using rabbit’s sera obtained on week 8th against 10 000 DL50. Results showed immunogenic capacity of evaluated preparations which were able to protect all animals against challenge of homologous strain as well as to prevent renal infection and the establishment of leptospira in organs to avoid in this way carrier state in the case of hamsters passively immunized. The unvaccinated controls showed 100% of mortality and serious injuries in organs were observed.
Keywords: Leptospira, outer membrane proteins, OMP, immunogenicity and protection, lipopolysaccharide, LPS.
Recibido: Marzo de 2007 Aceptado: Junio de 2007














