Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Vaccimonitor
versión impresa ISSN 1025-028Xversión On-line ISSN 1025-0298
Vaccimonitor v.19 n.2 Ciudad de la Habana Mayo-ago. 2010
ARTICULOS DE REVISIÓN
Estrategia y resultados de la farmacovigilancia de vacunas desde el Instituto Finlay, 2009.
Strategy and results of vaccine pharmacosurveillance from Finlay Institute, 2009.
Iván E. Cuevas*
*Doctor en Medicina, Especialista de II grado en Epidemiología, Master en Salud Pública, Profesor Auxiliar Adjunto de la Escuela Nacional de Salud Pública, Universidad Médica de La Habana. Instituto Finlay. Centro de Investigación-Producción de Vacunas. Ave. 27 No. 19805, La Lisa, Ciudad de la Habana, Cuba. AP. 16017, CP11600. email:cuevas@finlay.edu.cu; ivancuevas@infomed.sld.cu
RESUMEN
El objetivo de este trabajo fue mostrar la estrategia y los resultados de la farmacovigilancia desde el Instituto Finlay, como titular de registros sanitarios. Se concretó la biografía de los productos en la etapa de poscomercialización y se examinó el balance riesgo/beneficio. Esto fue posible gracias a convenios con instituciones que permitieron el acceso a bases de datos digitales y auditables, donde se encontró la notificación espontánea de eventos adversos y el cumplimiento de las buenas prácticas, reglamentos y regulaciones de la autoridad reguladora. La minería de datos para la búsqueda de la agrupación de eventos raros e inesperados para un mismo lote o de accidentes, la confección de los informes periódicos de seguridad y la práctica sistemática para completar la información de seguridad solicitada en subpoblaciones y grupos especiales permitió actualizar el perfil de seguridad de las vacunas. Se confirmó que la vacuna antileptospirósica trivalente, la antitifoídica Vi y el toxoide tetánico, presentaron una frecuencia de eventos adversos menor de 0,1 reporte por cada 100.000 dosis administradas, mientras las demás vacunas tuvieron valores entre 1 y 10 por cada 10.000 vacunados. Entre el 80% y 95% de las notificaciones fueron relacionadas causalmente con la vacuna, y solo el 0,89% fueron de severidad grave, casi todas en niños menores de un año. Las manifestaciones generales fueron las que predominaron. Los resultados presentados muestran la importancia que tiene la farmacovigilancia desde la industria para obtener una valiosa información de la seguridad en la aplicación de las vacunas.
Palabras clave: Farmacovigilancia, vacunas, industria.
ABSTRACT
This paper aims at showing the strategy and the results of pharmacosurveillance at Finlay Institute, as owner of sanitary medical registries. The biography of products was consolidated in post-marketing stage and risk/benefit balance was examined. In our case, the spontaneous notification of adverse events and the compliance with good practices and rules/regulations of the regulatory authority was possible due to agreements with institutions that allowed the access to digital and auditable data bases. Data-mining search of the grouping of rare and unexpected events for a same lot or accidents, the preparation of periodic safety reports and the systematic practice to fill requested information on subpopulations and special groups, allowed updating the safety profile of vaccines. It was confirmed that the frequency of adverse events of trivalent Leptospirosis vaccine, the typhoid Vi vaccine and tetanus toxoid, was lower than 0.1 report per every 100 000 vaccinees, while the other vaccines showed values from 0.1 to 1 per 100 000 vaccinees. From 80% to 95% of the notifications were causally related to the vaccine, and only 0.89% was of serious severity, almost all of it in children younger than one year. General manifestations were predominant. Results showed the pertinence of industry pharmacosurveillance to obtain valuable safety information on vaccine administration.
Keywords: Pharmacosurveillance, vaccines, industry.
INTRODUCCION
El Instituto Finlay es una organización científica dedicada a la investigación y producción de vacunas humanas. Trabaja en la producción de vacunas clásicas, incluidas las del Programa Ampliado de Inmunizaciones (PAI). Es titular del Registro Médico Sanitario de las vacunas siguientes: toxoide tetánico para adultos (vax-TET®, 1980), antimeningocócica BC (VA-MENGOC-BC®, 1987), antileptospirósica trivalente (vax-SPIRAL®, 1998), antitifoídica de polisacárido Vi (vax-TyVi®, 2002), la antidiftérica-antitetánica-antipertussis (2004) y la toxoide diftérico y tetánico para menores de 10 años (VA-DIFTET®, 2004)(1).
Este es un centro con ciclo completo, pues además de dedicarse al desarrollo de nuevas vacunas, se ocupa de la distribución y venta de las mismas y asume la responsabilidad de la farmacovigilancia. Ello es parte de la tradición de la institución que desde su nacimiento, a partir de la necesidad de crear una vacuna antimeningocócica para abortar un brote epidémico de la enfermedad meningocócica invasiva al serogrupo B, ha estado acompañando a sus productos durante su aplicación en el sistema nacional de salud. Es definitivamente allí donde se completa la biografía de efectos beneficiosos (efectividad) y no deseables (eventos adversos), mediante abordajes propios de la fase IV (posregistro del producto).
En este trabajo nos propusimos mostrar los resultados más relevantes de la experiencia del Instituto Finlay en la farmacovigilancia de sus productos desde la industria.
¿Por qué es necesaria la farmacovigilancia de vacunas para los titulares de los registros médicos sanitarios?
Las instituciones productoras y comercializadoras de vacunas preventivas en Cuba, como es el caso del Instituto Finlay, que son titulares de los registros sanitarios de los productos, reciben de las autoridades reguladoras (Buró Regulatorio de Productos Sanitarios y Centro Estatal para el Control de la Calidad de los Medicamentos (CECMED), la aprobación para la aplicación de los productos y están obligados por ley a brindar una información sistemática y actualizada sobre la seguridad de los mismos, con licencia para su comercialización.
Es evidente que los grupos de profesionales dedicados a la farmacovigilancia están en la interfase entre los titulares de los registros sanitarios y los servicios de salud. Es allí donde se aplican las vacunas y tanto unos como otros requieren de las informaciones de efectividad y seguridad que estas generan por su uso.
En esa interconexión los servicios de farmacovigilancia son los máximos responsables de la protección de la salud de los usuarios y receptores de vacunas al poder detectar precozmente manifestaciones inesperadas que alterarían el balance riesgo-beneficio de la aplicación de un producto a la población, aún cuando los códigos, metodologías y disciplinas (investigación biomédica e investigación de servicios de salud) no sean las mismas.
La información de farmacovigilancia debe ser completada en forma de registros documentados en bases de datos que permitan sean auditables y pertinentes, que consientan la trazabilidad de la vigilancia poscomercialización y la renovación periódica de las licencias de distribución y el uso de esos productos.
Como en todos los países, en Cuba las empresas dedicadas a la producción, comercialización y distribución de medicamentos o de vacunas asumen las buenas prácticas en el desarrollo farmacéutico y clínico y cumplen con las normas ISO 9000 y el enfoque de calidad total con una atención centrada en el usuario final.
Existen numerosas evidencias del beneficio de la vacunación, tanto individualmente como en la comunidad. Ejemplos destacados son la erradicación de la viruela y la poliomielitis en la mayor parte del mundo. Sin embargo, ninguna vacuna es ciento por ciento segura o eficaz. Está demostrado que al aumentar la cobertura vacunal, la incidencia de enfermedades prevenibles por vacunación se reduce, pero se incrementan la ocurrencia de acontecimientos adversos que, a la vista de los padres, prestadores de atención médica y autoridades sanitarias, asumen una mayor preponderancia. (Figura 1)(2).
A diferencia de lo que sucede con medicamentos terapéuticos, el umbral de aceptación de los posibles riesgos por la utilización de vacunas es muy limitado. Cualquier problema de seguridad que surge podría repercutir en la detención de un programa de vacunación y la afectación de un número significativo de sujetos por la pérdida de la confianza de la población.
En vacunas, las consideraciones de seguridad difieren con la mayoría de los medicamentos. Son productos biológicos con una composición molecular compleja y una corta duración de exposición, con una respuesta a largo plazo que generalmente se administran a personas sanas y especialmente a niños pequeños en las edades vulnerables.
La confianza pública en los programas de vacunación sólo podrá ser mantenida si se garantiza que las autoridades sanitarias evalúen la seguridad de las vacunas de manera adecuada y adopten las medidas oportunas. Es decir, para avalar su calidad y las buenas prácticas en su administración, es muy importante una efectividad demostrada y su seguridad muy bien documentada.
¿Cuáles son las dificultades que pueden presentarse al intentar la farmacovigilancia de vacunas desde la industria?
En la práctica, muchos factores conspiran y se convierten en obstáculos para instaurar la farmacovigilancia desde la industria (3). Algunos autores consideran que la sobrevaloración de resultados de los estudios previos al registro, excesiva confianza por las autoridades reguladoras en los documentos presentados para el registro médico sanitario, poca cultura de notificación de eventos adversos, retroalimentación poco comprensible (4), diseños inadecuados, tamaños de muestras limitadas y la calidad de los datos (3); por otro lado, costos inadmisibles de los ensayos clínicos poslicenciamiento (5), el pobre entrenamiento en programas de computación diseñados para detectar señales a través de minería de datos (3), la necesidad de la evaluación clínica complementaria (6), la falta de experiencia para obtener un perfil daño-beneficio del medicamento y la percepción de que las reacciones adversas, son manifestaciones menores o irrelevantes y algunos de los escollos a superar (7).
¿Cómo se organiza la farmacovigilancia de vacunas desde la industria?
Con independencia de la información que deben tributar periódicamente a las autoridades reguladoras, las industrias de vacunas asumen un mayor nivel de responsabilidad por los productos, en especial si se trata de centros con el ciclo completo de investigación-desarrollo-producción, como es el caso de los centros del Polo Científico, y es un ejemplo de lo que significa el término "acompañamiento de los productos" (8, 9, 10, 11).
Visto desde el punto de vista jurídico-legal, las obligaciones que deben cumplirse para hacer funcionar la vigilancia poscomercialización están enmarcadas por los siguientes documentos del Centro para el Control Estatal de la Calidad de los Medicamentos (CECMED):
. Regulación No.16-2006: Directrices sobre Buenas Prácticas de fabricación de productos farmacéuticos.
. Resolución 4/07: Reglamento para la vigilancia de medicamentos de uso humano durante la comercialización.
. Regulación No.17-2008: Directrices para la investigación de los eventos adversos supuestamente atribuibles a la vacunación o inmunización (ESAVI).
. Regulación No.49-2007 Requisitos para la presentación de Informes Periódicos de Seguridad de medicamentos.
. Regulación No.51-2008: Requisitos para la comunicación expedita y periódica de reacciones, eventos adversos, intoxicaciones, defectos de calidad y actividad fraudulenta a medicamentos durante la comercialización.
En el Instituto Finlay estas obligaciones se cumplen a través diferentes procedimientos normalizados de operación (PNO) en los que están incluidas obligaciones y compromisos en el poslicenciamiento y se regulan las acciones a realizar, a saber:
- PNO 03-008. Tratamiento de Quejas y Reclamaciones.
- PNO 24-001. Procedimiento para la Captación y Análisis de las Opiniones de los Clientes acerca de los productos.
- PNO 24-005. Distribución y Control de Productos para el Mercado Nacional e Internacional.
- PNO 30-012. Monitoreo de la Ocurrencia de las Enfermedades Prevenibles por las Vacunas producidas por el Instituto Finlay.
- PNO 30-013. Farmacovigilancia (Modelo 33-36-1 del Ministerio de salud Pública, Farmacia "Notificación de Sospecha de reacción Adversa a Medicamentos por profesionales sanitarios").
- PNO 30-014. Investigación de Clusters de eventos adversos y fallos vacunales.
Como puede apreciarse, se trata de un escenario donde hay diferentes actores implicados: el vacunado y, en el caso de la vacunación pediátrica, sus padres o cuidadores; los profesionales sanitarios, los solicitantes/titulares de la autorización de comercialización, los patrocinadores de ensayos clínicos, los gerentes del sistema de salud relacionados con el programa de inmunizaciones y de la vigilancia de productos sanitarios y las autoridades de salud pública. Dependiendo de su responsabilidad cada actor tiene un papel importante en este proceso.
La salida final de la información de los resultados de la farmacovigilancia y la demostración documental de la fuente de los resultados en formatos digitales y documentos impresos, son las evidencias tangibles para el análisis científico de los expertos y la percepción pública de los riesgos.
¿Por qué la farmacovigilancia es parte del desarrollo clínico de las vacunas?
La información recolectada en las fases previas al Registro Médico Sanitario no basta para perfilar la seguridad de los medicamentos y las vacunas, pues proceden de muestras homogéneas y relativamente pequeñas y una selectiva recolección de datos en un tiempo limitado y fuera de la práctica clínica habitual (3, 12). La biografía de un producto se inicia con el registro y se concreta durante la fase IV del desarrollo del fármaco, en la cual se va ampliando progresivamente la población expuesta (12), lo que permite detectar eventos adversos raros no observados previamente y el efecto de interacciones o de condiciones clínicas coexistentes (13).
La existencia de diferencias en los resultados de los estudios clínicos previos al registro y los que se realizan luego que medicamentos y vacunas ya están en la práctica sanitaria habitual están referidas en diferentes fuentes (14) y obedecen a diferencias en el tamaño de muestras, los problemas a estudiar, las características de la población, la probabilidad de medicación concomitante, las dosis administradas, forma de uso, enfermedades y condiciones coexistentes.
Con esa información es posible estimar el valor esperado de reacciones adversas y predecir las manifestaciones posibles en caso de que una vacuna sea utilizada en grupos con características especiales (15, 16).
¿Cuál ha sido la estrategia para implementar la farmacovigilancia de vacunas desde el Instituto Finlay?
El Instituto Finlay se apoya en el estado del arte para garantizar las buenas prácticas, la búsqueda de alianzas para acceder a la información y cumplir con las indicaciones de la autoridad reguladora y los procedimientos normados por el sistema de calidad de la institución.
La gerencia de los sistemas de vigilancia está en manos de las autoridades sanitarias y no en la industria farmacéutica. Por ello, para poder cumplir con los objetivos de la vigilancia poscomercialización, la industria farmacéutica requiere de un intercambio fluido de informaciones con las autoridades sanitarias y las agencias reguladoras de medicamentos (5).
Se observó el impacto de las vacunas en la población, con el objetivo de emprender las acciones que permitan mantener la relación riesgo-beneficio de estos productos. Sólo accediendo a la información desde diversas fuentes es posible cuantificar los valores esperados y prever las contraindicaciones en grupos especiales, o bien limitar su indicación a grupos especiales (17).
Por ello en 2003 se firmó un convenio con la Unidad Coordinadora Nacional de la Farmacovigilancia (UCNFv): para participar en proyectos ramales de farmacovigilancia, realizar estudios observacionales en atención primaria y secundaria, y diseño y aplicación de ensayos fase IV para evaluar la efectividad y seguridad de las vacunas.
Los diseños fundamentales para los estudios poscomercialización son observacionales y se obtienen desde la práctica sanitaria y clínica.
La experiencia de trabajo en el Instituto Finlay mostró la utilidad de establecer convenios con instituciones que dentro del Ministerio de Salud Pública nos permitieron:
1.- La investigación de eventos adversos raros e inesperados.
2.- Detectar aumentos en la incidencia de reacciones adversas conocidas.
3.- El análisis cuidadoso de las quejas y consultas médicas realizadas.
Mantener una colaboración con la Unidad Coordinadora Nacional de la Farmacovigilancia garantiza que la información se obtenga totalmente procesada de una fuente independiente, de profesionales donde se asegura que no existen conflictos de intereses, lo cual le confiere una gran valía, por la experiencia y extensión de ese subsistema de vigilancia.
La notificación espontánea de eventos adversos es considerada la fuente más importante y más utilizada en el poslicenciamiento, ya que nos permite obtener información de la seguridad vacunal de toda la población al mismo tiempo, a partir del uso continuado de esos productos en el servicio de salud, y la detección de reacciones adversas raras a medicamentos (RAM), o de baja frecuencia de exposición. Toma en cuenta todos los acontecimientos médicos después de la administración de vacunas, incluso aquellos que fueran considerados como leves (18, 19, 20).
¿Que procedimientos fueron empleados para cuantificar la información?
Se considera como evento o experiencia adversa por definición a cualquier acontecimiento médico inconveniente que se presente durante el tratamiento con un medicamento o vacuna, el cual no tiene necesariamente una relación causal con este tratamiento.
Esa definición permite la observación de acontecimientos adversos especiales, como las reacciones adversas eventos no esperados (tipo B). Su detección a través de fuentes diversas facilita una posterior evaluación clínica y detección de señales. Estas fuentes son: reporte espontáneo, artículos publicados, búsqueda de casos entre ingresos hospitalarios, estudios analíticos observacionales (de caso-control y de cohorte), estudios correlacionales de modificaciones en la mortalidad ante cambios en prescripción o uso con ciertos medicamentos, y ensayos clínicos fase IV de los productos. Cada uno de estos tipos de estudios con sus ventajas y sus desventajas (20, 21).
Aunque el sistema de reporte espontáneo no permite por sí mismo medir el riesgo, sin embargo, es sencillo, sensible, de bajo costo y fácil extensión nacionalmente, y permite la confección de bases de datos para la búsqueda de un nuevo conocimiento (minería de datos), donde se descubran nuevas señales, que por su gran importancia en la sospecha de reacciones adversas; se ha convertido en el sistema universalmente más aceptado en la farmacovigilancia (21).
Las pautas de armonización internacionales sugieren la necesidad de instaurar la transmisión electrónica de reportes de casos entre todas las partes (fabricantes, direcciones sanitarias y agencias reguladoras) y la conformación de bases de datos para lograr una mejor retroalimentación del sistema de farmacovigilancia. Ello constituye el real y actual desafío de la farmacoepidemiología (5, 12).
El sistema de farmacovigilancia del Instituto Finlay, cuyos clientes esenciales son los usuarios de sus vacunas y las autoridades sanitarias, tiene toda su información en bases de datos digitales desde el año 2003, lo cual le confiere consistencia a la información brindada y muestra la madurez de ese sistema de recolección de datos.
La red nacional que provee esos datos está formada por 176 centros municipales de farmacoepidemiología, que envía de forma sistemática notificaciones de eventos adversos en formato digital o electrónico a la Unidad Coordinadora Nacional de la Farmacovigilancia (UCNFv).
En el seguimiento de los eventos adversos de nuestras vacunas se realizan sistemáticamente dos aproximaciones: una mensual y otra anual. La primera, para profundizar en los casos graves que se puedan presentar en la búsqueda de agrupación de eventos para un mismo lote y de accidentes por la utilización de vacunas no indicadas en el Esquema Nacional de Inmunización. Este análisis desencadena investigaciones complementarias para profundizar en la relación causal y la clasificación epidemiológica (22). En el caso de que fuera relacionado causalmente con la vacuna, su análisis entra como si fuera una queja, en la búsqueda de la raíz del problema para la toma de acciones preventivas y correctivas (23).
La segunda, resume toda la información acumulada desde el año 2003 para la confección de los informes periódicos de seguridad y actualiza el perfil de seguridad de las vacunas, o sea, estima cuales serán los diagnósticos esperados en los informes mensuales subsecuentes.
La elaboración de informes periódicos de seguridad que solicitan las autoridades reguladoras (24) y la atención a quejas se convierten en la principal evidencia documentada de las salidas de la farmacovigilancia y a su vez, constituye su una herramienta desde la industria.
La frecuencia por dosis de vacunas administradas se estima mediante el cálculo puntual de reportes y eventos adversos por 100.000 dosis administradas de vacunas y el cálculo del Intervalo de Confianza al 95%, para ver la clasificación de frecuencia (25). Se consideraron todos los diagnósticos (síntomas y signos) individuales como eventos adversos incluidos dentro de cada reporte de la base de datos de los años 2003 al 2008.
La valoración de causalidad se analiza por los profesionales que forman parte de la red de farmacovigilancia que coordina la UCNFv, a partir de las definiciones de las normas y procedimientos del 2006 de la UCNFv (26). Los eventos relacionados causalmente son aquellos con la denominación de definitiva, probable y posible, mientras los demás son no relacionados.
El resultado de la severidad de los eventos se realiza de acuerdo con el fijado en las Normas de la UCNFv (27): leve, moderado o grave.
Se calcula la proporción de diagnósticos locales y manifestaciones sistémicas, así como los eventos adversos en frecuencias absolutas mayores de tres y su proporción entre el total de diagnósticos detectados.
Se realiza el cálculo de los eventos adversos con mayor asociación estadística, las cuales reciben el calificativo de señales por algunos autores a partir del análisis de disproporcionalidad de los grupos y la combinación evento adverso/vacuna de todos los diagnósticos en reportes de eventos a todos los registros del grupo farmacológico de vacunas (presentes en la tabla Excel) y la obtención de las combinaciones con mayor asociación estadística a partir del cálculo de la razón de riesgo proporcional (PRR), la razón diferencial de riesgo (ROR) y el valor P, mediante el programa Statcalc de EpiInfo. Para ello se consideraron solo los diagnósticos con frecuencias absolutas mayores de cuatro, y fueron seleccionados los resultados que resultara con un PRR y ROR, cuyo Intervalo de Confianza al 95% tenía límite inferior mayor de 2 (Tabla 1). (28-32).
* PRR (Razón de Riesgo Proporcional); ** ROR (Razón Diferencial de Riesgos)
El cálculo de los límites del Intervalo de Confianza al 95% (IC 95%) de PRR y ROR se calculó mediante el programa Statcalc, basado en el algoritmo de Mehta, Patel y Gray (33).
El programa WinPepi se utilizó para el cálculo de la frecuencia de eventos adversos (expresado en tasa por 100.000 dosis) y el Intervalo de Confianza al 95% (32).
¿Cuáles son los resultados obtenidos en el Instituto Finlay?
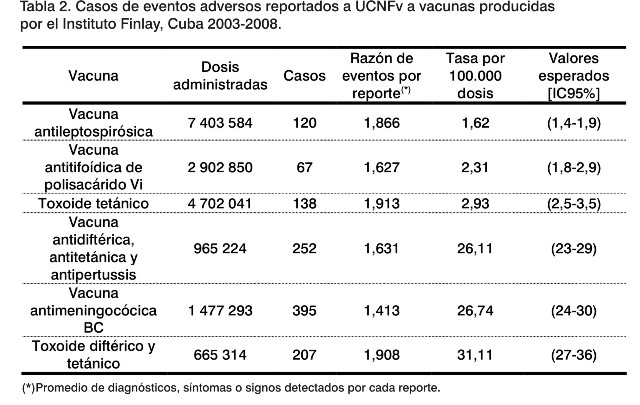
Las vacunas del Instituto Finlay tienen en común que son contra agentes bacterianos. Entre ellas hay bacterinas (vacuna antileptospirósica trivalente y componente pertussis de vacuna antidiftérica, antitetánica y antipertussis), toxoides (toxoide tetánico y toxoide diftérico y tetánico para uso pediátrico); las de polisacáridos (antitifoídica de polisacárido Vi y componente de polisacárido de serogrupo C de vacuna antimeningocócica BC) y las de subunidades (vesícula de membrana externa de Neisseria meningitidis del serogrupo B de la vacuna antimeningocócica BC). Comprender esto es importante cuando se comparan las tasas de reportes de eventos adversos por cada 100.000 vacunados (Tabla 2).
Se pudo apreciar que las tres primeras vacunas (antileptospirósica, antitifoídica Vi y toxoide tetánico) presentan una frecuencia de eventos adversos calificada como muy raros (menos de 0,1 reporte por cada 100.000 personas vacunadas). Las demás (antidiftérica-antitetánica-antipertussis, antimeningocócica BC y toxoides diftérico y tetánico) tuvieron una frecuencia que las califica como vacunas con eventos adversos raros (valor mayor de 0,1 y menor de 1 cada 100.000 vacunados) (25).
El análisis de causalidad es realizado por los expertos de la red de la Unidad Coordinadores de la Farmacovigilancia (Tabla 3). De esa información se obtuvo que valores cercanos o superiores al 95% de las notificaciones (exceptuando la vacuna antitifoídica Vi (80,59%) fueron relacionados causalmente con la vacuna.
De los casos relacionados (Tabla 4) predominaron los casos leves. Las vacunas menos reactogénicas fueron las que mostraron menor severidad (Tabla 3). El 90% de las notificaciones graves fueron en menores de un año, concentradas en vacunas con componente pertussis y con subunidades de vesícula de membrana externa de Neisseria meningitidis. Los casos graves tuvieron una recuperación completa.
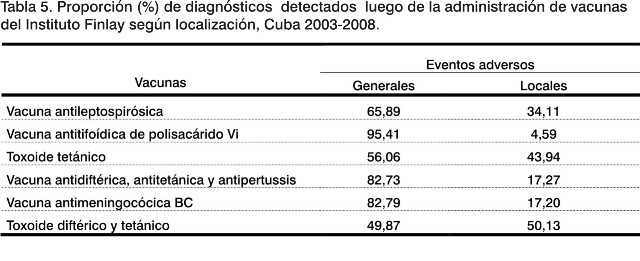
Referido a la proporción en la cual se presentan eventos adversos de manifestación local y general, se observa que exceptuando las vacunas que son constituidas solo por toxoides (toxoide tetánico y toxoides diftérico y tetánico); las manifestaciones generales son las que predominan en una cuantía diversa (Tabla 5).
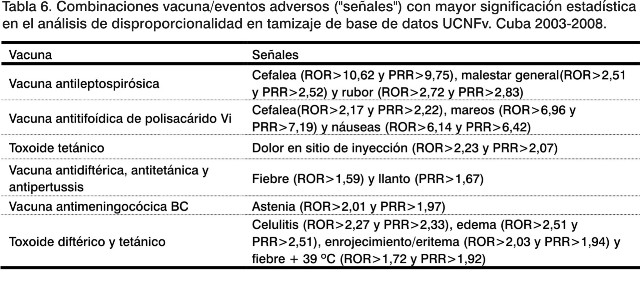
Las manifestaciones (síntomas y signos) que muestran un valor de PRR o ROR con un valor cercano o superior de 2 en el límite del Intervalo de Confianza 95% son las que se muestran en Tabla 6.
Las manifestaciones que reciben el calificativo de "señales" son reacciones adversas, descritas en los registros sanitarios y prospectos de cada vacuna, consideradas durante el uso sistemático en los servicios de salud como manifestaciones esperadas, a las cuales se les debe prestar mayor importancia cuando los valores proporcionales de estas se incrementen entre el total de manifestaciones detectadas para cada vacuna.
CONCLUSIONES
Ante los desafíos de nuevas enfermedades y la reemergencia de algunas, el fortalecimiento de la farmacovigilancia permitirá a los titulares de los registros médicos sanitarios para las nuevas vacunas acortar los plazos de aprobación por la seguridad que aportan los sistemas de vigilancia poscomercialización.
El incremento de nuevos productos farmacéuticos en Cuba y en otras regiones del mundo es una motivación adicional para completar la información de seguridad de los productos en la fase IV del desarrollo farmacéutico. La estrategia del Instituto Finlay en el enfoque poscomercialización desde la industria, donde se incluyen todos los factores y condiciones que pueden incidir en los efectos no deseados, es una herramienta valiosa para obtener una mejor evaluación de la seguridad en la aplicación de vacunas.
REFERENCIAS
1. Instituto Finlay, Cartera de productos. Disponible en: http://www.finlay.sld.cu/ [Accedido por última vez: 22 marzo 2010].
2. Cuevas I, Jiménez G, Peña MA, Ávila J González BE. Resultado de la farmacovigilancia de vacunas producidas por el Instituto Finlay. Rev Cubana Farm 2007;41(3):Disponible en:http://scielo.sld.cu/scielo.php?script= sci_arttext&pid=S0034-75152007000300004&lng=en&nrm=iso&tlng=es,[Accedido por última vez: 4 de mayo de 2010].
3. International Society of Drug Bulletins EU: Berlin Declaration on Pharmacovigilance; January 2005:1-28. Disponible en: http://www.icf.uab.es/informacion/boletines/ISDB/Declaration.pdf [Accedido por última vez: 15 de junio de 2009].
4. Bates DW, Evans RS, Murff H, Stetson PD, Pizziferri L, Hripcsak G: Detecting adverse events using information technology. J Am Med Inform Ass 2003; 10:115-28.
5. Talbot JC, Nilsson BS. Pharmacovigilance in the pharmaceutical industry. British Journal of Clinical Pharmacology 1998;45:427-31.
6. Hauben M. Early Postmarketing Drug Safety Surveillance: Data Mining Points to Consider. Ann Pharmacother. 2004;38(10):1625-30.
7. Cuevas I. La farmacovigilancia en la Industria Farmacéutica. VacciMonitor 2007, 16(1): 23-8.
8. Quintana I, Sotolongo F, Llop A, Cuevas I, Martínez N, Velásquez JC, et al. Programa Nacional de Prevención y Control de Síndromes Neurológicos Infecciosos. Ciudad de La Habana: Ministerio de Salud Pública, Dirección Nacional de Epidemiología; 1999.
9. Camaraza MA, Ochoa R, Arnet AG, Sotolongo F, Martínez I, Cuevas I. Assessment of immune response against C11 (ATCC)
strain induced by Cuban meningoccocal vaccine (VA-MENGOC-BC®) in adolescents of Ciego de Avila, Cuba. En: Proceedings of 13th International Pathogenic Neisseria Conference, Sept.1-6. Oslo, Norway: Norwegian Institute of Public Health; 2002.
10. Camaraza MA, Ochoa R, Sotolongo F, Martínez I, Cuevas I. Inmunogenicidad inducida por la vacuna antimeningocócica VAMENGOC-BC® contra la cepa de N. meningitidis ATCC C11 en adolescentes, después de 12 años de vacunados. Rev Cubana Med Trop 2004;56(1):26-30.
11. Gibson B, Product Stewardship in the Chemical Industry. ATSE Focus 1997 (98) Disponible en: http://www.atse.org.au/index.php?sectionid=372, [Accedido por última vez: 12 de julio 2006].
12. The Uppsala Monitoring Centre, WHO Collaborating Centre for International Drug Monitoring. Safety monitoring of medicinal products. Geneva: WHO; 2000.
13. Dainesi SM. Pharmacovigilance. More Than Ever, an overall responsibility. Clinics 2005;60:267-70.
14. Sasich LD, Lurie P, Wolfe SM. The Drug Industry's performance in finishing post-marketing research (Phase IV) studies. April 13,2000.Disponible en:http://www.citizen.org/publications/release.cfm?ID=6721&secID=1666&catID=126,[Accedido por última vez: 27 enero 2010].
15. Waller PC, Evans SJW. A model for the future conduct of pharmacovigilance. Pharmacoepidemiology and Drug Safety 2003; 12:17-29.
16. Adis Data Information BV. Reducing medication errors requires a multifactorial approach. Drugs & Therapy Perspectives, August 2004; 20 (8): 22-26.
17. WHO. Immunization safety surveillance: Guidelines for managers of immunization programmes on reporting and investigating adverse events following immunization. Immunization Focus: WHO Regional Office for the Western Pacific. Manila: WHO; 1999.
18. Autret-Leca E, Jonville-Béra AP, Beau-Salinas F. Pharmacovigilance des vaccins. La Revue du Practicien. 2004;54:526-31.
19. WHO. Global programme for vaccines and immunization: Expanded Programme on Immunization. Surveillance of adverse events following immunization (WPRO/EPI/99.01). Manila: World Health Organization Western Pacific Regional Office; 1999.
20. Ministerio de Salud Pública, Centro para el Desarrollo de la Farmacoepidemiología. Normas y Procedimientos de Trabajo del Sistema Cubano de Farmacovigilancia. Unidad Coordinadora Nacional de Farmacovigilancia. Disponible en: http://www.cdf.sld.cu/fv/NormasyProcedimientos2006.htm, [Accedido por última vez: 27 diciembre 2009].
21. Lazarou J, Pomeranz BH, Corey PN: Incidence of adverse drug reactions in hospitalized patients: a metaanalysis of prospective studies. JAMA 1998; 279:1200-5.
22. CECMED. Regulación No.17-2008: Directrices para la investigación de los eventos adversos supuestamente atribuibles a la vacunación o inmunización (ESAVI). Ciudad de La Habana: CECMED; 2008.
23. Instituto Finlay. Procedimiento Normalizado de Operaciones # 03-008 "Tratamiento de Quejas y Reclamaciones". Ciudad de La Habana: Instituto Finlay; 2006
24. Klepper MJ. The Periodic Safety Update Report as a Pharmacovigilance Tool. Drug Safety 2004; 27: 569-78.
25. Department of Immunization, Vaccines and Biologicals. Adverse Events Following Immunization (AEFI): Causality assessment, 2005. Disponible en: http://www.who.int/vaccines-documents/DocsPDF05/815.pdf [Accedido por última vez: 25 diciembre 2009].
26. Medawar C, Hardon A, Herxheimer A. Depressing research. Lancet 2003; 363:2087-9.
27. Ministerio de Salud Pública, Centro para el Desarrollo de la Farmacoepidemiología. "Normas y Procedimientos de Trabajo del Sistema Cubano de Farmacovigilancia". Unidad Coordinadora Nacional de Farmacovigilancia. Disponible en: http://www.cdf.sld.cu/fv/NormasyProcedimientos2006.htm [Accedido por última vez: 27 diciembre 2009].
28. Hauben M, Zhou X. Quantitative Methods in Pharmacovigilance. Focus on Signal Detection. Drug Safety 2003;26:159-86.
29. Evans SJW, Waller PC, Davis S. Use of proportional reporting ratios for signal generation from spontaneous adverse drug reaction reports. Pharmacoepidemiology and Drug Safety 2001;10:483-6.
30. van Puijenbroek EP, Bate A, Leufkens HGM, Lindquist M, Orre R and Egberts ACG. A comparison of measures of disproportionality for signal detection in spontaneus reporting systems for adverse drug reactions. Pharmaco-epidemiology and Drug Safety 2002;11:3-10.
31. Moore N, Thiessard F, Begaud B. The history of disproportionality measures (reporting odds ratio, proportional reporting rates) in spontaneous reporting of adverse drug reactions. Pharmacoepidemiology and Drug Safety 2005;14:285_86.
32. Abramson JH. WINPEPI (PEPI-for-Windows): Computer programs for epidemiologist. Epidemiologic Perspectives & Innovations, 2004;1(1): 6.Disponible en: http://www.epi-perspectives.com/content/1/1/6 [Accedido por última vez; 27 diciembre 2009].
33. Mehta CR, Patel NR, Gray R. Computing an exact confidence interval for the common odds ratio in several 2X2 contingency tables. J Am Statistical Assoc 1985;80:969-73.
Recibido: Febrero de 2010
Aceptado: Abril de 2010