Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Vaccimonitor
versión On-line ISSN 1025-0298
Vaccimonitor v.19 n.3 Ciudad de la Habana sep.-dic. 2010
ARTICULOS ORIGINALES
Perfil de seguridad de la vacuna antileptospirósica trivalente vax-SPIRAL®.
Safety profile of the trivalent leptospirosis vaccine vax-SPIRAL®
Giset Jiménez1*, Iván E. Cuevas 2**
1. Unidad Coordinadora Nacional de la Farmacovigilancia, Centro para el Desarrollo de la Farmacoepidemiología. Calle 44 No. 502, Miramar, CP 11300, La Habana. Cuba.
2. Instituto Finlay, Centro de Investigación-Producción de Vacunas. Ave. 27 No. 19805. La Coronela, La Lisa; AP 16017, CP 11600, La Habana. Cuba.email:cuevas@finlay.edu.cu
* Doctor en Medicina, Especialista de II grado en Farmacología, Máster en Economía de la Salud, Profesor Auxiliar de la Escuela Nacional de Salud Pública, Universidad Médica de La Habana.
** Doctor en Medicina, Especialista de II grado en Epidemiología, Máster en Salud Pública, Profesor Auxiliar de la Escuela Nacional de Salud Pública, Universidad Médica de La Habana.
RESUMEN
Con el objetivo de mostrar el perfil de seguridad de la vacuna antileptospirósica cubana, vax-SPIRAL®, se realizó un estudio observacional descriptivo y transversal, a partir de la base de datos de la red nacional de farmacovigilancia a medicamentos. Se estimó la frecuencia de reportes por dosis de vacunas administradas, la valoración de causalidad, severidad, localización y los eventos adversos con mayor asociación estadística, a partir del cálculo de disproporcionalidad de las combinaciones de eventos adversos a vacunas de todos los diagnósticos en los reportes de eventos del grupo farmacológico de vacunas y el cálculo de la Razón de Riesgo Proporcional (PRR) y la Razón Diferencial de Riesgo (ROR). Hubo 1,62 reportes por 100 000 dosis administradas y 1,9 diagnósticos por reporte en personas entre 18 y 77 años de edad y una media ±DE de 40 ± 13 años, con predominio del sexo femenino (65,54%). No se reportaron casos graves; el 74,17% fueron con severidad leve y el 66,96% fueron manifestaciones adversas sistémicas. El 94,17% de los reportes estuvieron relacionados con la vacuna. Los eventos adversos más frecuentes fueron: fiebre/hipertermia (18,75%), cefalea (14,73%), dolor local (13,84%), enrojecimiento/eritema/rubor en el sitio de inyección (12,05%), malestar general (8,48%) y manifestaciones de hipersensibilidad mínimas, sólo a nivel cutáneo. Entre los que mostraron mayor asociación: cefalea, malestar general y rubor. Los resultados obtenidos son similares y con mejor perfil de seguridad que los de la vacuna francesa SPIROLEPT, por lo cual se recomienda para la protección en grupos de riesgo de leptospirosis.
Palabras clave: Vacuna leptospirósica, seguridad vacunal, farmacovigilancia.
ABSTRACT
A cross-sectional descriptive study was performed to show the safety profile of the leptospirosis vaccine vax-SPIRAL®, based on the database of the drug pharmacosurveillance national net. The frequency of reports of the administered-vaccine doses was estimated as well as the assessment of causality, severity, location and adverse events with greater statistical association from the calculation of disproportional combinations of adverse events/vaccinations of all diagnoses in reports of events of vaccines pharmacological group by the calculation of the Proportional Risk Ratio (PRR) and the Reporting Odds Ratio (ROR). There were 1.62 reports per 100 000 doses administered and 1.9 diagnoses for individual report of adverse events in people from 18-77 years of age, and a mean ± SD of 40 ± 13 years (range 27-53 years) being female the predominant sex (65.54%). There were no serious cases, and 74.17% were reported with mild severity. The 94.17% of reports were related to the vaccine while 66.97% were systemic adverse events. The most common diagnoses were fever/hyperthermia (18.75%), headache (14.73%), local pain (13.84%), redness/erythema at the site of injection/flushing (12.05%) and general malaise (8.48%). Hypersensitivity manifestations were minimum and only at skin level. The events that showed greater statistical association were headache, malaise and flushing. The results obtained were similar and better than the safety profile of the French vaccine SPIROLEPT. The acceptable safety profile of vax-SPIRAL® makes it suitable for the protection of Leptospirosis risk groups.
Keywords: Leptospirosis vaccine, Vaccine safety, Pharmacosurveillance.
INTRODUCCIÓN
Todo proveedor de vacunas debe procurar que estas sean seguras y estar preparado para atender cualquier preocupación sobre su inocuidad, tales como algunas manifestaciones adversas observadas durante su desarrollo clínico (1). La mayoría de las no conocidas solo se detectan luego del registro del medicamento.
La inocuidad y eficacia de las vacunas que se demuestran antes de la concesión de la licencia se realizan en fases y condiciones controladas para cumplir con los requerimientos del registro sanitario (1).
Después de concedida la licencia, sólo los estudios de seguimiento (vigilancia posmercadeo) proporcionan información sobre la efectividad y manifestaciones adversas, datos que de comunicarse adecuadamente pueden agregar valiosos conocimientos al perfil de seguridad de la vacuna (1).
La notificación o reporte de eventos adversos de forma pasiva es la fuente de información de seguridad vacunal poslicenciamiento más importante y más utilizada. En condiciones reales permite obtener información a toda la población al mismo tiempo, a partir del uso continuado de esos productos en el servicio de salud y la detección de reacciones adversas raras o de baja frecuencia de exposición. La misma tiene en cuenta todos los acontecimientos médicos, después de la administración de los medicamentos y vacunas, incluso aquellos que fueran considerados como leves (2,3).
En Cuba, esto está garantizado por una red nacional de farmacovigilancia de medicamentos y biológicos formada por 176 centros municipales de farmacoepidemiología y 15 centros provinciales, que envían de forma sistemática notificaciones de eventos adversos en formato de fichero Excel a la Unidad Coordinadora Nacional de la Farmacovigilancia (UCNFv). La misma coordina la actividad de los centros provinciales de farmacovigilancia, unifica criterios sobre el método de trabajo y presta el debido soporte en lo que respecta a la codificación, tratamiento, emisión y evaluación de información sobre sospechas de reacciones adversas a medicamentos, administra la base de datos nacional, recibe, valora, procesa y emite información sobre sospechas de reacción adversa medicamentosa (RAM) o cualquier otro problema relacionado con su eficacia durante su aplicación clínica, así como realiza y coordina estudios científicos sobre la seguridad de los medicamentos y elabora informes para las autoridades sanitarias y sistema de salud (4).
La existencia del sistema de farmacovigilancia cubano permite que la información sobre sospechas de reacciones adversas a vacunas sean enviadas a las industrias de vacunas del país y se retroalimente a las instituciones y profesionales sanitarios periódicamente (4).
La vacuna antileptospirósica trivalente vax-SPIRAL® fue registrada en Cuba en 1998 y obtuvo el registro médico sanitario en siete países de Las Américas, entre el 2004 y el 2009: Colombia, República Dominicana, Guatemala, Nicaragua, Perú, Argentina y Costa Rica (5).
Durante el ensayo clínico fase III se mostró una eficacia serovar específica de 78,1% y del 60,4% para todos los serovares diagnosticados y ausencia de reacciones adversas graves (6).
Es una vacuna trivalente en solución inyectable que se administra por vía intramuscular en dos dosis de 0,5 mL cada una, separadas por un intervalo óptimo entre 6-8 semanas, y contiene una suspensión de células enteras de Leptospira interrogans perteneciente a los serogrupos Canicola serovar canicola, Icterohaemorrhagiae serovar copenhageni y Pomona serovar mozdok, inactivadas con formaldehído, adsorbidas en gel de hidróxido de aluminio, al que se le añade 0,01% de tiomersal como agente de preservación (5).
Está recomendada para la aplicación en personas a partir de los 15 años de edad, con riesgo de adquirir la enfermedad: trabajadores de arrozales, cañeros, granjeros, trabajadores de alcantarillados, mineros, veterinarios, criadores de animales, empleados de mataderos, trabajadores de establecimientos piscícolas y militares; también en personas expuestas a aguas contaminadas por orina de animales domésticos y salvajes, bañistas y personas que acampan al aire libre en zonas infectadas o que habitan en zonas consideradas de riesgo por la asociación de elementos como: infestación de roedores, suelo húmedo e historia de morbilidad. Adicionalmente se recomienda su uso ante la convivencia con animales domésticos o afectivos que son reservorios de la enfermedad (5).
La vacuna vax-SPIRAL® es parecida a la vacuna monovalente fabricada por Thea Laboratorios (Clermont-Ferrand, Francia) (7). Ambas son de las pocas disponibles para la inmunoprofilaxis de la enfermedad de leptospirosis en humanos (8).
Ante todas las vacunas antileptospirósicas han existido aprensiones referidas al perfil de seguridad: algunos autores señalan que tiene un inaceptable perfil de efectos locales, además del riesgo teórico potencial de que las bacterias inactivadas induzcan una enfermedad autoinmune tal como uveítis (9). Es por ello cardinal mostrar el perfil de seguridad de la vacuna antileptospirósica cubana después de 10 años de su introducción en los servicios de salud, siendo el objetivo de este artículo.
MATERIALES Y MÉTODOS
Se realizó un estudio observacional descriptivo y transversal de farmacovigilancia con datos de eventos adversos procedentes de la UCNFv, que estaban disponibles en base de datos digital (formato Excel) desde 2003-2008.
Se estimó la frecuencia de casos de eventos adversos por dosis de vacunas administradas mediante el cálculo total de reportes de eventos adversos por 100 000 dosis administradas de vacunas y el cálculo del intervalo de confianza al 95% para la clasificación de frecuencia (10). Esto se hace a partir del cálculo del 80% de las dosis vendidas, pues al no estar incluida en el esquema de inmunización, las dosis no son informadas en el Anuario Estadístico. Fueron incluidos todos los diagnósticos (síntomas y signos) individuales como eventos adversos comprendidos dentro de cada reporte. Se calculó la proporción de diagnósticos contra el total de manifestaciones, expresado en por ciento.
La valoración de causalidad fue realizada por los profesionales que forman parte de la red de farmacovigilancia que coordina la UCNFv, a partir de las definiciones de las normas y procedimientos del sistema cubano de farmacovigilancia, 2006 (3). Los eventos relacionados causalmente son aquellos con la denominación de definitiva, probable, posible, mientras los demás son no relacionados.
El resultado de la severidad de los eventos fue de leve, moderado o grave, de acuerdo con lo fijado en Normas y Procedimientos de la UCNFv (3).
Se muestreó la proporción de diagnósticos locales y manifestaciones sistémicas, así como los eventos adversos en frecuencias absolutas mayores de tres y su proporción entre el total de diagnósticos detectados.
Utilizando las herramientas de trabajo de la farmacovigilancia se calculó la posible asociación estadística entre un evento adverso y un medicamento o biológico, previamente desconocida o incompletamente conocida. Para hacer este cálculo se acepta que sean a partir de tres reportes. Los diagnósticos que cumplen con esa característica reciben el nombre de señal, y todo depende de la seriedad del evento y la calidad de la base de datos (11, 12).
Ese cálculo recibe la denominación de análisis de disproporcionalidad de combinaciones de eventos adversos/vacunas de todos los diagnósticos. Se distribuyen en una tabla de contingencia las manifestaciones correspondientes a todas las vacunas presentes en la base de datos de la UCNFv pertenecientes al grupo farmacológico de vacunas y la obtención de las combinaciones estadísticamente diferentes, a partir del cálculo de la razón de riesgo proporcional (PRR) y la razón diferencial de riesgo (ROR), mediante el programa Statcalc de EpiInfo. Para ello se consideraron sólo los diagnósticos con frecuencias mayores de 3, y fueron seleccionados los resultados cuyo Intervalo de Confianza al 95% tenían límite inferior mayor de 2 (11, 12, 13).
Los programas de computación utilizados fueron Excel, StatCalc de EpiInfo y WinPepi (14).
La tabla de contingencia de 2x2 que se utiliza para el vaciamiento de datos y realizar los cálculos, descrita en otras publicaciones (11, 12, 13) se corresponde con la que se muestra en la Tabla 1.
RESULTADOS y DISCUSIÓN
Durante el periodo 2003-2008 hubo 120 casos de personas que tuvieron eventos adversos (1,62 por 100 000 dosis), las cuales totalizaron 224 manifestaciones o diagnósticos diferentes (Tabla 2).
Excepto un niño de 7 años, todos los reportes fueron de personas entre 18 y 77 años de edad y una media ±DE de 40 ± 13 años (rango: 27-53 años). Este niño recibió la vacuna en el año 2006 durante una acción de protección a una comunidad vulnerable de inundaciones, previo al inicio de la temporada ciclónica y fue considerado un fallo en la prescripción; sin embargo, no tuvo manifestaciones severas, sólo fiebre de 38,5 0C y malestar general.
El 65,54% de los reportes fueron de personas del sexo femenino. La tasa de reporte para esta vacuna la señala como una de las que provocan eventos adversos en muy baja frecuencia, clasificando como eventos raros, al estar en un valor inferior a 10 reportes por 100 000 dosis (10). Esta baja frecuencia se correspondió con la encontrada en SPIROLEPT (7).
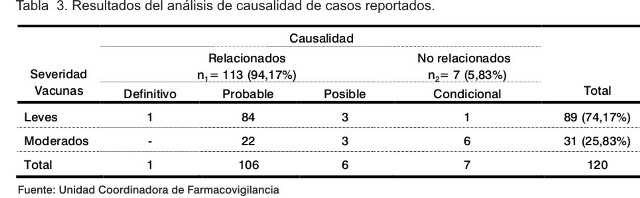
Referido a la severidad, no hubo casos graves y las reacciones locales fueron ligeras y de corta duración, con predominio de reportes leves. En cuanto al análisis causal, el 94,17% de los reportes fueron relacionados con la vacuna (Tabla 3).
Los casos clasificados como no relacionados fueron: cefalea (leve) en un paciente masculino de 33 años, reportado en diciembre 2003; trombocitopenia (paciente femenina de 39 años, junio 2003); reacción vagal (paciente femenina de 24 años, septiembre 2004); fiebre (paciente masculino de 37 años, marzo 2005); diarreas (paciente femenina de 28 años, febrero 2006); vómitos (paciente femenina de 32 años, mayo 2006); vómitos y fiebre, en paciente femenina de 42 años, reportada en octubre 2006.
Se muestra el porcentaje de diagnósticos entre el total de manifestaciones y se observa que la mayor parte de las manifestaciones adversas fueron sistémicas (Tabla 4).
Lo observado se aparta a lo detectado a la vacuna SPIROLEPT, comercializada en Francia desde 1979 (7), donde las manifestaciones que predominaron fueron locales. Los diagnósticos más frecuentes fueron: fiebre/hipertermia, cefalea, dolor local y enrojecimiento/eritema/rubor en el sitio de inyección (Tabla 5).
En proporción menor de 4,46% (menos de 10 casos) estuvieron: hipersensibilidad, febrícula, edema, diarreas/náuseas, temblor/escalofríos, mareos/reacción vagal/decaimiento y nódulo/inflamación/endurecimiento. Estos diagnósticos se agruparon de esta manera por la similitud del cuadro clínico y por ser incluidos dentro de la terminología de sospechas de RAM (WHOART 2008), por el cual se rige el sistema de farmacovigilancia nacional (4).
Las manifestaciones de hipersensibilidad fueron a nivel cutáneo: rash (tres casos), prurito generalizado (tres casos) y erupción cutánea (tres casos).
Los diagnósticos en una frecuencia menor de cuatro (menor a 1,78%) fueron: cardiovasculares (tres casos), dos casos con inflamación local más allá del sitio de aplicación de la vacuna, mialgia/artralgia (dos casos) y un caso con trombocitopenia.
De estos, las manifestaciones cardiovasculares no están referidas entre los eventos adversos esperados, y podrían ser explicables por el grupo de edad del cual proceden los reportes, por lo que se evalúan como eventos condicionales que podrían ser explicados por otras causas y no están descritos para este producto.
Los dos casos (0,89%) con inflamación más allá del sitio de inyección son eventos locales con una intensidad severa, lo cual puede ocurrir ante vacunas que contienen hidróxido de aluminio y por la posibilidad de que por mala técnica de aplicación esta haya sido aplicada en la región subcutánea; sin embargo es una frecuencia no apreciable.
Hubo un reporte de un caso de trombocitopenia (0,45%) en más de 7 millones de dosis (0,02 casos por 100 000 dosis), clasificando como evento adverso muy raro. Sin embargo, este merece un comentario especial.
Como evento adverso posvacunal, la literatura científica señala que la trombocitopenia clínicamente aparente es un acontecimiento clínico raro sólo considerado como evidencia después de la aplicación de la vacuna contra la paradotiditis, rubéola y sarampión (PRS), estimada de tres a cuatro por 100 000 niños inmunizados con esa vacuna (16).
Se considera que su patogénesis es compleja debido a la inmunoestimulación de citoquinas, que causa alteraciones en los megacariocitos precursores de plaquetas, producción de anticuerpos ante antígenos virales, los que actúan sobre los antígenos de las plaquetas o a la activación de las células de T citotóxicas que disminuyen la supervivencia de las plaquetas.
Ese razonamiento no se aplicó a esta vacuna, pues este caso fue hallado como condicional (no relacionado causalmente con vax-SPIRAL®) por la UCNFv.
Los resultados en una proporción mayor de 1,78% (cuatro o más reportes) se corresponden al referido en el expediente de Registro Médico Sanitario (5) que señala que durante el ensayo fase III no se observaron eventos adversos graves; las manifestaciones generales más frecuentes fueron: malestar general, cefalea, fiebre ligera, somnolencia y náuseas.
Las manifestaciones locales más frecuentes fueron: dolor en el sitio de de inyección, eritema, edema, induración y prurito.
En un estudio de cohortes fase IV (17), se observó que la vacuna no ocasionó ninguna reacción adversa sistémica grave y las manifestaciones más frecuentes fueron: dolor ligero en el sitio de la inyección (25,0%), malestar general (8,5%), cefalea (2,3%) y fiebre (1,0%).
La mayor parte de los síntomas y signos referidos duraron menos de 72 horas y fueron menos frecuentes después de la segunda dosis. La fiebre, malestar general y la cefalea son las manifestaciones más esperadas de esta vacuna según el prospecto (6).
La alta proporción de enrojecimiento/eritema/rubor en el sitio de inyección (12,05%) se corresponde también con lo descrito en la vacuna francesa SPIROLEPT, la más similar en el perfil de seguridad a la nuestra. En 1997 se realizó un estudio para evaluar la tolerancia de la vacuna antileptospirósica SPIROLEPT en 50 empleados de alcantarillados (18), y se observó que el 6% de ellos tuvieron eritema e induración mayor de 10 mm, por lo que se consideró que la misma era una vacuna con una tolerancia clínica buena. Las manifestaciones de hipersensibilidad cutáneas a vax-SPIRAL® estuvieron presentes en un estudio de cohortes de personas expuestas al riesgo ambiental de infección por leptospira (17).
La hipersensibilidad cutánea por exposición previa puede ser la patogenia de los resultados del estudio de la vacuna SPIROLEPT, de Pouliquen y Bendrick (18) y de nuestros resultados, pues tanto los participantes en el estudio referido, como la población diana de la vacuna cubana, son personas expuestas al riesgo ambiental de posible contaminación con la leptospira. En todos ellos, la exposición previa no puede excluirse y cuando ocurre la reexposición por la aplicación de la vacunas, pueden aparecer estas ligeras manifestaciones de hipersensibilidad cutánea y el eritema local.
En el estudio de eficacia y seguridad de la vacuna cubana, la reacción sistémica que se encontró con mayor frecuencia fue malestar general, en una proporción similar tanto en la primera como en la segunda dosis. La reacción local más frecuente fue el dolor espontáneo ligero, sin menoscabo funcional u orgánico de la extremidad donde se aplicó la inyección, menor en la segunda dosis (6).
Ese ensayo confirmó, tal cual lo corrobora la información de farmacovigilancia, que la vacuna vax-SPIRAL® no produce reacciones sistémicas adversas graves y que las reacciones locales son ligeras; en menor cuantía a la reactogenicidad desencadenada por una vacuna de procedencia rusa (19).
En otro estudio, efectuado en Israel, sobre una vacuna de ese país contra la leptospirosis sin adyuvante, encontraron reacciones adversas leves y algunas de naturaleza alérgica de tipo sistémica y cutánea atribuidas a anticuerpos circulantes o a efecto irritativo de la formalina utilizada en la inactivación celular (5).
La vacuna de procedencia rusa (sin adyuvante) (19) ocasiona reacciones adversas moderadas, lo cual puede ser probablemente debido a que contiene más células enteras inactivadas (6).
En el estudio de seguridad de la vacuna antileptospirósica monovalente francesa, SPIROLEPT, se observó que las reacciones en el sitio de la inyección eran raras dentro de la primera hora de la inyección, pero las reacciones locales se diferenciaron perceptiblemente según la ruta de la inyección en un plazo de tres días, con 40-60% y 13-20% para los sujetos inyectados por vía subcutánea e intramuscular, respectivamente. Ninguna de las reacciones sistémicas ocurrieron dentro de 1 hora posterior a la inyección y fueron raras en el plazo de tres días postinyección (0-4% y 0-13% para las vías subcutánea e intramuscular) (7).
El aceptable perfil de seguridad detectado a vax-SPIRAL®, se correspondió con la tolerancia total a la vacuna SPIROLEPT, que había sido considerada buena o muy buena por 97,7% de los médicos que participaron en esa evaluación (20).
Estos resultados hablan de la buena tolerancia y solamente reacciones locales de calidad inferior de las vacunas antileptospirósicas francesa y cubana cuando se les compara con otras vacunas de células inactivadas (10); a pesar de la diferencia existente entre ellas, pues la vacuna francesa es monovalente y la cubana es trivalente y adyuvada con hidróxido de aluminio.
En ninguno de los estudios realizados con la vacuna cubana, ni en la que presenta un comportamiento de seguridad similar (SPIROLEPT), se puso de manifiesto el riesgo teórico de uveítis, ni siquiera como evento adverso no relacionado.
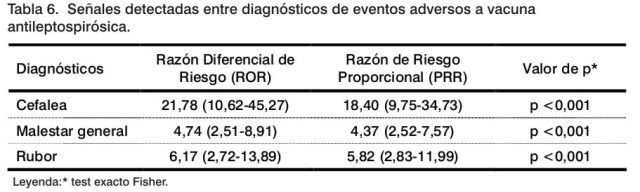
En la Tabla 6 se muestran las señales detectadas con la vacuna vaxSPIRAL®, que son aquellos diagnósticos que mostraron mayor asociación estadística en el análisis de desproporcionalidad.
Esos diagnósticos están incluidos en el grupo de eventos posvacunales esperados (5), de acuerdo con el registro de vax-SPIRAL®, y se corresponden con aquellos referidos con mayor frecuencia en la Tabla 5.
Esos diagnósticos también fueron considerados relacionados causalmente con la vacuna en otro análisis, exceptuando un caso con cefalea que fue clasificada como no relacionada por existir otras causas alternativas y una relación temporal dudosa. Si bien son diagnósticos esperados, su importancia radica en que un incremento de su proporción contra el total de reportes o la presencia de un brote con estas manifestaciones pudiera ser considerado como indicativo de la necesidad de profundizar en la investigación de lotes, pues es muy probable que la reacción esté relacionada con propiedades intrínsecas de la vacuna.
CONCLUSIONES
Los resultados en el seguimiento de las manifestaciones adversas a esta vacuna, obtenidos a partir de una red de farmacovigilancia a través de todo el país, confirman lo detectado en los estudios de seguridad realizados para acceder a la autorización de distribución de la vacuna antileptospirósica cubana, la cual tuvo una frecuencia esperada de eventos adversos muy raros, no graves y un perfil de seguridad que es consistente con la información contenida en el registro médico sanitario. En cuanto a la reactogenicidad de la vacuna, sus resultados son similares a los mejores alcanzados con la vacuna antileptospirósica SPIROLEPT.
Por ello, es posible señalar que esta vacuna tiene un perfil de seguridad muy aceptable y por lo tanto recomendable para la protección de grupos de riesgo de leptospirosis.
REFERENCIAS
1. Organización Panamericana de la Salud. División de Vacunas e Inmunización. Vacunación Segura: Cómo enfrentar los eventos supuestamente atribuidos a la vacunación o inmunización. Washington: D.C.OPS; 2002.
2. Autret-Leca E, Jonville-Béra AP, Beau-Salinas F. Pharmacovigilance des vaccins. La Revue du Practicien 2004;54:526-31.
3. Ministerio de Salud Pública, Centro para el Desarrollo de la Farmacoepidemiología. Normas y Procedimientos de Trabajo del Sistema Cubano de Farmacovigilancia. Unidad Coordinadora Nacional de Farmacovigilancia. Disponible en: http://www.cdf.sld.cu/fv/NormasyProcedimientos2006.htm [Consultado por última vez: 27 diciembre 2009].
4. Jiménez López G, Debesa García F, González Delgado B, Ávila Pérez J, Pérez Peña J. El Sistema Cubano de Farmacovigilancia, seis años de experiencia en la detección de efectos adversos. Rev Cubana Farm 2006;40(1). Disponible en: http://scielo.sld.cu/scielo.php?.[Consultado por última vez: 27 enero 2010].
5. Vacuna vax-SPIRAL®: Expediente de Registro Médico Sanitario enviado al Centro para el Control de la Calidad de los Medicamentos,Vacunas Finlay S.A., La Habana, Cuba; 1998.
6. Martínez Raydel, Pérez Alberto, Quiñones María del Carmen, Cruz Raúl, Álvarez Angel, Armesto Marlen, et al. Eficacia y seguridad de una vacuna contra la leptospirosis humana en Cuba. Rev Panam Salud Pública 2004;15: 249-55.
7. Laurichesse H, Gourdon F, Smits HL, Abdoe TH, Estavoyer JM, Rebika H, et al. Safety and immunogenicity of anti-leptospiral vaccine. Clinical Microbiology and Infection 2007;13:395-403.
8. Koizumi N, Watanabe H. Leptospirosis Vaccines: Past, Present, and Future. J Postgrad Med 2005;51:210-4.
9. Rathinam SR, Rathnam S, Selvaraj S, Dean D, Nozik RA, Namperumalsamy P. Uveitis associated with an epidemic outbreak of leptospirosis. Am J Ophthalmol 1997;124(1):71-9.
10. Adverse Events Following Immunization (AEFI): Causality assessment, Disponible en: http://www.who.int/vaccines-documents/DocsPDF05/815.pdf [Consultado por última vez: 25 diciembre 2009].
11. Hauben M, Zhou X. Quantitative Methods in Pharmacovigilance, Focus on Signal Detection.Drug Safety 2003;26:159-86.
12. Moore N, Thiessard F, Begaud B. The history of disproportionality measures (reporting odds ratio, proportional reporting rates) in spontaneous reporting of adverse drug reactions. Pharmacoepidemiology and Drug Safety 2005;14:285-6.
13. Cuevas Valdespino I, Jiménez López G, Peña Machado MA, Ávila Pérez J, González Delgado BE. Resultado de la Farmacovigilancia de vacunas producidas por el Instituto Finlay. Rev Cubana Farm 2007;41(3). Disponible en: http://scielo.sld.cu/scielo.php?[Consultado por última vez: 27 diciembre 2009].
14. Abramson JH, WINPEPI (PEPI-for-Windows): Computer programs for epidemiologist. Epidemiologic Perspectives & Innovations 2004 1(1):6. Disponible en: http://www.epi-perspectives.com/content/1/1/6 [Consultado por última vez: 27 diciembre 2009].
15. Mehta CR, Patel NR, Gray R. Computing an exact confidence interval for the common odds ratio in several 2x2 contingency tables. J Am Statistical Assoc 1985;80:969-73.
16. Miller E, Waight P, Farrington P, Andrews N, Stowe J, Taylor B. Idiopathic thrombocytopenic purpura and MMR vaccine. Arch Dis Child 2001;84:227-9.
17. Martínez R, Pérez A, Baró M, Álvarez AM, Menéndez J, et al. Evaluation of the effectiveness of a new vaccine against human leptospirosis in groups at risk. Rev Panam Salud Pública 2000;8:385-92.
18. Benbrik E, Pouliquen P, Dômont A. Evaluation de la tolérance de la vaccination contre Leptospira icterohaemorrhagiae chez 50 employés de canaux. Archives des Maladies Professionnelles et de l'Environnement 2001;62(1):35-40.
19. Cruz de la Paz R, Rodríguez P, López C, Atienzar E, Abreus J, Aldama F. Reactogenicidad de la vacuna antileptospirósica en Cuba. Rev Cub Hig Epidemiol 1986;24(4):407-12.
20. Pouliquen P, Catilina P. Vaccin Leptospires. Enquête de pharmaco surveillance auprès des médecins vaccinateurs. Rev Med Trav 2000;27:83-8.
Recibido: Marzo de 2010
Aceptado: Junio de 2010