Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Vaccimonitor
versión impresa ISSN 1025-028Xversión On-line ISSN 1025-0298
Vaccimonitor v.19 n.3 Ciudad de la Habana sep.-dic. 2010
ARTICULOS ORIGINALES
Niveles de protección contra la hemaglutinina del virus de influenza A/Johannesburg/82/96(H1N1) en un hogar de ancianas.
Protection levels against the hemaglutinine of influenza A/Johannesburg/82/96 (H1N1) influenza virus in a care center for old ladies.
Suset Oropesa1*, Bárbara Hernández1, Marlen Pérez2, Graciela Herrera2, Celia Tait2, Consuelo Menéndez2, Juana Toma2, Mercedes Biset2, Gladys Travieso2, Ileana Borrego3, Beatriz Vega1, Lizet Sánchez1
1 Laboratorio Nacional de Referencia de Virus Influenza. Instituto de Medicina Tropical "Pedro Kourí" (IPK). Centro Colaborador OPS/OMS para el Control de Enfermedades Virales. Novia del Mediodía. km 6½. La Lisa. La Habana. Cuba.email:s.oro@ipk.sld.cu
2.Hogar de Ancianas Hermanas Giralt. Marianao. La Habana, Cuba.
3 Consultorio Médico de la Comunidad. La Lisa. La Habana, Cuba.
* Dr. en Medicina. Investigador y Profesor Auxiliar. Especialista de II Grado en Microbiología.
RESUMEN
La vacunación anual contra la influenza es una acción estratégica fundamental para reducir la morbilidad, la mortalidad y las complicaciones ocasionadas por esta enfermedad. Su aplicación se recomienda en los grupos de riesgo, sobre todo en los ancianos con peligro de desarrollar una influenza severa o complicada. Atendiendo a esta condición se evaluó, después de aplicar una dosis única (0,5 mL por vía intramuscular) de la vacuna Agrippal S1/Chiron, recomendada por la OMS para la temporada 1997-1998, la respuesta inmune humoral antihemaglutinina en 38 mujeres con una edad ³ a 65 años, todas pertenecientes a un hogar de ancianas (institución estatal) de La Habana, Cuba. Para ello se utilizó la técnica de inhibición de la hemaglutinación en muestras de suero, obtenidas a partir de la sangre extraída en tres etapas: prevacunación (inmediatamente antes de su aplicación), posvacunación (30 días después) y un año después de la inmunización durante la temporada de influenza 1997-1998. Al aplicar el test de Student en los resultados obtenidos se observó que al comparar los niveles de anticuerpos protectores detectados en la etapa posvacunal (78,94%) y al año de la inmunización (42,11%), con los identificados en la etapa prevacunal, existían diferencias estadísticamente significativas (p=0,0094 y p=0,0018), respectivamente. La comparación de los porcentajes de positividad detectados en las tres etapas investigadas (28,94%; 97,36% y 86,84%) fue también significativo mediante el test de Chi cuadrado (p<0,00001). La respuesta a la inmunización antigripal obtenida en este grupo de riesgo apoya la política de revacunación en los ancianos, individuos donde se observan las mayores tasas de mortalidad por influenza y neumonía.
Palabras clave: Virus influenza, vacunas, inhibición de la hemaglutinación.
ABSTRACT
Annual vaccination against influenza is an essential strategic action to reduce morbidity, complications and mortality due to this disease. This practice is specially recommended in risk groups, mainly in the elderly with high risk to develop a severe or complicated influenza. Taking into account this condition and after the application of a single dose (0.5 mL by intramuscular route) of the Aggrippal S1 vaccine/ Chiron vaccine, according to WHO for 1997-1998, the anti-hemagglutinin humoral response was evaluated in 38 women aged ³ 65 from a care center for old ladies (state institution) of the City of Havana, Cuba. It was used the Hemagglutination Inhibition technique in serum samples from blood extracted in three stages: pre-vaccination (immediately after the application), post-vaccination (30 days after), and one year after vaccination during the influenza season 1997-1999. The Student test was applied in the results and statistically significant differences were observed (p=0.00094 and p= 0.0018, respectively) when comparing the protective antibodies levels in post-vaccine stage (78.94%) and those of one year after vaccination (42.11%) with the ones of the pre- vaccination stage. The comparison of positivity detected in the three stages (28.94%; 97.36% and 86.34%) was also significant by Chi-squared test (p<0.00001). Response to anti-flu immunization achieved in this group supports re-vaccination practice in the elderly who shows the higher mortality rates due to influenza and pneumonia.
Keywords: Influenza viruses, Inactivated vaccine, Hemagglutination-inhibition test.
INTRODUCCIÓN
La influenza o gripe es una infección respiratoria aguda (IRA), cuyo agente causal es el virus de la influenza, un miembro de la familia Orthomixoviridae (1) de distribución universal y que afecta a los individuos de todas las edades. La gripe constituye un problema de salud mundial por las elevadas tasas de morbilidad y mortalidad que produce, generalmente asociada con la neumonía, sobre todo en las edades extremas de la vida (2).
La ocurrencia anual de las epidemias de influenza se mantiene a través de los continuos procesos de cambios antigénicos menores o "drift", así como por la acumulación de mutaciones puntuales en los genes que codifican las glicoproteínas situadas en la superficie viral: la hemaglutinina (HA) y la neuraminidasa (NA). A intervalos impredecibles puede ocurrir la emergencia o reemergencia de una cepa pandémica, con características antigénicas y genéticas nuevas, originadas por cambios mayores o "shift" de la HA, la NA o ambas, para la cual la mayoría de los individuos poseen poca o ninguna inmunidad (3).
Debido a estos cambios en las proteínas virales (HA y NA), todos los años un comité de expertos analiza y reformula la composición de la vacuna estacional contra la influenza para la siguiente temporada, sobre la base de las principales cepas de influenza A(H3N2), A(H1N1) y tipo B que han circulado en el mundo (3).
La Organización Mundial de la Salud (OMS) recomienda la inmunización anual como única medida para el control y la prevención de esta enfermedad, la que junto con la quimioprofilaxis, constituyen las dos estrategias fundamentales para disminuir la morbilidad y mortalidad que produce la influenza. Actualmente se recomienda aplicar una vacuna trivalente, constituida por virus inactivados de los subtipos A(H3N2), A(H1N1) y el tipo B, fármaco con una elevada concentración de las glicoproteínas superficiales purificadas y que produce efectos secundarios mínimos (4).
La inmunización se recomienda, sobre todo, en los individuos con antecedentes de enfermedades respiratorias crónicas, afecciones cardíacas, renales, diabetes o en aquellos con un compromiso inmunológico, principalmente los que tienen una edad ³ a 65 años, grupo poblacional con un alto riesgo de desarrollar la influenza severa o complicada (5).
Está demostrado que la vacunación contra la influenza es segura y efectiva en los ancianos: reduce la duración de la enfermedad, su severidad, así como las complicaciones y la muerte. Además, unido a este tipo de intervención se observa un marcado beneficio relacionado con el costo-beneficio de la enfermedad (6).
Sin embargo, a pesar de las recomendaciones internacionales, en muchos países no se mantiene una política de vacunación sistemática de los ancianos. Las campañas de vacunación antigripal en Cuba están apoyadas por las autoridades gubernamentales y el Ministerio de Salud Pública. Desde 1997, todos los años los ancianos institucionalizados en hogares y diferentes grupos de riesgo de la población se inmunizan con la vacuna recomendada por la OMS para la temporada de influenza (7).
El propósito de este estudio fue determinar los niveles de protección humoral pre, posvacunación y 12 meses después de la inmunización, en un grupo de mujeres con una edad ³ a 65 años pertenecientes a un hogar de ancianas de La Habana y que fueron inmunizadas contra la influenza con la vacuna Agrippal S1 (Chiron), recomendada por la OMS para la temporada 1997-1998.
MATERIALES y MÉTODOS
Se realizó un estudio longitudinal (cohorte), durante la temporada 1997-1998 de influenza para determinar la respuesta de anticuerpos contra la hemaglutinina pre, posvacunación y al año de inmunizadas contra la influenza en 38 mujeres con una edad ³ a 65 años, todas del hogar de ancianas "Hermanas Giralt" (institución estatal) de La Habana, Cuba. En su diseño y realización se tuvieron en cuenta las exigencias bioéticas regulatorias nacionales e internacionales establecidas para este tipo de estudio.
Vacuna
Se aplicó la vacuna Agrippal S1, elaborada por los laboratorios Chiron Vaccine. Esta vacuna contiene los virus de influenza tipo A y B de las cepas recomendadas por la OMS para la temporada 1997-1998 (8), cultivados en embriones de pollo, purificados, concentrados e inactivados con formaldehído. Cada dosis contenía proteínas (HA y NA) de las cepas virales seleccionadas, expresadas en hemaglutininas (15 µg, de cada una).
La cepa A/Bayern/7/95(H1N1) análoga a la cepa A/Johannesburg/82/96(H1N1), fue el constituyente del subtipo A(H1N1), utilizada en este estudio. Contenía, además, timerosal, como preservante y solución salina tamponada. La vacuna se conservó a una temperatura entre 2 y 8 oC.
Esquema de vacunación
A todas las personas que participaron en esta investigación se les aplicó una dosis única de vacuna (0,5 mL), por vía intramuscular en la región deltoidea.
Muestras procesadas para serología, secuencia de su extracción y recolección
Se realizaron tres extracciones de 5 mL de sangre por punción de la vena cubital a 38 ancianas. La secuencia que se siguió para la toma de muestras fue la siguiente: Prevacunación (inmediatamente antes de aplicar la dosis de la vacuna), posvacunación (30 días después de su aplicación) y a los 12 meses después de la inmunización. Todas las muestras de sangre se centrifugaron a 800 g para la obtención del suero y se conservaron en el Laboratorio de Referencia Nacional de Virus de Influenza del IPK a -20 °C, hasta su uso.
Criterios de inclusión
Se establecieron como criterios de inclusión el que las ancianas pertenecieran al grupo de riesgo cuya edad fuera ³ a 65 años, no ser alérgico a ningún componente del huevo, no estar bajo terapia antibiótica o antiviral, no presentar un cuadro clínico de IRA compatible con enfermedad tipo influenza u otro cuadro infeccioso que pudiera interferir con el estudio, si padecía de alguna patología crónica, la persona debía estar compensada en el momento del estudio y no estar sometida a tratamiento con salicilatos durante un periodo prolongado.
Virus
El antígeno utilizado en la prueba serológica de inhibición de la hemaglutinación (IH) se elaboró en el Laboratorio de Referencia Nacional de Virus Influenza del IPK, por inoculación en la cavidad alantoidea de embriones de pollo de 9 a 11 días, con la cepa humana A/Johannesburg/82/96 (H1N1), que constituye la vacuna utilizada, según las normas establecidas en este laboratorio (9).
Determinación de la respuesta inmune, mediante la técnica de IH
Los anticuerpos anti-HA (neutralizantes) producidos como respuesta inmune humoral a la vacuna contra la influenza se detectaron y midieron por IH frente a uno de los antígenos constituyentes de la vacuna empleada, el subtipo A(H1N1), de acuerdo con los procedimientos recomendados por Palmer y colaboradores (10).
Criterio de individuo seropositivo
Se consideraron positivos los individuos que cumplieron con la condición de tener sueros que mostraron, por la técnica de IH, títulos de anticuerpos ³ 1:10. El porcentaje se calculó con relación al total de individuos.
Criterio de seroconversión
Se consideró como el aumento de los títulos de anticuerpos por IH1 ³ 1:10 en la etapa posvacunal o al año de la inmunización, en aquellos individuos con títulos de anticuerpos por IH ³ 1:10 (seronegativos) en la etapa prevacunal. El porcentaje se calculó con respecto al total de individuos seronegativos antes de vacunar.
Criterio de título protector
Se definió como título protector para la influenza por IH, el nivel de anticuerpos anti-HA ³1:40, en correspondencia con la definición internacional. El porcentaje se calculó con respecto al total de individuos.
Criterio de título protector inducido por la vacunación
Se definió como el aumento del título inicial en cuatro o más diluciones con respecto a los anticuerpos presentes, antes de la inmunización (respuesta basal). El porcentaje se calculó con relación al total de individuos.
RESULTADOS
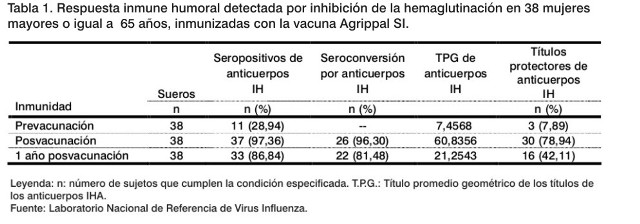
Al aplicar la técnica de IH en las muestras de suero correspondientes al periodo prevacunal, frente al antígeno A/Johannesburg/82/96, perteneciente al subtipo de influenza A(H1N1) de los virus influenza, se obtuvo que: 11 fueron seropositivos (28,94%) y de estos, tres (7,89%) mostraron títulos protectores (³ 40). El TPG fue de 7,45. Mientras que, en las muestras de la etapa posvacunal se identificaron 37 seropositivos (97,36%), entre los cuales, 30 (78,94%) mostraron títulos protectores, el TPG fue de 60,83, detectándose una seroconversión de 96,30% (Tabla 1 y Figura 1).
En 27 sueros del total de los protegidos (30 individuos) se constató un aumento de al menos en cuatro diluciones o más del título de anticuerpos inducidos por la inmunización, con respecto a la muestra prevacunal por IH.
Transcurridos 12 meses de la inmunización, 16 ancianas (42,11%) conservaban títulos protectores y el 81,48% de los sueros seroconvirtieron con relación a la muestra prevacunal (Tabla 1). En 14 (de los 16 sueros con títulos protectores) se demostró por IH un aumento del título inicial en cuatro diluciones o más.
El nivel de protección alcanzado en la etapa posvacunal y al año de la inmunización fueron superiores al existente antes de vacunar (p=0,0094 y 0,0018), respectivamente. Los TPG aumentaron significamente después de la vacunación (p=0,0027). También aumentó el porcentaje de seropositividad obtenido en las etapas posvacunal y al año (p < 0,00001).
DISCUSIÓN
Hasta el momento, la vacunación constituye la estrategia más efectiva para prevenir la infección por el virus de la influenza, relacionándose su efectividad o el grado de protección que aporta contra la influenza con factores que varían, en dependencia de la edad y la inmunocompetencia del individuo vacunado (11). Influyen también la cantidad de antígeno contenido en estas vacunas, su vía de administración, así como la inactivación, la valencia del inmunógeno y los adyuvantes utilizados (12).
En este trabajo se tomó en consideración las recomendaciones del Comité Asesor para la Práctica de la Inmunización contra la Influenza como la cepa del subtipo A(H1N1) recomendada para este periodo, la concentración máxima de virus constituyente (15 µg) y la vía empleada (6), que consideramos influyó en los resultados satisfactorios obtenidos en cuanto a la seropositividad, la seroconversión y la protección de las ancianas investigadas (Tabla 1).
En la literatura se describe que, cuando existe una correspondencia adecuada u homología entre las cepas circulantes y las incluidas en la vacuna durante la estación actual, habrá una mayor efectividad contra la infección de los virus homólogos y una menor actividad contra la de los virus heterólogos, notificándose la prevención de la influenza en 70-90% de los adultos sanos menores de 65 años (13).
A partir de estos criterios se consideró que durante el período analizado la efectividad que se alcanzó frente a la cepa A/Johannesburg/82/96(H1N1) fue satisfactoria y las personas estaban en cierto grado protegidas contra esta cepa y aquellas con una estructura antigénica similar.
La vacunación previene también la hospitalización por influenza y la neumonía, en el 30-70% de las personas mayores de 65 años que no viven en instituciones estatales y en el 50-60% de los ancianos internados en los hogares geriátricos. Sin embargo, en este último grupo la eficacia puede variar en la prevención de la enfermedad (30-40%) y la muerte (80%) (14).
Diferentes autores coinciden en afirmar que la vacuna inactivada contra la influenza previene la enfermedad severa y reduce el riesgo de fallecer, cuando se compara el comportamiento de esta enfermedad con los que se presentan en los individuos no vacunados (4,15).
De acuerdo con la descripción hecha por otros autores, los títulos protectores alcanzados favorecen al grupo de riesgo inmunizado, lo que se traduce en la prevención de las complicaciones clínicas ocasionadas por el virus de la influenza, así como en la exacerbación o descompensación de las enfermedades crónicas (16).
El subtipo A(H1N1) reemerge en el año 1977 (17) y comienza a cocircular en el mundo con otros virus de influenza, sin embargo, en la población estudiada se evidenció su baja circulación en correspondencia con estudios que identifican también la baja circulación de los virus de influenza tipo A(H1N1) en nuestra población (18).
Los valores de anticuerpos humorales obtenidos del estudio serológico y que se detectaron mediante la técnica de IH frente al antígeno vacunal A/Johannesburg/82/96 (H1N1) (19), en la etapa de preinmunización, sugirieron que en este grupo hubo infecciones previas por virus pertenecientes al subtipo A(H1N1), afección que dejó un nivel de anticuerpos protectores bajo. Autores nacionales obtienen resultados similares en la etapa prevacunal con antígenos pertenecientes a este subtipo (18, 20).
En el grupo estudiado se constató que 30 días después de la inmunización se identificaron niveles de anticuerpos anti-HA satisfactorios (³ 1:40) frente a la cepa A/Johannesburg/82/96 (H1N1). Hobson y colaboradores señalan cifras similares a las obtenidas en este trabajo y coinciden en ratificar el papel que desempeñan estos niveles de anticuerpos protectores contra la infección de los virus de influenza A y B (21).
Otros investigadores señalan niveles de anticuerpos protectores también similares, utilizando una vacuna antigripal bivalente en individuos con edades comprendidas entre 57 y 70 años (22).
La vacunación contra la influenza está formulada para que se realice todos los años debido a los cambios que se producen en la estructura viral y por la disminución progresiva de los anticuerpos sistémicos en el transcurso del año. Sin embargo, en este trabajo resultó interesante conocer, después de un año de la inmunización, el desarrollo y el nivel de anticuerpos humorales presentes en este mismo grupo.
Se demostró que un porcentaje considerable de ancianas mantuvieron títulos protectores anti-HA o neutralizantes contra la cepa de influenza A(H1N1). Este efecto quedó también demostrado al comparar los TPG detectados en las etapas pre, posvacunal y al año de la inmunización.
Algunos autores describen que las personas mayores de 65 años (11) y con enfermedades crónicas de base, desarrollan una respuesta inmunitaria menor a la que se observa en los adultos sanos. Sin embargo, en este trabajo se detectó una respuesta posvacunal y anamnésica satisfactoria en el grupo de ancianas estudiadas.
La protección obtenida en este grupo de ancianas apoya el empleo de la vacuna antigripal para prevenir las reinfecciones con esta cepa del virus influenza o virus con una estructura antigénica y genómica similar, así como para prevenir las complicaciones secundarias y reducir el riesgo de hospitalización y la muerte.
Esto apoya la política de revacunación en los grupos de riesgo, fundamentalmente en los ancianos, grupo poblacional donde se observan las mayores tasas de mortalidad.
Agradecimientos
Los autores agradecen a todos los participantes por la importancia de su contribución en la investigación realizada. A las Dras. Clara Savón, Odalys Valdés, Beatriz Sierra, Grehetel González y al Lic. Edgardo Fundora, por la revisión del manuscrito.
REFERENCIAS
1. Wright PF, Webster RG. Orthomyxoviruses. In: Knipe DM, Howley PM, eds. Fields Virology. Philadelphia: Lippincott Williams and Wilkins; 2001. p. 1533-79.
2. Simonsen L, Fukuda K, Schoenberger LB, Cox NJ. The impact of influenza epidemic on hospitalizations. J Infect Dis 2000;181:831-7.
3. Taubenberger JK, Morens DM. 1918 influenza: the mother of all pandemics. Emerg Infect Dis 2006;12:15-22.
4. Nichol KL. The efficacy, effectiveness and cost-effectiveness of inactivated influenza virus vaccines. Vaccine 2003; 21:1769-75.
5. Deguchi Y, Takasugi Y. Efficacy of influenza vaccine in the elderly: reduction in risks of mortality and morbidity during an influenza A (H3N2) epidemic for the elderly in nursing homes. Int J Clin Lab Res 2000;30:1-4.
6. Centers for Disease Control and Prevention. Strategies for Increasing Adult Vaccination Rates Prevention and Control of Influenza. Recommendation of the Advisory Committee on Immunization Practice (ACIP). MMWR 2002. 51 (RR-03). Disponible en: http://www.cdc.gov/mmwr/pre- view/ [Consultado: abril de 2004].
7. Piñón A. Respuesta de anticuerpos inducida por una vacuna trivalente antiinfluenza en grupos de riesgo. Tesis para optar por el grado de Máster en Ciencias. Ciudad Habana, Cuba: Universidad de La Habana; 2003.
8. World Health Organization. Recommended composition of influenza virus vaccines for use in the 1997-1998 season. Wkly Epidemiol Rec 1997;72:57-61.
9. Goyenechea A, Oropesa SI, López E, Bello M, Comella MM, Savón C. Curso Nacional de Diagnóstico Virológico de las Enfermedades Respiratorias Agudas. Ciudad de La Habana. Ministerio de Salud Pública (MINSAP); 1983.
10. Palmer D, Dowdle W, Coleman M, Schild G. Advanced laboratory techniques for influenza diagnosis. Immunology Series No 6. Part. 2: Procedural Guide, Atlanta, US Department of Health Educat and Public Health Service; 1975. p. 25-62.
11. Webster RG. Immunity to influenza in the elderly. Vaccine 2000;18:1686-9.
12. Stephenson I, Bugarini R, Nicholson KG, Podda A, Wood JM, Zambon MC, et al. Cross-reactivity to highly pathogenic avian influenza H5N1 viruses after vaccination with nonadjuvanted and MF59-adjuvanted influenza A/Duck/Singapore/97 (H5N3) vaccine: a potential priming strategy. J Infect Dis 2005;191:1210-5.
13. Chilbek R, Beran J, Salino M. Effectiveness of influenza vaccination in healthy adults: a fourfold decrease in influenza morbidity during one influenza season. Epidemiol Mikrobiol Immunol 2002;51:47-51.
14. CDC. Seasonal Influenza, 2009-2010. Vaccine Updates. Disponible en: http://www.cdc.gov/flu/flu_vaccine_updates.htm
15. Couch RB. Prevention and treatment of influenza. N England J Med 2000; 343:1778-87.
16. Suzuki K, Torii M, Yamamoto T, Mizumo Y. Prevention and care management of influenza infection in institutions for the elderly and high risk groups. Nippon Rinsho 2000;58:2327-32.
17. Zhdanov VM, Lvov DK, Zakstelskaya LY, Yakhno MA, Isachenko VI, Braude NA. Return of epidemic A1(H1N1) influenza virus. Lancet 1978;311:294-5.
18. Sotolongo Valdés A. Estudio virológico de un brote de infección respiratoria aguda en un colectivo cerrado de adolescentes. Tesis para optar por el título de Licenciada en Microbiología. La Habana, Cuba: Universidad de La Habana; 1996.
19. CDC. Update: influenza activity United States, 1997-98 season. MMWR. 1998;47:196-200.
20. Rivas MI. Valoración inmunológica a una vacuna contra la influenza inactivada a viriones enteros en un colectivo de adultos. Trabajo para optar por el título de especialista de primer grado en Microbiología. Ciudad de La Habana: Universidad de La Habana; 1986.
21. Hobson D, Curry RL, Beare AS, Ward-Gardner A. The role of the serum haemagglutination inhibition antibody in protection against challenge infection with influenza A and B viruses. J Hyg 1972;70:767-77.
22. Pérez RA, González EO, Armas C, Goyenechea A. Evaluación de la vacuna antigripal en un grupo de ancianos. Revista Cubana de Medicina Tropical 1990;42(1):96-102.
Recibido: Marzo de 2010
Aceptado: Junio de 2010