Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Vaccimonitor
versión impresa ISSN 1025-028X
Vaccimonitor vol.20 no.3 Ciudad de la Habana sep.-dic. 2011
ARTÍCULOS ORIGINALES
Comparación entre dos biomodelos murinos en el ensayo de la morfología de la cabeza del espermatozoide
Two murine biomodels comparison in the head sperm morphology assay
Daniel Francisco Arencibia1*, Luis Alfredo Rosario2, Yolanda Emilia Suárez3, Livan Delgado4
1Vicepresidencia de Investigaciones, Instituto Finlay. Calle 17 e/ 198 y 200, Reparto Atabey, Municipio Playa, Apartado Postal 16017. La Habana, Cuba. email:darencibia@finlay.edu.cu
2Instituto de Farmacia y Alimentos (IFAL) Universidad de La Habana. Calle 222 e/ 25 y 27, Reparto La Coronela, Municipio La Lisa. La Habana, Cuba.
3Universidad Agraria de La Habana (UNAH), San José a carretera Tapaste, municipio San José. Mayabeque, Cuba.
4Centro de Estudios para las Investigaciones y Evaluaciones Biológicas (IFAL, U.H). Avenida 23 No. 21 425 e/ 214 y 222, Reparto La Coronela, Municipio La Lisa. La Habana, Cuba.
* Doctor en Medicina Veterinaria y Zootecnia. Aspirante a Investigador.
RESUMEN
Este trabajo tuvo como objetivo realizar una comparación entre el ratón Balb/c y ratas Sprague Dawley (SD) como biomodelo en el ensayo de la morfología de la cabeza del espermatozoide, teniendo en cuenta la frecuencia de formas anómalas en la cabeza del espermatozoide basales e inducidas con ciclofosfamida (CF). Se utilizaron 20 animales/grupo de la línea de ratón Balb/c y de ratas Sprague Dawley, administrados durante 35 días en el ratón y 52 días en la rata. Se creó un grupo control negativo (no administrado), dos controles con sustancias vehículo y un control positivo administrado con CF 50 mg/kg por vía intraperitoneal durante cinco días consecutivos. El mejor biomodelo experimental resultó ser el de los ratones Balb/c que difirió significativamente con los resultados obtenidos en las ratas SD, teniendo en cuenta los valores espontáneos e inducidos en la concentración espermática y la frecuencia de espermatozoides morfológicamente anómalos en epidídimos. Este estudio permitirá utilizar esta línea de ratón con mayor eficiencia en la evaluación genotóxica y toxicológica de la fertilidad preclínica de drogas, vacunas y otros productos.
Palabras clave: Morfología de la cabeza del espermatozoide, ratones Balb/c, ratas Sprague Dawley.
ABSTRACT
This research aimed at comparing Balb/c mice and Sprague Dawley rats as biomodel in the head sperm morphology assay, keeping in mind the frequency in anomalous forms in the sperm head basal and induced with cyclophosphamide (CF). Twenty animals/group were used of Balb/c mice line and Sprague Dawley (SD) rats, administered during 35 days in the mouse and 52 days in the rat. Using a negative control group (not administered), two substance-vehicle controls and positive control CF administered with 50 mg/kg, by intraperitoneal route during five consecutives days. The best experimental biomodel turns out to be the Balb/c mice differing significantly from the results obtained in the SD rats, keeping in mind the spontaneous and induced values in the spermatic concentration and the frequency of anomalous epididymis sperms. This study will allow to use mice species with more efficiency in the genotoxic and preclinical toxicology fertility evaluation of drugs, vaccine and other products.
Keywords : Head sperm morphology, Balb/c mice, Sprague Dawley rats.
INTRODUCCIÓN
El ensayo de la morfología de la cabeza del espermatozoide se encuentra dentro de la batería de ensayos de genotoxicidad, el cual permite determinar la inducción de daño genotóxico a nivel de las células germinales masculinas. Esta técnica es sensible, rápida y económica, lo cual justifica su uso.
Entre los sistemas que se emplean para evaluar los daños ocurridos en las células germinales se encuentra el ensayo basado en los criterios morfológicos de Wyrobek y Bruce. Estos criterios permiten el estudio y la clasificación de la cabeza del espermatozoide al incluir dentro de las clasificaciones cabezas normales, anormales y dentro de este último los que tienen morfología en forma de banana, los amorfos, sin gancho y con dos colas (1). Esta herramienta a su vez permite evaluar cambios en la concentración espermática, siendo capaz de detectar el daño irreversible que queda fijado por un período de tiempo relativamente largo (2).
Los ensayos de genotoxicidad son obligatorios en vacunas de ADN y en todo producto biotecnológico. Además, se justifica aún más para aquellos que se obtengan por la tecnología del ADN recombinante. En vacunas se exigen cuando estas van a ser administradas a embarazadas, niños, mujeres y hombres en edad reproductiva. Estos estudios sirven de herramienta para conocer si su producto es capaz de interactuar con el material genético y qué tipo de daño ocasiona y permiten enriquecer el registro sanitario de su producto en la temática de seguridad.
Hasta el momento la mayoría de las agencias reguladoras por excelencia en productos biotecnológicos establecen solo realizar estudios reproductivos en vacunas en las cuales se haya observado daño a nivel del sistema reproductivo durante la evaluación en toxicología clásica y aquellas que de una forma inminente se deban administrar a embarazadas (3,4).
El ensayo de la morfología de la cabeza del espermatozoide, en cambio, permite evaluar la toxicidad reproductiva en el macho a corto plazo, siendo utilizado en vacunas y nuevos adyuvantes (5). Por lo que se hace evidente la necesidad y utilidad de los ensayos de genotoxicidad en el campo de la seguridad en la industria biotecnológica y farmacéutica.
Es de vital importancia en la evaluación genotoxicológica el uso de biomodelos experimentales eficientes. Por lo que se hace necesario que estos expresen la menor frecuencia de aparición de cabezas morfológicamente anómalas, como parámetro medible del daño genotóxico.
Esto permitirá detectar con el mínimo margen de error, la actividad genotóxica de una sustancia química o agente complejo en el material genético (6).
Al utilizarse diferentes especies indistintamente de forma azarosa sin un basamento teórico-práctico que justifique su elección, es necesario conocer el biomodelo ideal a partir de obtener resultados de índices espontáneos bajos e inducidos altos. Además, de no existir hasta el momento una armonización en cuanto al mejor biomodelo capaz de detectar sustancias con bajo o poco efecto genotóxico, lo cual al sugerir el uso de una especie y línea en particular, le permitiría a estos ensayos una mayor sensibilidad y robustez.
Por otro lado, es totalmente novedosa la evaluación y comparación de los índices basales e inducidos entre varias líneas de ratas y de ratones mediante esta técnica citogenética, tanto para el mundo como para Cuba (6,7), aplicable igualmente a otras técnicas que se encuentran dentro de la batería de ensayos obligatorios de genotoxicidad.
Aún en nuestros días no se ha realizado una comparación entre diferentes especies, teniendo en cuenta la morfología de la cabeza del espermatozoide, sí para el ensayo cometa alcalino, el de micronúcleos y aberraciones cromosómicas en células de la médula ósea, en los cuales han sido comparados ratones de la línea Balb/c y ratas de la línea Sprague Dawley (SD) en ambos sexos (8,9).
A partir de esta problemática surge la necesidad de realizar una comparación en cuanto a la frecuencia basal e inducida con ciclofosfamida (CF), entre ratones Balb/c y ratas SD machos, en el ensayo de la morfología de la cabeza del espermatozoide, útil como ensayo de genotoxicidad y para determinar la fertilidad del macho, con el objetivo de identificar el mejor biomodelo experimental, lo cual pudiera aplicarse en estudios de otros fármacos o agentes no explorados en relación con el efecto genotóxico.
Utilizamos para este estudio solo ratones de la línea Balb/c. Sobre la base de los resultados de nuestras investigaciones se comprobó que esta línea es la más eficiente en este ensayo (6,7). Tomamos en consideración la alta concentración espermática y la baja frecuencia espontánea de espermatozoides anómalos, así como la alta sensibilidad a sustancias mutagénicas como la CF encontrada en esta línea de ratón (6,7).
MATERIALES Y MÉTODOS
Animales
Para este ensayo se utilizaron ratones adultos jóvenes machos (8-9 semanas), de la línea Balb/c, cuyo peso corporal oscilaba entre 26-30 g. Además, se utilizaron ratas Sprague Dawley adultos jóvenes machos (6-8 semanas), cuyo peso corporal oscilaba entre 180-210 g al término de la cuarentena. Ambas especies se mantuvieron en locales separados bajo condiciones controladas de temperatura (23 ± 2 º C) y humedad relativa (60% ± 10%) y ciclos de luz-oscuridad de 12 h. El acceso al agua y al alimento fue ad libitum.
El alimento suministrado fue pienso para ratas y ratones, todo propósito y esterilizable, suministrado por el CENPALAB. Estas características fueron comunes para todos los grupos experimentales evaluados en este ensayo. Durante todo el proceso experimental se respetaron los principios éticos establecidos para la investigación con animales de laboratorio (10).
Administración y dosificación
En todos los grupos experimentales la sustancia se administraba en el horario de 10:30-11:30 a.m. y las concentraciones se ajustaron semanalmente en función del aumento del peso corporal.
Los animales se distribuyeron aleatoriamente (10 animales/grupo/especie), para un total de 20 animales/grupo/especie en las dos réplicas realizadas. La administración y dosificación de las sustancias utilizadas en este estudio se realizaron de acuerdo con las premisas internacionales, respetando el bienestar animal (11).
En el grupo experimental 1 utilizamos animales no tratados como control negativo. A estos animales se les realizó la técnica de intubación gástrica para que estuvieran expuestos a las mismas condiciones de manejo que los demás grupos, durante un periodo de 35 días en el ratón y de 52 días en la rata (duración del ciclo espermático de cada una de las especies realizadas) (12).
En el grupo experimental 2 utilizamos el tween 65% al 2%, siendo el vehículo más utilizado en la mayoría de las preparaciones de sustancias oleosas, útil como agente tensoactivo (sustancia vehículo 1) (13).
En el grupo experimental 3 utilizamos el NaCl al 0,9%, útil como disolvente de la mayoría de las sustancias a preparar (sustancia vehículo 2) (11,14). Ambas sustancias fueron administradas por vía oral a 2 mL/kg durante un periodo de 35 días en los ratones y de 52 días en la rata, preparadas 2 h antes de la administración (12).
En el grupo experimental 4 se utilizó la CF (adquirida de la firma comercial mexicana Lemri S.A bajo la marca de LEDOXINA), utilizada en dosis de 50 mg/kg (12,15). La CF se administró por vía IP y se diluyó en disolución salina (NaCl) al 0,9%, administrada a razón de 10 mL/kg. Se administró inmediatamente de ser preparada durante cinco días consecutivos y luego estuvieron sin administrarse 35 días para el caso de los ratones y 52 días en las ratas (12).
Observaciones clínicas
Se realizaron dos observaciones clínicas diarias en el horario comprendido entre las 8.30-10.30 a.m y en el horario de la tarde de 3.00-4.30 p.m. Durante cada observación se tuvo en cuenta el estado clínico general del animal, lo cual incluyó la palpación para la detección de las lesiones, posibles afectaciones respiratorias del sistema nervioso, cardiovascular, gastrointestinal, estado de la piel, pelo, coloración de las mucosas y ojos.
Eutanasia
La eutanasia se realizó por dislocación cervical con previa atmósfera de éter para el caso de los ratones; en las ratas se realizó por sobredosis de Pentobarbital (16); en el caso de los grupos experimentales 1, 2 y 3, a las 24 h de la última administración y en el grupo 4, la eutanasia fue a las 24 h pasados los 35 días de reposo para el caso de los ratones y 52 días para las ratas, para que los espermatozoides analizados fuesen los que estuvieran expuestos a las sustancias mutagénicas (12,17).
Ensayo de la morfología de la cabeza del espermatozoide
La técnica se realizó de acuerdo con las normas de la ICH en el 2005 sobre toxicología de la fertilidad del macho (18). Para realizar este ensayo en el caso de los ratones se procedió a extraer ambos epidídimos y uno solo para el caso de las ratas, los cuales se redujeron a pequeños fragmentos con la ayuda de tijeras afiladas, al ser depositados en placas Petri que contenían 3 mL de solución isotónica de NaCl 0,9% (12). La muestra se homogeneizó con pipetas Pasteur (12,19).
Conteo de espermatozoides . El contenido de la placa se colocó en un tubo graduado, al cual se le añadió 0,05 mL de tripsina al 0,25%; transcurridos 5 min de tripsinización se le añadió 2 mL más de NaCl 0,9%. Luego se realizó una dilución del homogeneizado tripsinizado en NaCl - Formol al 1% (1:10) y se colocó en una cámara de Neubauer, contándose ambos lados con la cámara al microscopio Olympus BH-2, a 10x (12,19).
Morfología del espermatozoide . Al tubo que contenía la dilución del homogeneizado ya diluido se le añadió cinco gotas de eosina al 1%, dejándolo reposar por 5 min. Posteriormente, se extendió una gota sobre una lámina seca y se colocó el cubreobjeto (12). Se prepararon dos láminas por animal y se analizaron 500 espermatozoides con la ayuda de un microscopio Olympus BH-2, a 40x. Las observaciones fueron realizadas "a ciegas" por dos observadores independientes, para luego establecer un promedio entre ambos. El criterio de clasificación se basó en cabezas normales y anormales que incluye amorfas, banana, sin gancho y con dos colas (12).
Análisis estadístico. Se verificó los supuestos para el análisis de varianza. Los resultados obtenidos están distribuidos normalmente (según el test de Kolmogorov-Smirnov). Existe dependencia entre las observaciones y presentan homogeneidad de varianzas (prueba de Levene), por lo cual todos los resultados se analizaron mediante el método de análisis de varianza (ANOVA).
El nivel de significación establecido fue a=0,05. Los análisis se realizaron empleando el paquete estadístico Statsoft for windows. StatSoft, Inc. (2003). STATISTICA (data analysis software system), versión 6.
RESULTADOS Y DISCUSIÓN
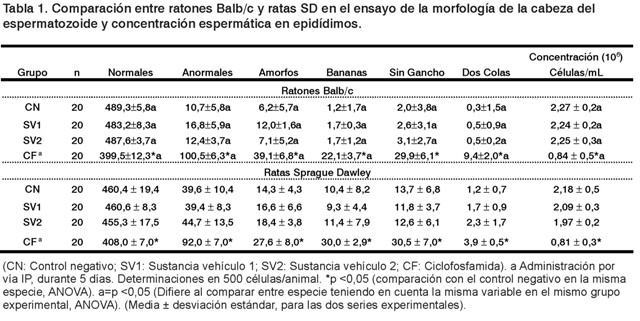
No se observaron signos y síntomas indicativos de toxicidad en los animales tratados en nuestro estudio. El hecho de ser observado y medible el daño en células germinales evidencia que las dosis, vía y número de exposiciones fueron las apropiadas para no lograr daño sistémico. En la Tabla 1 se observan los resultados basales de espermatozoides anómalos en ratones de la línea Balb/c, los cuales se encuentran en valores de 10,7-16,8 en un conteo total de 500 espermatozoides.
Por otro lado, el mayor número de espermatozoides anómalos se caracterizó por ser amorfo, estando el rango basal entre 6,2-12,0. Se corroboró que la concentración espermática de está línea de ratón se encuentra en el rango entre 2,24-2,27 x 10 6 células/mL.
Estos resultados concuerdan con los obtenidos por nuestro grupo de trabajo en un estudio comparativo de dos mutágenos en el ensayo evaluado (20). Tanto los resultados de citotoxicidad como de genotoxicidad basales encontrados difieren significativamente con los obtenidos con el uso de la CF, que valida los resultados obtenidos en nuestro estudio.
La CF en ratones Balb/c indujo valores entre 100,5±6,3 espermatozoides anómalos en conteo de 500 células totales, siendo los espermatozoides en forma anómala amorfa los de mayor frecuencia. También este mutágeno fue capaz de ejercer su efecto citotóxico, disminuyendo de forma considerable la concentración espermática en epidídimos, que está en valores entre 0,84 ± 0,5 x 10 6 células/mL (20).
En ratas SD se encontraron valores de espermatozoides anómalos basales en el rango entre 39,4-44,7 células en conteo total de 500 (Tabla 1).
Las formas predominantes de morfo anomalías espermáticas en la cabeza del espermatozoide encontradas fueron: amorfo, banana y sin gancho. Se corroboró que la concentración espermática de esta especie de rata se encuentra en el rango 1,97-2,18 x 10 6 células/mL (21). En tanto la CF indujo en ratas SD entre 92,0 ± 7,0 espermatozoides anómalos en 500 células totales. Igualmente, indujo un gran número de espermatozoides amorfos, banana y sin gancho, resultados que difieren de forma significativa con los endógenos de está especie (21). A su vez, al inducir la CF, estas formas anómalas justifican su uso como control positivo en protocolos de estudios de teratogénesis y fertilidad (22).
Por primera vez se comparan diferentes especies murinas en búsqueda del biomodelo ideal, a partir de que las agencias reguladoras de los medicamentos establecen solo el uso de una especie en estos ensayos (18). Además, en recientes investigaciones se observaron diferencias significativas dentro de una misma línea de ratones, en relación con la acción de mutágenos químicos clásicos con la CF y la bleomicina, con solo variar la dosis o el número de administraciones en diferentes intervalos de tiempo (20, 21).
De igual forma, para Cuba este resultado es totalmente novedoso y obtener una buena caracterización desde el punto de vista del daño endógeno al ADN por varios mecanismos de genotoxicidad permitiría un mayor conocimiento de los biomodelos que comercializa nuestro país, siendo de importancia para apoyar la exportación hacia otros países interesados en evaluar sus productos, utilizando nuestros biomodelos.
Al comparar los resultados basales e inducidos entre ambas especies se obtuvo que la línea de ratones Balb/c difiere con las ratas SD en todas las variables analizadas. Siendo esta línea de ratones la de valores espontáneos más bajos en cuanto al análisis de las variables genotóxicas, pero a su vez la misma experimentó mayor concentración espermática que las ratas SD.
Al analizar los resultados de las variables inducidas se observa que, igualmente, en el caso de la morfología de la cabeza del espermatozoide los ratones Balb/c son más susceptibles a la CF, pero al medir la citotoxicidad mediante la concentración espermática resultaron ser más resistentes al daño inducido por la CF que las ratas SD.
El hecho de que los ratones Balb/c hayan resultado ser mejores biomodelos que las ratas SD, al tener en cuenta los índices endógenos evaluados, pudiera estar dado por la baja tasa de variabilidad genética de esta línea al ser isogénica, lo cual constituye una ventaja al evaluar el efecto genotóxico de drogas mediante este ensayo, pero a su vez no obtendremos una respuesta heterogénea, la cual es típica en poblaciones humanas.
Por otro lado, las ratas SD fueron más susceptibles a la CF en la variable concentración espermática, la cual mide el componente citotóxico en este ensayo. Esto pudiera ser en respuesta a diferentes niveles de expresión de los genes que codifican para la enzima citocromo P-4501A1 en el hígado, ya que los ratones y ratas difieren genética y epigenéticamente al tener en cuenta esta enzima hepática fundamental en la fase I del metabolismo de xenobióticos, que participa en el metabolismo de la CF en el hígado al utilizarse como droga citostática (21-24).
Para que esta droga se metabolice es necesario la activación en los microsomas hepáticos, en un primer paso a hidroxiciclofosfamida, transformándose espontáneamente a aldofosfamida y, posteriormente, en las células blanco se convierte en mostaza fosforamida, del que surgen cuatro metabolitos: mostaza fosforamida (activo), acroleína, carboxi-fosfamida y 4-aldofosfamida que son escasamente activos. La CF es inactivada por enzimas microsomales y hepáticas con participación activa de la citocromo P-450 (21).
El resultado final de este estudio confirma que el mejor biomodelo experimental resultó ser el de los ratones Balb/c, que difiriere significativamente con los resultados obtenidos en las ratas SD, teniendo en cuenta los valores espontáneos e inducidos en la concentración espermática y la frecuencia de espermatozoides morfológicamente anómalos en epidídimos. Esto nos permitirá utilizar esta línea de ratón con mayor eficiencia en la evaluación genotóxica y de toxicología de la fertilidad preclínica de drogas, vacunas y otros productos. Además, nos permitió sugerir el mejor uso de ratones Balb/c bridándole a esta prueba una mayor sensibilidad y robustez.
REFERENCIAS
1. Wyrobek AJ. An evaluation of the sperm morphology test in experimental animals and other sperm test in humans. Mut Res 1983;115(3):73-148.
2. Arencibia DF, Rosario LA, Rodríguez Y, Martín Y, Díaz D. Frecuencia espontánea e inducida de anomalías en la morfología de la cabeza del espermatozoide y micronúcleos en médula ósea de ratones Balb-C y OF-1. Retel 2009;24(2): 7-29.
3. EMEA. European Agency for the Evaluation of Medicinal Products. Note for Guidance on Preclinical Pharmacological and Toxicological Testing of Vaccine. London, UK: EMEA; 2001. Disponible en: http://www.emea.eu.int/pdfs/human/swp/099796en.pdf
4. FDA. Guidance for Industry. Considerations for Developmental Toxicity Studies for Preventive and Therapeutic Vaccines for Infectious Disease Indications. USA: FDA; 2006. Disponible en: http://www.fda.gov/cber/gdlns/cmcvacc.pdf
5. Domínguez A, Tamayo M, Pérez I, Salas H, Pérez O, Batista A. Evaluación citotóxica y genotóxica del adyuvante AFCo1 por el ensayo de morfología de la cabeza del espermatozoide en ratón NMRI. VacciMonitor 2009;18(3):13-7.
6. Arencibia DF, Rosario LA. El ratón como biomodelo en los ensayos de genotoxicidad, resumen de resultados finales del estudio, dos años de experiencias, Instituto Finlay, Cuba. Retel 2010; 27(1):1-8.
7. Arencibia DF, Rosario LA, Vidal A. The mouse as biomodel in genotoxicity assays, two years of experience, Finlay Institute, Cuba. VacciMonitor 2010;19(Suppl. 2):245.
8. Arencibia DF, Rosario LA, Suárez YE, Vidal A. Comparación de dos biomodelos (ratones Balb/c y ratas Sprague Dawley) en el ensayo cometa alcalino. Biocyt 2011;4(14):229-39.
9. Arencibia DF, Rosario LA, Suárez YE, Vidal A. Comparación entre dos biomodelos murinos en el ensayo de micronúcleos y de aberraciones cromosómicas en células de la médula ósea. QuímicaViva 2011;10(2):106-17.
10. CCAC. Canadian Council on Animal Care Guidelines for the use of animals in Psychology. In: Olfert ED, Cross BM, McWilliam DVM, McWilliam AA (Eds.) Ottawa: Bradda Printing Services Inc; 1997 p. 155-62.
11. Shayne CG. Animal Models in toxicology. In: Published by Shayne C Gad and Taylor & Francis Group. Toxicology: Chapter 2 and 3. The Mouse and Rats. 2nd ed. New Cork (U.S.A): LLC edition; 2007 p. 24-162.
12. Arencibia DF, Rosario LA, Morffi J, Curveco D. Desarrollo y estandarización de la técnica en tres ensayos de genotoxicidad. Retel 2009; 25(3):22-38.
13. Arruzazabala ML, Mas R, Molina V. Effects of D-004, a lipid extract from the Cuban royal palm fruit on atypical prostate hyperplasia induced by phenylephrine in rats. Drugs in R&D 2006;7:233-41.
14. Hipler U, Gorning M, Hipler B, Romer W. Stimulation and scabestrogedn-inducent inhibition of reactive oxygen species generated by rat sertoli cells . Arch Androl 2000;44:147-54.
15. Arencibia DF, Rosario LA, Curveco D. Frecuencia espontánea e inducida de anomalías en la morfología de la cabeza del espermatozoide en ratones NMRI. Retel 2009;20(1):2-14.
16. American Veterinary Medical Association (AVMA). Guidelines on Euthanasia. Formerly Report of the AVMA Panel on Euthanasia. USA: AVMA; 2007. p.1-125.
17. Arencibia DF, Rosario LA, MorffI J, Curveco D. Estrategias en las evaluaciones genotóxicas. Retel 2009;23(3):23-40.
18. ICH. International conference on harmonisation of technical requirements for registration of pharmaceuticals for human use. Harmonised tripartite guideline detection of toxicity to reproduction for medicinal products & toxicity to male fertility S5(R2) . Process the final draft is recommended for adoption to the regulatory bodies of the European Union, Japan and USA; 2005. p.1-21.
19. Tasdemir I, Tasdemir M, Tavukwosky S, Lahraman S, Biberogly K. Effect of abnormal sperm head morphology on the outcome of intracytoplasmatic sperm injection in mice. Mice Reprod 2000; 12(6):1214-7.
20. Arencibia DF, Rosario LA. Respuesta de ratones Balb/c frente a ciclofosfamida y bleomicina en el ensayo de la morfología de la cabeza del espermatozoide. REDVET 2011; 12 (2):1-13.
21. Arencibia DF, Vidal A, Rosario LA, Delgado L. Comparación de la respuesta de ratas Sprague Dawley frente a ciclofosfamida y bleomicina en el ensayo de la morfología de la cabeza del espermatozoide. ARS Pharmaceutica 2010; 51(3):155-62.
22. Rezvanfar MA, Sadrkhanlou RA, Ahmadi A, Shojaei H, Rezvanfar MC, Mohammadirad A. Protection of cyclophosphamide-induced toxicity in reproductive tract histology, sperm characteristics, and DNA damage by an herbal source; evidence for role of free-radical toxic stress. Human & Exp. Toxicol 2008;27:901-10.
23. Amri H, Batt A, Siest G. Comparison of cytochrome P-450 content and activities in liver microsomes of seven species including man. Xenobiótica 1986;16:351-8.
24. Jana NR, Sarkar S, Yonemoto J, Tohyama C, Sone H. Strain differences in cytochrome P451A1 gene expression caused by 2,3,7,8-tetrachlorordibenzo-p-dioxin in the rat liver: Role of the aryl hydrocarbon receptor and its nuclear translocator. Biochem Biophys Res Commun 1998;248:554-8.
Recibido: Abril de 2011
Aceptado: Mayo de 2011