Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Vaccimonitor
versión impresa ISSN 1025-028X
Vaccimonitor vol.20 no.3 Ciudad de la Habana sep.-dic. 2011
ARTÍCULOS ORIGINALES
Determinación de residuos de deoxicolato de sodio en formulaciones vacunales por cromatografía electrocinética micelar
Determination of Sodium deoxycolate residues in vaccinal formulation by micellar electrokinetic chromatography
Yaima Merchán1*, Silvia Lucangioli2,Clyde Carducci2,Esther María Fajardo1,Jeannete Rico3,Yolexis Tamayo1,Ileana Delgado1
1Instituto Finlay. Centro de Investigación-Desarrollo-Producción de Vacunas. A.P. 16017, Cod. 11600. La Lisa, La Habana, Cuba. email:ymerchan@finlay.edu.cu
2 Departamento de Química Analítica. Facultad de Farmacia y Bioquímica. Universidad de Buenos Aires (UBA), Argentina.
3Instituto de Nacional Oncología y Radiobiología. La Habana, Cuba
* MSc Biológicas. J' Laboratorio de Físico Química, Vicepresidencia de Control de la Calidad.
RESUMEN
El deoxicolato de sodio (DCNa) es el surfactante por excelencia empleado en la industria biofarmacéutica para la solubilización de vesículas de membrana externa. Es bien conocida la importancia que reviste el control de este metabolito en materiales biológicos, debido a su alta toxicidad para el organismo humano. Para demostrar la presencia de bajas concentraciones de este metabolito en formulaciones vacunales es necesario el empleo de una metodología altamente selectiva, sensible, específica y reproducible. En el presente reporte se utilizó la cromatografía electrocinética micelar (MEKC) en un analizador capilar de iones (Water corp. Milford MA), con una detección a 185 nm, con lámpara de mercurio. Se empleó un capilar de sílica fundida (Waters Corp. Milford MA); se evaluó la pureza de dos lotes de deoxicolato de sodio y se analizaron 15 muestras de vesículas purificadas, ingrediente farmacéutico activo de formulaciones vacunales. Los datos fueron registrados y procesados con el software Millennium TM (Waters Corp. Milford MA). Se determinó que los lotes de deoxicolato de sodio contenían 1,19% y 0,44% de ácido cólico contaminante y que el 93% de las muestras de vesículas purificadas tenían de 0 a 2,44 µg DCNa/100 µg de proteína. Los resultados obtenidos por MEKC fueron comparados con una modificación de una prueba cinética empleada para determinar ácidos biliares en sangre (Merckotest). El sistema MEKC mostró mejores resultados con respecto al Merkotest.
Palabras clave: Deoxicolato de sodio, MEKC, vesículas de membrana externa.
ABSTRACT
The sodium deoxycholate (DCNa) source is the surfactant used in the biopharmaceutical industry for the solubilization of outer membrane vesicles. It is well known the importance of control of this metabolite in biological materials due to its high toxicity for humans. To demonstrate significant small variations of this metabolite in vaccine formulations it is necessary to use a methodology highly selective, sensitive, specific and reproducible. In this report we used the micellar electrokinetic chromatography (MEKC) in a Capillary Ion Analyzer (Water corp. Milford MA) detection at 185 nm mercury lamp. It employed a fused silica capillary uncoated (Waters Corp. Milford MA). We assessed the purity of 2 lots of sodium deoxycholate and analyzed 15 samples of purified vesicles active pharmaceutical ingredient vaccine formulations. Data were recorded and processed with software Millennium TM (Waters Corp. Milford MA). It was found that lots of sodium deoxycholate containing 1.19 and 0.44% cholic acid and contaminate that 93% of the purified vesicles samples were from 0 to 2.44 mg protein DCNa/100 µg. MECK's results were compared with a kinetic test used to determine bile acids in blood (Merckotest). MECK system showed better results regarding the Merkotest.
Keywords : Sodium deoxycholate, MEKC, outer membrane vesicles.
INTRODUCCIÓN
El uso de detergentes en la industria biotecnológica está ampliamente difundido como práctica común de muchos trabajos de laboratorios, es utilizado en protocolos estándares para purificación de biomoléculas y como agentes solubilizantes en procesos biotecnológicos. La acción de un detergente en etapas de extracción y solubilización de vesículas de membrana externa (VME) resulta un proceso complejo de difícil optimización y muy dependiente de un proceso de prueba y error (1).
En la producción de la vacuna antimeningocócica serogrupo B se incluyen estas etapas en la obtención de VME de Neisseria meningitidis. El deoxicolato de sodio es el surfactante empleado en dichos procesos. El uso del mismo está sujeto al cumplimiento de especificaciones y es bien conocida la importancia que reviste el control de este metabolito en materiales biológicos, debido a su alta toxicidad para el organismo humano. Se ha reportado su actividad carcinogénica y la posible aparición de enfermedades hepatobiliares (2-3).
Para demostrar pequeñas variaciones significativas de este metabolito en formulaciones vacunales, aún cuando estos no puedan ser cuantificables por encontrarse en muy pequeñas cantidades, es necesario el empleo de una metodología altamente selectiva, sensible, específica y reproducible.
La electroforesis capilar (EC) es una herramienta de separación de biomoléculas relativamente novedosa, que en los últimos años ha tenido gran importancia en el campo de la industria biofarmacéutica; presenta la versatilidad de poder separar aminoácidos, ácidos orgánicos, iones inorgánicos, carbohidratos, esteroides, tioles, contaminantes alimenticios, material genético y algunos fármacos importantes en el estudio de diferentes ramas en el área de la salud (diagnósticos molecular y de laboratorio clínico) (4-5). Usualmente el análisis de los diferentes analitos puede realizarse en unos minutos; se requiere de pequeñas cantidades de muestra, en el rango de nanolitros, con una alta reproducibilidad y con un error estándar relativo de tiempo de migración menor a 0,5% (6).
La EC constituye un método de separación basado en la migración diferencial de moléculas sujetas a un campo eléctrico (de 100 a 500 V/cm) a través de un capilar de menos de 75 µm de diámetro. El interior del capilar se encuentra formado por los grupos silanol (Si-OH), los cuales al ser desprotonados (Si-O), elevan considerablemente el potencial de hidrógeno (pH) y favorecen la presencia de analitos específicos (7).
Como en toda electroforesis, los cationes fluyen hacia el terminal negativo, mientras que los aniones fluyen hacia el positivo, pero la inducción del alto potencial eléctrico permite que la separación sea más sensible entre las diferentes moléculas (resolución) y el tiempo de análisis sea más corto.
Estas características hacen de la EC un método eficiente y económico, con capacidad de separar cientos de componentes de forma simultánea. Cumple con muchos de los requerimientos para el control de la calidad de componentes mayoritarios y minoritarios orgánicos e inorgánicos, así como trazas en matrices simples y complejas, empleando mínimas cantidades de muestras y reactivos, razones suficientes para ser la herramienta de elección en el control de la calidad de productos farmaceúticos (8-10).
Por esta técnica es posible no solo la detección directa de analitos a bajas longitudes de onda, sino la detección UV indirecta de muchos de ellos con poca o ninguna absorción con resultados exactos y confiables (11-14).
La determinación de deoxicolato de sodio (DCNa) comúnmente se realiza por técnicas cromatográficas, pero por las características estructurales de este metabolito y su baja absorción en el UV, en ocasiones limita su detección, más aún cuando se está cuantificando residuos. Entre otros métodos utilizados están los enzimáticos, pero estos son normalmente para análisis serológicos y son poco confiables para la evaluación de residuos en productos vacunales (15, 16).
La electrocromatografía capilar es un híbrido entre la HPLC y la CE, donde se reúnen algunas de las mejores características de cada técnica por separado, por lo que tiene ventajas sobre ellas. De esta manera la misma puede usarse para la separación de especies no cargadas. Proporciona una elevada eficacia en las separaciones de microvolúmenes de disolución de muestra, sin necesidad de aplicar un bombeo de alta presión. Entre las variantes de esta técnica se encuentra: la cromatografía capilar electrocinética micelar (MECK).
Esta técnica requiere la utilización de un tensoactivo en un nivel de concentración en el cual se formen micelas, que estas son capaces de alojar compuestos no polares en su interior. La interacción de las micelas y los solutos es la que produce la separación (11-14).
El presente trabajo tiene como objetivo la determinación de residuos de deoxicolato de sodio por cromatografía electrocinética micelar como modo de la electroforesis capilar con detección UV directa en el control de formulaciones vacunales.
MATERIALES Y MÉTODOS
Materiales y reactivos
Sal de sodio del ácido desoxicólico, procedente de Merck, Alemania. Dodecilsulfato de sodio (SDS) (Sigma, EEUU), tetraborato de sodio, fosfato de sodio monohidratado, metanol y acetonotrilo fueron grado HPLC suministrado por (J.T Baker, EEUU). El agua ultrapura se obtuvo con un equipamiento EASYpureTM RF (Barnstead, EEUU). El resto de los reactivos y disoluciones empleadas fueron de grado analítico. Las soluciones y las muestras fueron filtradas utilizando membranas de nylon de 0,45 µm de porosidad (Micron Separations Inc, EEUU) y desgasificadas antes de su uso.
Equipamiento
MEKC se realizó en un analizador capilar de iones (Water corp. Milford MA). Los datos fueron colectados y procesados con el software MillenniumTM (Waters Corp. Milford MA). Se empleó un capilar de sílica fundida no recubierto de 60 cm de largo y 75 µm de diámetro interno. (Waters Corp. Milford MA, EEUU).
Sistema-CE
El procedimiento analítico por MECK se realizó empleando un sistema electrolítico formado por tetraborato de sodio (10 mmol/L), fosfato de sodio monohidratado (10 mmol/L pH 9,0) con SDS (50 mmol/L) y acetonitrilo al 10%. Se realizó una inyección hidrostática (10 cm de altura) por 18 seg; operamos a un voltaje de 25 kV, 25± 0,1 ºC de temperatura y la detección se hizo a 185 nm con lámpara de mercurio.
El capilar se acondicionó con KOH 0,5 mol/L durante 5 min y con KOH 0,1 mol/L ese mismo tiempo; posteriormente se lavó con agua ultrapura durante 8 min. Entre corridas el capilar fue acondicionado durante 3 min con la disolución electrolítica de corrida. Al finalizar el día el capilar fue lavado con KOH 0,1 mol/L durante 5 min y 10 min con agua ultrapura.
Control de pureza del deoxicolato de sodio
Se evaluaron dos lotes de sal de sodio del ácido desoxicólico (DCNa) (Merck, Alemania), uno de presentación granel y otro envasado frente a un estándar de ácido deoxicólico (DCA) (Sigma, EEUU) y ácido cólico (CA) (Sigma, EEUU).
Disolución stock y estándar
Las disoluciones de DCA y CA (Sigma) fueron preparadas en metanol a una concentración de 1 mg/mL. La disolución estándar se obtuvo de alícuotas diluidas a partir de la disolución madre en la disolución amortiguadora de fosfato de sodio 10 mmol/L - borato de sodio 10 mmol/L a una concentración final de 200 µg/mL, respectivamente. La disolución madre de DCNa se preparó a una concentración de 25 mg/mL en metanol. El estándar fue preparado en solución amortiguadora fosfato de sodio 10 mmol/L - borato de sodio 10 mmol/L con una concentración final de 5 mg/mL pH 7,4
Preparación de las muestras
El principio activo de las formulaciones vacunales (15 lotes de vesícula de membrana externa purificada) que contenían los residuos de DCNa, y conservadas en diferentes aditivos (etanol o sacarosa), fueron filtradas por centrifugación 800 g durante 10 min con membranas de nylon de 0,45 µm, desgasificadas e inyectadas directamente en el sistema.
Por otra parte, estas mismas muestras (8 lotes) fueron concentradas. Se realizó una extracción en fase sólida en columnas RP18 (Merck, Alemania). La columna fue activada con 4 mL de metanol-HPLC y 4 mL de agua ultrapura. Se sembraron en minicolumnas de forma independiente 15 mL de cada lote, se lavó con 4 mL de agua y se llevó a sequedad con aire. La elución se realizó con 4 mL de metanol-HPLC. Posteriormente, se evaporó en Rotoevaporador Re 47 (Yamato Scientific, Japón). Las muestras secas se resuspendieron en solución amortiguadora de fosfato de sodio: 1 mmol/L- borato de sodio 1 mmol/L pH 9,0 MeOH al 20%; después de concentradas fueron analizadas bajo las mismas condiciones que las muestras puras.
Se evaluaron tres réplicas de cada uno de los lotes en estudio y se determinó el valor medio de concentración para cada muestra, la desviación estándar y se calculó el coeficiente de variación:
CV= (DE/Media) x100
Donde:
DE: Desviación estándar de las réplicas de la muestra
Media: Concentración media de las réplicas
RESULTADOS y DISCUSIÓN
En la industria biofarmacéutica muchas tecnologías incorporan el uso de detergentes en las etapas de extracción y solubilización de las VME (1). La tecnología de obtención del complejo de la VME de Neissseria meningitidis serogrupo B lleva implícito el uso de DCNa a una concentración de 13,5 mmol/L en el evento de extracción, y es mantenida durante todo el proceso de semipurificación para garantizar una adecuada solubilización de dichas VME (1).
Después de eliminar una gran cantidad de contaminantes mayoritarios, las VME totales se resuspendieron en solución amortiguadora dietanolamina-deoxicolato 13,5 mmol/L (DEA-DCNa). Esta solución amortiguadora desempeña un papel muy importante en los procesos de delipidación y separación de lipopolisacáridos, entidad molecular no deseada en el producto final por su poder endotóxico. Este lipopolisacárido es finalmente separado por técnicas cromatográficas.
Sin embargo, se ha visto que el evento de extracción de VME es quien aporta mayor empirismo en los resultados finales. Las condiciones para la extracción de dichas VME han sido optimizadas; se han incluido todos los posibles parámetros desde las concentraciones óptimas: temperatura, tiempo de extracción, velocidad de agitación. No obstante, un importante criterio en la selección del detergente es el nivel de pureza que se requiere para un procedimiento específico (1). Los detergentes empleados en la producción de la vacuna son de grado "microbiológico" y no se tienen antecedentes analíticos de su evaluación en el país.
Para la realización de este estudio se controló la pureza de dos lotes de DCNa (Merck) con diferentes presentaciones: granel y envasado (1 kg), frente a los estándares de DCA y CA de Sigma. Se muestran los electroferogramas de las corridas realizadas a los estándares de DCA y CA (Sigma) y los correspondientes a los lotes de DCNa granel y envasado, respectivamente (Fig. 1).
En el electroferograma (Fig. 1) los perfiles A y B muestran los tiempos de migración (tm) de cada uno de los estándares Sigma utilizados: para el CA fue de 8,017 min y para el DCA de 9,527 min.
En el caso de los lotes de DCNa fabricados en diferentes presentaciones (envasado C y granel D) mostraron un comportamiento diferente con relación al del estándar de deoxicolato (DCA) de Sigma. Puede apreciarse en los electroferogramas para cada uno de estos lotes, un pico aproximadamente a los 9,4 min que corresponde al tiempo de migración del deoxicolato, y otro pico a los 8 min, en el que eluye del capilar el ácido cólico. Se determinó que ambos lotes evaluados presentaron ácido cólico contaminante.
El lote de DCNa granel contiene 1,19% de ácido cólico contaminante, mientras que el DCNa envasado contiene solo 0,14%. Es bueno destacar que si bien esto no constituye un aspecto significativo en el proceso de extracción-solubilización del complejo de VME, su utilización como estándar de trabajo en curvas de calibración sí puede ser cuestionable en los ensayos de cuantificación de residuos de deoxicolato en sistemas de alta sensibilidad, ya que para estos fines el estándar debe ser una sustancia con alto grado de pureza.
Determinación de residuos de deoxicolato de sodio en muestras de VME purificadas
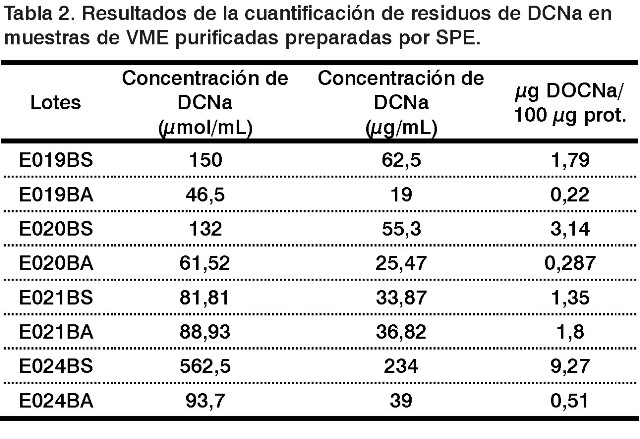
Se evaluaron un total de 15 lotes de VME purificadas, conservadas en sacarosa y en etanol. La cuantificación de los residuos de deoxicolato de sodio se realizó utilizandouna curva de calibración de concentración en función del área normalizada de 6 puntos (12,5-400 µg/mL). De la regresión lineal resultó un r = 0,9967. Los resultados del análisis de cuantificación se muestran en la Tabla 1.
Los valores residuales de deoxicolato de sodio son muy bajos, cercanos al límite de cuantificación (30 µg/mL), que son los establecidos en la validación de esta metodología (Tabla 1). Por ello se decidió emplear la extracción en fase sólida (SPE) como método de concentración de muestras que permitiera corroborar los resultados obtenidos.
Se observa un perfil de un electroferograma típico de una muestra conservada en sacarosa y otra en agua. Los perfiles muestran que el método es capaz de detectar residuos de DCNa (Fig. 2).
Al evaluar la repetibilidad del método, obtuvimos CV <5% en todos los casos, lo que demuestra que este posee una buena precisión, teniendo en cuenta que es un procedimiento cromatográfico de detección de impurezas, para los que se ha referido que CV menores e iguales a 10% pueden ser aceptados (17).
Después de preparadas las muestras por SPE y evaluadas por MEKC se obtuvieron resultados similares (Tabla 2), lo que sugiere que a pesar de estar trabajando en un rango bajo de concentraciones el sistema electroforético empleado es capaz de detectar trazas de deoxicolato de sodio hasta niveles muy bajos.
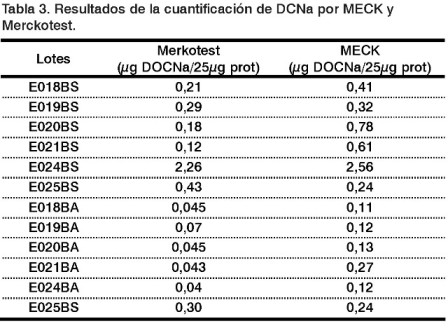
Los resultados de la cuantificación de los residuos de DCNa por MECK fueron comparados con una prueba cinética empleada para determinar ácidos biliares en sangre (Merckotest 14352). Ambos métodos permiten la cuantificación de estos residuos para este tipo de muestra (Tabla 3).
En el caso de la prueba cinética para su implementación fue necesario realizar algunos ajustes debido a la complejidad de la muestra, ya que la prueba estaba diseñada para ácidos biliares en sangre y no es específica para DCNa. Los valores obtenidos por el Merckotest fueron mucho más bajos en el límite de cuantificación del método.
Este trabajo demuestra que el método MEKC resultó ser capaz de cuantificar pequeñas concentraciones de DCNa en muestras complejas (VME de membrana externa) de manera rápida y con bajo consumo de reactivos. Es un método fácil de realizar y es robusto, lo cual es adecuado para su implementación en los laboratorios.
REFERENCIAS
1.Rodríguez Cabrera M, González Fernández P, Bayolo Guanche PJ, Barrera Padrón Z. Caracterización preliminar del desoxicolato de sodio de los proveedores Merck y Fluka.Revista CENIC Ciencias Químicas 2005;36(4). Disponible en: http://revista.cnic.edu.cu/revista/files/CQ-2005-4-CQ-022.pdf
2.Rotunda RM, Suzuki H, Moy RL, Kolodney MS. Detergent effects of sodium deoxycholate are a major feature of an injectable phosphatidylcholine formulation used for localized fat dissolution. Derm Surg 2004;30(7):1001-8.
3.Rotunda AM and Kolodney MS. Lipomas treated with subcutaneous deoxycholate injections.J Amer Acad Derm 2005; 53:973-8.
4.García-canas V, Cifuentes A. Detection of microbial food contaminants and their producís by capillary electromigration techniques. Electrophoresis 2007;28:4013-30.
5.Martínez-Gómez MA, Carril-Aviles MM, Sagrado S, Villanueva-Camanas RM, Medina-Hernández MJ. Characterization of antihistamine-human serum protein interactions by capillary electrophoresis.J Chromatogr A 2007;1147(2):261-9.
6. Magaña JJ, de la Luz Arenas-Sordo M, Gómez R. La electroforesis capilar como una nueva estrategia en la medicina y el diagnóstico clínico.Rev Méd Chile 2009;137:946-56.
7.Liu X, Dahdouh F, Salgado M, Gómez FA. Recent advances in affinity capillary electrophoresis (2007).J Pharm Sci 2009;98: 394-410.
8.Wallingford RA, Ewing AG. Capillary electrophoresis.Adv Chromatogr 1989;(29):1-76.
9.Lamari FN, Gioldassi XM, Mitropoulou TN, Karamanos NK. Structure analyisi of lipoglycans and lipoglycan-derived carbohydrates by capillary electrophoresis and mass spectrometry.Biomed Chromatogr 2002;16:116-26.
10.LiJ Thibault P, Martín A, Richard JC, Wakarchuuk WW, Van del Wilp W. Development of an on line preconcentration method for the analysis of pathogenic lipopolysaccharides using capillary electrophpresis-electrossprespay mass spectrometry. Application to small colony isolates.J Chormatogr A 1998;817:325-36.
11.Rodríguez V, Lucangioli S, Fernández Otero G, Carducci C. Determination od bile acids in pharmaceutical formulations using micellar electrokinetic chromatography. Journal of Pharmaceutical and Biomedical Analysis 2000;23:375-81.
12.Lucangioli S, Rodríguez V, Fernández G, Carducci C. Determination of related impuretties of bile acids in bula drugs by ciclodextrin-modified micellar electrokinetic chromatography. Journal of capillary electrophoresis. Shelton: ISC Technical Publication; 1997.
13.López-Avila V, van de Goor T, Bohuslav G, Coufal P. Separation of haloacetic acids in water by capillary zone electrophoresis with drect UV detection and contactless conductivity detection. J Chromatogr A 2003;993:143-152.
14.Ackermans MT, Everaerts FM, Beckers JL. Quantitative analysis in capillary zone electrophoresis with conductivity and indirect UV detection. J Chromatogr A 1991;549:345-55.
15.Rudolph WG, Planella J, Bernal A, Correa J, Salazar J. Variaciones diurnas de los ácidos biliares totales sanguíneos en el equino: efectos del ayuno. Av Cs Vet 1998;13(1):16-20.
16.Mac Faddin. Biochemical test for identification of medical bacteria. 2 ed. Baltimore: Williams and Wilkins;1980.
17.Rudd DR. Suitability of Analytical methods for stability testing. Is the room for Improvement? Journal of Validation Technology 2001;5(3):255-61.
Recibido: Abril de 2011
Aceptado: Junio de 2011