Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Vaccimonitor
versión impresa ISSN 1025-028X
Vaccimonitor vol.21 no.2 Ciudad de la Habana mayo-ago. 2012
ARTÍCULO ORIGINAL
Anticuerpos IgY en ensayos de látex-aglutinación
IgY antibodies in latex-agglutination assay
José Raúl Dopico,1* Mario Álvarez,1 Ana Isabel Juvier,2 Janette Trujillo,2 Giselle Reyes,3 María Cristina Pico,4 Isis Casadelvalle,4 Isabel Giraldino1
1 UEB Diagnosticadores, Empresa de Producción de Biológicos "Carlos J Finlay". Infanta # 1162 esq Manglar. CP 10300. Centro Habana, La Habana, Cuba.
2 Centro de Inmunoensayo. Calle 134 y Ave 25 Playa. AP. 6653. La Habana, Cuba.
3 Instituto Finlay. Centro de Investigación-Desarrollo-Producción de Vacunas. Ave. 27 No. 19805, La Lisa. AP. 16017 Cod. 11600. La Lisa, La Habana, Cuba.
4 Facultad de Biología, Universidad de La Habana. Calle 25 #455 entre J e I. Plaza. CP 10400. La Habana, Cuba.
email:jrdopico@finlay.quimefa.cu
* Especialista A en Ensayos Físicos-Químicos y Mecánicos, Licenciado y Máster en Bioquímica
RESUMEN
Los anticuerpos aviares (IgY) presentan algunas ventajas con relación a los anticuerpos IgG de mamíferos, debido a su fácil obtención y purificación y su bajo costo de producción. El objetivo de este trabajo fue estudiar la factibilidad de acoplar anticuerpos IgY a partículas de poliestireno y evaluar su desempeño en ensayos de látex-aglutinación en lámina. Para este propósito se utilizó como modelo la detección del antígeno de superficie de la hepatitis B (HBsAg). Gallinas Leghorn se inmunizaron con el ingrediente farmacéutico activo que se utiliza en la elaboración de la vacuna recombinante cubana Heberbiovac-HB. Los anticuerpos obtenidos se purificaron y emplearon en la preparación de reactivos de látex-aglutinación (0,8 µm) para la detección del HBsAg, los cuales se evaluaron con 50 muestras de suero frente a un reactivo comercial similar. Los resultados se evaluaron de satisfactorios. Se demostró la factibilidad de acoplar anticuerpos aviares a partículas de látex y se abre una perspectiva al empleo de este tipo de ensayo para el diagnóstico rápido de diversas enfermedades.
Palabras clave: Anticuerpos aviares, tecnología IgY, látex, aglutinación
ABSTRACT
Avian antibodies (IgY) display some advantages in relation to the mammalian IgG antibodies due to its easy procedure for generation and purification and besides for its lower production cost. The objective of this work was to analyze the feasibility of binding IgY antibodies to polystyrene particles and to evaluate its performance in latex-agglutination tests in slide. For this purpose, the detection of hepatitis B surface antigen (HBsAg) was used as a model. Leghorn hens were immunized with the active pharmaceutical ingredient (MPA) used in the manufacturing of the Cuban recombinant vaccine Heberbiovac HB . The obtained antibodies were purified and used in the preparation of the latex particles (0.8 µm) for the detection of the HBsAg by agglutination. The performance of the test was evaluated with 50 serum samples against similar commercial reagent. The results obtained were satisfactory and demonstrated the feasibility of binding such avian antibodies to latex particles. These results open a perspective to the use of this type of assay for the rapid diagnostic of many diseases.
Keywords : Avian antibodies, IgY technology, latex, agglutination
INTRODUCCIÓN
Los anticuerpos aviares resultan una atractiva alternativa para la elaboración de inmunoensayos para el diagnóstico, en particular, porque pueden extraerse de la yema del huevo donde se encuentran con una elevada concentración (6-20 mg/mL). La inmunoglobulina Y deriva su nombre, precisamente, del término inglés "yolk" (yema) y constituye el isotipo principal presente en la yema, con una masa molecular de 160 y 190 kDa. Aunque se le compara con la IgG de los mamíferos, posee características estructurales que la diferencian (1). El estudio, producción y aplicación de los anticuerpos aviares obtenidos a partir de la yema de los huevos es lo que se conoce como "tecnología IgY".
Otras ventajas de los anticuerpos aviares son la capacidad del sistema inmunológico de las aves para producir anticuerpos contra antígenos altamente conservados de mamíferos (2) y que no presentan reactividad con el factor reumatoide (FR), término que agrupa aquellos autoanticuerpos dirigidos contra determinantes antigénicos del fragmento Fc de las moléculas de IgG (3).
A pesar de estas y otras ventajas, en la actualidad no existen en el mercado diagnosticadores que utilicen estos anticuerpos. Su mayor aplicación ha sido en las investigaciones y no existen reportes de su desempeño en ensayos de látex aglutinación.
Desde hace algunos años, la Empresa de Producción de Biológicos "Carlos J Finlay" se encuentra trabajando en la producción de anticuerpos aviares de interés diagnóstico (4). Por ser los reactivos de látex aglutinación en lámina una de las principales líneas de producción y desarrollo de esta empresa, se decidió estudiar la factibilidad de acoplar anticuerpos IgY a partículas de poliestireno y evaluar su desempeño en ensayos de látex aglutinación. Con este propósito se utilizó como modelo la detección del antígeno de superficie de la hepatitis B, porque se contaba con el ingrediente farmacéutico activo (MPA) de la vacuna recombinante Heberbiovac-HB y un sistema ultramicroanalítico (UMELISA anti-HBsAg) para la titulación de los anticuerpos (5).
MATERIALES Y MÉTODOS
Se inmunizaron dos gallinas blancas ponedoras Leghorn (G1 y G2) con el MPA de la vacuna recombinante Heberbiovac-HB, producida por el Centro de Ingeniería Genética y Biotecnología (CIGB). La inmunización se realizó por vía intramuscular con dosis de 100 µg del inmunógeno cada 30 días, utilizando el adyuvante completo de Freund en la primera dosis e incompleto en las restantes, hasta completar un total de ocho inmunizaciones durante ocho meses. Después de la primera y segunda inmunizaciones se colectaron los huevos los días 10, 20 y 30; a partir de la tercera inoculación, la recogida se realizó a los 15 y 30 días posteriores a cada inoculación hasta llegar a un total de 30 posturas (6).
Purificación de IgY
La yema de huevo se separó manualmente de la clara y se le cortó su membrana para extraer el contenido. Para la eliminación de los lípidos se tomaron 10 mL de yema, a los que se adicionaron 40 mL de solución amortiguadora de Tris salino (TBS) con agitación constante. Seguidamente, se añadieron, gota a gota, 3 mL de sulfato de dextrana al 10%. Luego de 5 min de agitación se adicionaron 7,5 mL de CaCl2 1 mol/L, sin interrumpir la agitación; la mezcla se centrifugó a 3.600 rpm durante 25 min, descartándose el precipitado (7).
Para la extracción de los anticuerpos se midió el volumen del sobrenadante y se le adicionó un volumen igual de Na2SO4 al 34%. La mezcla se centrifugó en las mismas condiciones, anteriormente descritas.
En esta ocasión se tomó el precipitado y se le adicionaron 23 mL de Na 2 SO 4 al 17%. Este paso se repitió y al segundo precipitado se le añadieron 23 mL de Tris-HCL 60 mmol/L con 3,45 g de Na2 SO4 . Al nuevo precipitado se le adicionaron 23 mL de Na2SO4al 15%. Todas estas centrifugaciones se realizaron en un equipo Eppendorf 5415C a 12 000 rpm durante 10 min. El precipitado final se restituyó en 10 mL de glicina-NaCl 8,5 g/L 0,2 mol/L pH 8,2 (glicina-NaCl). Finalmente, se realizó una primera diálisis contra agua destilada para eliminar el Na2SO4 , y una segunda contra la solución amortiguadora de glicina-NaCl. Los anticuerpos purificados se conservaron a -20 o C (8).
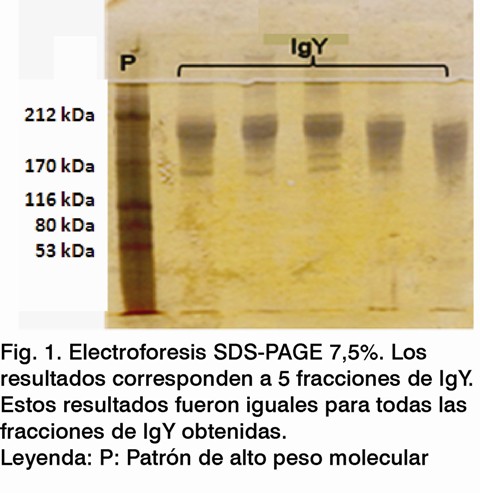
A cada una de las fracciones de IgY obtenidas se le midió la densidad óptica a 280 nm en un espectrofotómetro UV/VIS para determinar su concentración (e=13,2) (9), y se les realizó una electroforesis en gel de poliacrilamida en presencia de dodecil sulfato de sodio (PAGE-SDS), empleando geles al 7,5% (10). Se utilizaron los patrones de masa molecular: miosina 212 kDa, a2-macroglobulina 170 kDa, b-galactosidasa 116 kDa, transferrina 80 kDa y glutamato dehidrogenasa 53 kDa. Finalmente, a todas las fracciones se les ajustó la concentración a 1 mg/mL con solución amortiguadora de glicina-NaCl.
Titulación de anticuerpos IgY anti-HBsAg
A cada una de las fracciones de IgY, obtenidas del proceso de purificación y correspondientes a todos los huevos colectados durante el período de estudio, se le determinaron los niveles de anticuerpos anti-HBsAg mediante un sistema ultramicroanalítico (UMELISA anti-HBsAg), desarrollado por el Centro de Inmunoensayo (5). De acuerdo con el título de anticuerpos las fracciones correspondientes a cada una de las gallinas se agruparon en tres mezclas: M1 (>500 000 UI/L), M2 (100 000-500 000 UI/L) y M3 (<100 000 UI/L)
Preparación de los reactivos y ensayos de látex-aglutinación
Se prepararon seis reactivos de látex-IgY con los anticuerpos procedentes de cada una de las mezclas de IgY (M1, M2 y M3) de las dos gallinas sin diluir. A 1 mL de cada mezcla de IgY se le añadieron 100 µL de suspensión de látex, se agitaron 2 h a temperatura ambiente, se centrifugaron a 12.000 rpm durante 5 min en el equipo Eppendorf 5415C y se lavaron tres veces en la solución glicina-NaCl.
Posteriormente, se evaluó la estabilidad de cada variante de la forma siguiente: en una lámina de fondo oscuro se depositaron en la zona de reacción 20 µL del reactivo de látex y 20 µL de solución amortiguadora, se mezclaron las 2 gotas y se observó la preparación durante 5 min. Si se mantenía homogénea se consideraba estable, si se producía aglutinación se desechaba (11).
De forma similar, para realizar los ensayos de aglutinación con el látex-IgY se mezclaron, en una lámina de fondo oscuro, 20 µL del reactivo de látex-aglutinación (látex-IgY) con 20 µL de muestra. Para dispensar los volúmenes se usaron micropipetas automáticas (Eppendorf). La lectura se realizó visualmente bajo una buena iluminación. La aglutinación se evaluó con cruces (1+, 2+, 3+, 4+) en correspondencia con su intensidad. El título correspondió a la última dilución que dio resultado positivo. Se consideró el resultado positivo (+) o negativo (-) si se producía o no aglutinación en 5 min de reacción (11).
La presencia del FR en los sueros se determinó mediante el reactivo Látex-FR producido en la propia Empresa "Carlos J Finlay".
Evaluación de los ensayos de látex-IgY
Se evaluaron las seis variantes de látex-IgY en paralelo con un reactivo comercial de principio similar, de la firma francesa Elitech. Este reactivo se basa en una suspensión de partículas de látex recubiertas con anticuerpos monoclonales con una sensibilidad de 20 ng/mL.
La evaluación de los látex-IgY se efectuó frente a un panel de 25 muestras positivas y 25 muestras negativas, clasificadas mediante el sistema UMELISA anti-HBsAg (5), procedentes del Instituto de Gastroenterología.
Para comparar el desempeño del ensayo de látex-IgY frente al reactivo comercial de principio similar se confeccionó una tabla de contingencia 2X2 y se calcularon la sensibilidad (S = PV/PV+NF x 100%), la especificidad (E = NV/NV+PF x 100%) y los valores predictivos positivo (VPP = PV/PV+PF x 100%) y negativo (VPN = NV/NV+NF x 100%). El coeficiente kappa (Kp ) se determinó por el software estadístico Vassar Starts y se valoró según los márgenes propuestos (12)
RESULTADOS
Obtención de inmunoglobulina Y
La concentración media de inmunoglobulina Y en las fracciones fue 9,85 ± 0,81 mg de IgY por mL de yema, lo que está en el rango 6-20 mg/mL informado por otros autores (2) (Tabla 1).
El patrón típico de las electroforesis en SDS-PAGE, usando el método de tinción con nitrato de plata correspondiente a las fracciones de IgY, puede observarse en la Figura 1. Una sola banda entre 170 y 212 kDa arrojó la electroforesis, lo cual coincide con la masa molecular de la IgY que se encuentra entre 160 y 190 kDa (1,10). Estos resultados, junto con los de la electroforesis, demuestran la reproducibilidad del método empleado para la purificación de la IgY y permiten concluir que es adecuado para los propósitos de la investigación.
Respuesta y titulación de anticuerpos IgY anti-HBsAg
El estudio cinético de la respuesta de anticuerpos anti-HBsAg mediante el UMELISA anti-HBsAg mostró que los niveles de anticuerpos comenzaron a elevarse a partir de la tercera inmunización para ambas gallinas y alcanzaron un máximo alrededor de los 15 días después de cada reactivación con una caída relativa en el entorno de los 30 días (Fig. 2).
Esto coincide con lo informado por otros autores (2) que plantean que el período útil para la recolección de los huevos es a partir de la tercera inmunización (títulos ³100 000 UI/L). Se puso de manifiesto la necesidad de mantener la presencia del antígeno (inmunizaciones periódicas) para sostener los títulos de anticuerpos en estas aves. Aunque la cinética de producción de anticuerpos fue similar para las dos gallinas, la G2 alcanzó mayores niveles de anticuerpos anti-HBsAg que la G1 (2 209 500 UI/L vs 1 142 000 UI/L). En ambos casos los mayores niveles se lograron después de la cuarta inmunización (Tabla 1 y Fig. 2).
Se logró un rendimiento de unos 3 g de IgY por gallina durante los seis meses posteriores a la tercera inmunización.
Evaluación de los ensayos de látex-IgY
Las seis variantes de látex-IgY, preparadas con las tres mezclas de anticuerpos IgY (M1, M2, M3) de las dos gallinas, sin diluir, se mantuvieron homogéneas durante 2 min.
Este es el criterio de estabilidad que usualmente se emplea cuando se preparan reactivos de látex-aglutinación (11).
El estudio del desempeño de los 6 ensayos de látex-IgY frente al panel de 50 muestras arrojó que solo aquellos que se prepararon con las mezclas de anticuerpos de títulos mayores de 100 000 UI/L fueron capaces de producir aglutinación (Tabla 2).
La intensidad de la aglutinación fue mayor para los anticuerpos G2, a los que correspondieron los títulos más altos de anticuerpos anti-HBsAg. Se evidenció una alta sensibilidad (92%) de los ensayos de látex-IgY; solo dos de las muestras positivas no pudieron ser detectadas, coincidiendo en ambas la presencia del FR. Los resultados con las muestras negativas para HBsAg fueron los esperados. Las 25 muestras dieron negativas con las seis variantes del reactivo de látex-IgY, al igual que frente al látex comercial y al de FR.
El procesamiento estadístico demostró la alta especificidad y sensibilidad del ensayo de látex aglutinación para HBsAg (Tabla 3), aún considerando que el reactivo de referencia utilizado pudiera haber dado como positivos falsos las dos muestras que contenían concentraciones elevadas de factor reumatoide.
DISCUSIÓN
La tecnología IgY reemergió en los años noventa del siglo pasado en un escenario poco favorable para su desarrollo en el campo del inmunodiagnóstico, invadido por los anticuerpos policlonales de conejos y caprinos y los monoclonales de ratón, cuya eficacia estaba más que demostrada.
No resulta extraño que los seguidores de esta nueva tecnología en el mundo sean pocos, entre los que se destacan aquellos que abogan contra el sufrimiento de los animales (2,3).
A pesar de estas realidades, no se debe desestimar la producción de anticuerpos IgY como una alternativa, dada sus ventajas.
Las aves, especialmente las gallinas, son más fáciles de manipular que los animales que se utilizan habitualmente en las inmunizaciones, ya que no requieren de sangrado para la obtención de los anticuerpos que pasan a la yema de los huevos, toleran bien las inmunizaciones, y los adyuvantes tradicionales inducen buenas respuestas contra antígenos filogenéticamente relacionados, dando rendimientos similares o superiores a los obtenidos en mamíferos (7). A esto se suma que la IgY, a diferencia de los anticuerpos IgG de mamíferos, no une el FR, lo que la hace particularmente útil en las pruebas serológicas (13).
Considerando las ventajas de los anticuerpos aviares, si se quiere asumir su producción, se hace necesario tener en cuenta que los métodos y procedimientos habituales de obtención de anticuerpos no pueden extrapolarse a la tecnología IgY.
La composición de la yema del huevo como fuente de extracción, rica en material lipídico, y las diferencias estructurales de la IgY con las IgG de mamíferos (14) hacen que los métodos y procedimientos tradicionales para la obtención de anticuerpos no sean útiles en aves y que se requiera el estudio y adecuación de esquemas de inmunización, métodos de purificación y sistemas de evaluación de anticuerpos IgY.
Esta investigación se ha inspirado en tales propósitos y tomó como modelo la producción de anticuerpos anti-HBsAg en gallina para elaborar un ensayo de látex-aglutinación. La necesidad de altas concentraciones de anticuerpos para lograr la aglutinación en los ensayos de látex-IgY pudo estar dado por la rigidez de la molécula IgY que, a diferencia de la IgG de los mamíferos, presenta un dominio constante, adicional, en sustitución de la bisagra.
Al evaluar los seis ensayos de látex-IgY y compararlos con el reactivo de la firma francesa Elitech, de principio similar pero que utiliza anticuerpos monoclonales de ratón, se observó una buena correspondencia (Kp=0,96) en los resultados.
Se exceptúan dos muestras positivas del panel que dieron negativas con los seis ensayos de látex-IgY, pero que fueron identificadas con el látex comercial. Esto apunta a un menor grado de sensibilidad de los ensayos preparados con los anticuerpos aviares, que puede ser mejorado técnicamente con empleo de partículas de látex de diámetro más pequeño. Está reportado que al disminuir el tamaño de la partícula de látex se puede favorecer la agregación, por estar más cerca una partícula de otra.
En el caso de la IgY, una molécula menos flexible que los anticuerpos IgG de mamíferos, pensamos que es conveniente probar esta opción que podría mejorar la detectabilidad de cualquier ensayo que utilice anticuerpos aviares en el recubrimiento. Aunque no se descarta que en esa menor sensibilidad pudiera también haber influenciado el factor reumatoide (11).
Consideramos que los resultados obtenidos en esta investigación ponen de manifiesto que estamos en presencia de una tecnología aplicable a la industria farmacéutica. Las limitaciones que se le podrían adjudicar a la producción de anticuerpos en aves se resuelven con una adecuación de las condiciones para el mantenimiento de los animales, la purificación de los anticuerpos a partir de la yema de huevo y los métodos de titulación.
Una vez definidas estas condiciones, la tecnología IgY puede resultar más sencilla y económica que aquellas que se utilizan en la producción de anticuerpos policlonales de mamíferos, en particular cuando se trabaje con antígenos altamente conservados (2).
REFERENCIAS
1. Sun S, Mo W, Ji Y, Liu S. Preparation and mass spectrometric study of egg yolk antibody (IgY) against rabies virus. Rapid Commun. Mass Spectrom 2001;15(9):708-12.
2. Behn I, Hommel U, Oertel M, Hauschildt S. Kinetics of IgY formation after immunization of hens with different protein antigens. Altex 1996;96(13):18-21.
3. Gutiérrez E, Cruz ME, Samon CT, Vázquez E, Corona Z, Schade R. Extraction of a monospecific coomb-reagent from chicken eggs. Altex 2003;03(20):21-5.
4. Díaz-Machado L, Giraldino I, Soria K, la Rosa E, Vega F. Evaluación de anticuerpos antiproteína C reactiva obtenidos en gallina en un ensayo de látex aglutinación. Rev Cubana Farm 2003;37(3). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_issuetoc&pid=0034 -751520030003&lng=pt&nrm=iso . Consultado: Abril de 2012.
5. Rodríguez L, Balmaceda A, Bravo J, Trujillo J, Martínez L, Díaz M, et al. Validación de un UltramicroElisa de detección de anticuerpos contra el antígeno de superficie de la hepatitis B. Revista Cubana de Medicina Tropical 1996;48(1):45-9.
6. Pico MC, Otero A, Giraldino I. Producción de anticuerpos policlonales. Inmunología Experimental. La Habana: Editorial Félix Varela;1997.
7. Tini M, Jewel UR, Camnisch G, Chilov D, Gassmann M. Generation and aplication of chicken egg-yolk antibodies. Comp Biochem Physiol 2002;131(17):569-74.
8. García A, Santiago R, Arévalo A, Torres O, Duque S. Obtención, purificación y caracterización de anticuerpos policlonales (IgY) desarrollados en gallinas dirigidos contra aislamientos colombianos de Giardias duodenales. Revista Biomédica 2005; 25(4):451-63.
9. Leslie GA, Clem LW. Phylogen of immunoglobulin structure and function of the immunoglobulin chicken. Journal of Experimental Medicine 1969;130(6):1337-52.
10. Sensitive Silver Staining. Development Technique File No 210: 80-1311-98. PhastSystem, 1st edition. Uppsala, Sweden: Pharmacia LKB Biotechnology;1991.
11. Molina-Bolívar JA, Galisteo-González F. Latex immunoagglutination assays. J Macromolecular Science-Polymer Reviews 2005; 45(1):59-98.
12. Ochoa R, Martínez JC, Estrada E, García AM, Ferriol X, Blanco R, et al. Validación de inmunoensayos cualitativos usados para evaluar la inmunogenicidad de vacunas. VacciMonitor 2000; 9(1):17-20.
13. Chacana PA, Terzolo HR, Gutiérrez Calzado E, Shade R. Tecnología IgY o Aplicaciones de los Anticuerpos de yema de huevo de gallina. Rev Med Vet 2004;85(5):179-89.
14. Shimizu M, Nagashima H, Sano K, Hashimoto K, Ozeki M, Tsuda K. Molecular stability of chicken and rabbit immunoglobulin G. Biosc Biotech Biochem 1992;56(2):270-4.
Recibido: Abril de 2011
Aceptado: Diciembre de 2011