Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Vaccimonitor
versión impresa ISSN 1025-028X
Vaccimonitor vol.21 no.3 Ciudad de la Habana sep.-dic. 2012
ARTÍCULO ORIGINAL
Caracterización de aislamientos clínicos de Leptospira por métodos fenotípicos y moleculares en la República de Nicaragua
Phenotypic and molecular characterization of Leptospira clinical isolations from the Republic of Nicaragua
Luis Alfredo Rosario,1* Daniel Francisco Arencibia, 2** Niurka Batista,2 William Jirón, 3 Yolanda Emilia Suárez, 4 Juan Francisco Infante 2
1 Departamento de Tecnología Farmacéutica, Instituto de Farmacia y Alimentos (IFAL), Universidad de La Habana. Calle 222 e/ 25 y 27, La Coronela, La Lisa, La Habana, Cuba.
2 Vicepresidencia de Investigaciones. Instituto Finlay. Calle 17 e/ 198 y 200, Atabey, Playa, La Habana, Cuba. AP 16017.
3 Escuela de Veterinaria (UNAN), León, Nicaragua.
4 Universidad Agraria de la Habana (UNAH), San José a carretera Tapaste, San José de Las Lajas, Mayabeque, Cuba. email:darencibia@cecmed.sld.cu
* Licenciado en Microbiología, Profesor Instructor, Aspirante a Investigador y Máster en Farmacología, Profesor Principal de la Asignatura de Microbiología Farmacéutica
**Autor de correspondencia: Dr. en Medicina Veterinaria y Zootecnia, Diplomado en Epidemiología Veterinaria, Máster en Microbiología Veterinaria
RESUMEN
En este trabajo se caracterizaron ocho cepas de Leptospira, aisladas de casos clínicos en Nicaragua mediante métodos fenotípicos y moleculares, las cuales no mostraron crecimiento a 13 °C ni en medio suplementado con 8-azaguanina (2,25 mg/mL). Se observó la conversión a formas esféricas a los 60 min de estar expuestas en un medio suplementado con NaCl 1M. Para la caracterización molecular de los aislamientos se realizó la reacción en cadena de la polimerasa (RCP) de genes conservados con cepas patógenas, cuyos productos génicos confieren virulencia al microorganismo ( ompL1 y lipL32 ). Los resultados de este ensayo demostraron la presencia de bandas de amplificación de los genes ompL1 y lipL32 para los ocho aislamientos, lo que permite afirmar que los microorganismos analizados constituyen cepas de Leptospira patógenas, según los métodos fenotípicos y moleculares recomendados.
Palabras clave: leptospira, métodos fenotípicos, RCP.
ABSTRACT
This paper present the phenotypic and molecular characterization of eight strains of Leptospira isolated from Nicaragua clinical cases. The phenotypic characterization results showed absence of cell growth on culture media incubated at 13 °C or 8-azaguanina (2.25 mg/mL) supplemented medium. Besides a conversion to spherical shapes at 60 min to exposure NaCl 1M supplemented medium was observed. The molecular characterization was carried out by polymerase chain reaction (PCR) of ompL1 and lipL32 genes stored with pathogen strains. The results demonstrated the presence of amplified bands for both genes on eight strains, which allow to affirm that the analyzed microorganisms are Leptospira pathogens strains.
Keywords : leptospira , phenotypic methods, PCR.
INTRODUCCIÓN
La leptospirosis es una zoonosis bacteriana de las más difundidas en el mundo (1). El agente causal de esta enfermedad es una bacteria helicoidal con una motilidad activa, que se agrupa en cuatro especies saprófitas y 12 patógenas, con alrededor de 250 serovares (2).
Debido a las afecciones que produce en el hombre y los animales, así como por su repercusión económica en los países desarrollados y en vías de desarrollo, constituye una importante y permanente preocupación para la medicina humana y veterinaria (3).
En Cuba existe un programa de lucha contra la leptospirosis que incluye la vacunación profiláctica para humanos y animales con los productos vacunales vax-SPIRAL ®, del Instituto Finlay, y Polivalente- Leptospira , de los Laboratorios Biológicos Farmacéuticos (LABIOFAM). Estas vacunas son de células enteras inactivadas, con o sin adyuvante, respectivamente, que incluyen en sus formulaciones a los serovares de mayor circulación en el país (1).
En algunos países de la región, como la República de Nicaragua, se han producido importantes epidemias asociadas, fundamentalmente con eventos climatológicos severos. Durante los meses de octubre y noviembre del 2007 este país sufrió grandes inundaciones provocadas por el huracán Félix, que condujeron al desarrollo de brotes de leptospirosis, fundamentalmente en los departamentos de León y Chinandega. De estos brotes especialistas cubanos aislaron ocho cepas de Leptospira de pacientes con evidencia epidemiológica y sintomatológica, característica de la leptospirosis (4).
Para la República de Nicaragua la leptospirosis es una enfermedad endémica, en especial en algunos de sus departamentos, con alta frecuencia de presentación de casos clínicos asociados a eventos climatológicos extremos, como las lluvias intensas y medianas (4-6).
Esta prevalencia es sostenida en el tiempo y en cualquier condición por la existencia de factores de riesgo que lo favorecen, tales como: roedores, problemas de higiene, baja percepción de riesgos, así como inadecuadas prácticas agrícolas y de crianza de animales (4-6). Además, no existen prácticas de reducción de riesgos en humanos, incluida la vacunación, que permitan la disminución de la vulnerabilidad de la población humana y animal a la enfermedad y que contribuyan a disminuir su prevalencia.
El objetivo de nuestro trabajo fue la caracterización de ocho aislamientos clínicos de Leptospira en la República de Nicaragua por métodos fenotípicos y moleculares, obtenidos a partir de la epidemia de leptospirosis del año 2007.
MATERIALES Y MÉTODOS
Cepas en estudio
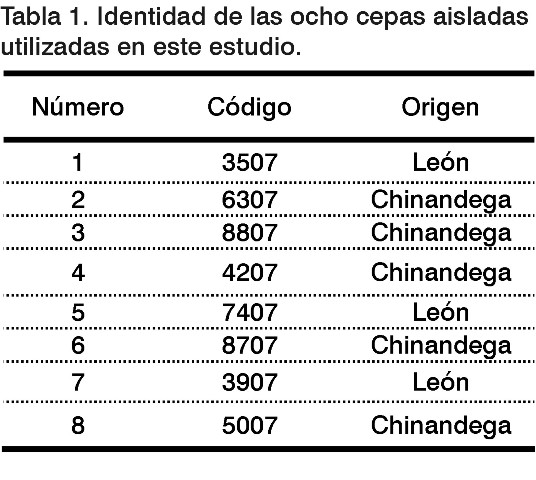
En este estudio se utilizaron ocho cepas procedentes de pacientes con evidencias clínicas y epidemiológicas de la enfermedad leptospirósica del brote ocurrido en los departamentos de León y Chinandega, la parte más noroccidental de la República de Nicaragua (Tabla ).
Todas las cepas se cultivaron en medio líquido Ellinghausen-McCullough-Johnson-Harris (EMJH) (7,8) a 28 °C y se conservaron en medio semisólido Fletcher a una temperatura entre 28-30 °C.
Se mantuvieron mediante cultivos semanales en el medio proteico EMJH, bajo condiciones estáticas a 28-30 °C (7).
Diferenciación de las cepas aisladas entre patógenas y saprófitas mediante métodos fenotípicos y moleculares
Métodos fenotípicos (convencionales)
Crecimiento a 13 °C
Esta prueba se realizó a los ocho aislamientos clínicos en este orden: 7407, 6307, 4207, 8807, 3507, 8707, 3907, 5007. Se utilizó la cepa patógena L. interrogans serovar Canicola como control positivo y la cepa no patógena L. biflexa serovar Patoc (ATCC), como control negativo.
Se procedió a inocular 0,1 mL de medio de cultivo, proveniente de un cultivo estático de 5-7 días en el medio proteico EMJH, a una concentración ajustada de 7,5 x 10 6 células/mL (conteo directo de células en cámara de Petroff-Hausser) con cada una de las cepas utilizadas en 10 mL de medio fresco y luego fueron incubadas a una temperatura de 13 °C (8).
Seguidamente el crecimiento fue verificado a los 7, 14, 21 y 30 días postinoculación mediante la observación en el microscopio de campo oscuro. En cada muestreo, además, se evaluaron las características culturales como motilidad y uniformidad celular y se realizaron controles de pureza a los cultivos mediante tinción de Gram, siembra en caldo triptona soya y caldo tioglicolato. La evaluación de cada cepa se realizó por triplicado (8).
Crecimiento en medio suplementado 8-azaguanina (2,25 mg/mL)
Se realizó esta prueba a los ocho aislamientos clínicos en este orden: 7407, 6307, 4207, 8807, 3507, 8707, 3907, 5007. Se utilizó la cepa patógena L. interrogans serovar Canicola como control positivo y la cepa no patógena L. biflexa serovar Patoc (ATCC) como control negativo.
Se preparó una suspensión de 8-azaguanina a una concentración de 2,25 mg/mL con agua destilada (8). Luego se diluyó la suspensión con un agitador magnético y se esterilizó el frasco que contenía la suspensión de 8-azaguanina durante 20 min a 121 °C. Se tomó 1 mL estéril de esta suspensión y se mezcló de forma mecánica con 9 mL en medio EMJH fresco.
Posteriormente, se inoculó 0,1 mL del medio de cultivo proveniente de un cultivo estático de 5-7 días en el medio proteico EMJH, a una concentración ajustada de 7,5 x 106 células/mL (conteo directo de células en cámara de Petroff-Hausser), que contenía cada una de las cepas a evaluar en medio fresco y se incubó a una temperatura de 28 °C.
Se chequeó el crecimiento a los 7, 14, 21 y 30 días postinoculación mediante la observación en el microscopio de campo oscuro (8). En cada muestreo, además, se evaluaron las características culturales como motilidad y uniformidad celular y se realizaron controles de pureza a los cultivos mediante tinción de Gram, siembra en caldo triptona soya y caldo tioglicolato. La evaluación de cada cepa fue realizada por triplicado (8).
Conversión a formas esféricas en NaCl a 1M
En este ensayo se evaluaron los ocho aislamientos clínicos y las cepas L. interrogans serovar Canicola (control positivo) y L. biflexa serovar Patoc (ATCC) (control negativo). Para ello se preparó una suspensión de NaCl 1M, esterilizada por filtración (8). Se adicionó asépticamente 1 mL de la misma en 7 mL de medio EMJH fresco.
Se procedió a inocular 0,7 mL de una suspensión celular de cada una de las cepas a investigar por triplicado, provenientes de un cultivo estático de 5-7 días en el medio proteico EMJH, a una concentración ajustada de 7,5 x 106 células/mL (conteo directo de células en cámara de Petroff-Hausser).
Se incubó a una temperatura de 28 °C por 2 h; pasado este tiempo se procedió a chequear las formas esféricas mediante observación en el microscopio de campo oscuro cada 20 min/1 h. La evaluación de cada cepa fue realizada por triplicado (8).
Método Molecular
Reacción en cadena de la polimerasa (RCP)
Se realizó la RCP al ADN extraído de los ocho aislamientos clínicos en este orden (7407, 6307, 4207, 8807, 3507, 8707, 3907, 5007). Se utilizaron como controles una cepa vacunal L. interrogans serovar Canicola (control positivo), una cepa L. biflexa serovar Patoc (ATCC) (control negativo) y por último una cepa de Treponema pallidum spp (ATCC). En la amplificación del gen ompL1 se utilizó un patrón de peso molecular de 1000 pb (Promega). Para el caso de la amplificación del gen lipL32 se utilizó un patrón de peso molecular al inicio 4521 (Promega), y al final un patrón de peso molecular 720-20 pb.
La extracción del ADN para la amplificación por la RCP se realizó por el método de shock osmótico y calentamiento (9). A cada extracción de ADN después se le aplicó el método de la RCP, descrito por Gravekamp, et al, 1993; Vaganova, et al, 2010 (9,10). Los genes lipL32 y ompL1 fueron amplificados. La LipL32 es una proteína con 272 aminoácidos y el gen tiene 423 pb. En cambio la OmpL1 es una proteína de 31 kDa, 320 aminoácidos y un gen con 960 pb. Los cebadores utilizados fueron:
lipL32 (F) 5´-CGCTGAAATGGGAGTTCGTATGATT-3´
lipL32 (R) 5´-CCAACAGATGCAACGAAAGATCCTTT-3´
ompL1 (F) 5´-TTGATTGAATTCTTAGAGTTCGTGTTTATA-3´
ompL1 (R) 5-AGGAGAAGCTTATGATCCGTAACATAAGT-3´
Para una reacción la mezcla de RCP preparada fue de 50 µL. Las muestras fueron amplificadas con el uso de un termociclador Applied Biosystems GeneAmp, utilizando 0,5 µL del iniciador hacia delante, 100 µM (100 pmol/µL), 0,5 µL del iniciador de sentido reverso, 100 µM (100 pmol/µL), 0,5 µL de mezcla de dNTP que contenía 25 mM de cada uno de los deoxinucleótidos: dATP, dCTP, dGTP, dTTP (Amersham Pharmacia), 0,125 µL de deoxinucleótido dUTP 100 mM (Amersham Pharmacia), 5,0 µL de tampón 10x de RCP (GeneAmp 10 x Tampón para RCPII), 6 µL de solución de MgCl 2 25 mM, 0,2 µL de ADN polimerasa AmpliTaq (5U/µL), 0,5 µL de uracil glicosilasa (1U/ µL) (9,10). Luego se agregó 10-30 µL de la muestra a la mezcla de la RCP. Posterior a esto se agregó agua destilada para un volumen final de 50 µL. Finalmente, se procedió a agregar dos gotas de aceite mineral.
La concentración final del tampón fue de 10 mM Tris HCL, pH 8,3, 50 nM KCL, 3 mM MgCl2 . Se utilizó la uracil N-glicosilasa (UNG) para la RCP diagnóstica (9,10). El programa de RCP fue de 10 min a 36 °C para permitir la acción de la UNG, seguida de 5 min a 94 °C, para inactivar posteriormente la UNG y separar las hebras de ADN. Seguido de 35 ciclos de 1 min a 94 °C (desnaturalización del ADN), 1 min a 55 °C (unión del cebador) y 2 min a 72 °C de extensión del iniciador por la polimerasa termoestable (9,10). Luego se incubó a una temperatura de 72°C. Para visualizar los productos de RCP (8 µL) se revelaron mediante electroforesis en geles de agarosa al 2% teñido con bromuro de etidio en buffer TBE 1X. Luego de observar el gel en un transiluminador con UV, una muestra se consideró positiva al revelarse la banda de 423 pb para el caso del gen lipL32 y para el caso del gen de la porina OmpL1 al revelarse la banda de 960 pb (9, 10).
RESULTADOS Y DISCUSIÓN
Prueba de crecimiento a 13 °C
Las cepas patógenas para mantener su crecimiento y antigenicidad necesitan crecer en medios de cultivos adecuados a temperatura de 28-30°C, siendo más lo característico de las cepas saprófitas aisladas de aguas estancadas y suelo como medio más favorable el crecimiento a estas bajas temperaturas (11). Las ocho cepas evaluadas y la cepa vacunal control del proceso L. interrogans serovar Canicola no experimentaron crecimiento a una temperatura de 13°C. En cambio se observó crecimiento en la cepa control L. biflexa serovar Patoc (ATCC). En los medios de cultivo donde el microorganismo creció presentaba motilidad y uniformidad celular.
Los hallazgos en los estudios de genómica y proteómica plantean marcadas diferencias en relación con la sobrevivencia frente a agentes externos entre cepas patógenas. Por ejemplo, L. interrogans puede sobrevivir por un tiempo relativamente largo fuera del hospedero; sin embargo, L. borgpetersenii es dependiente del hospedero y a temperaturas diferentes a las del mismo y la acción de los rayos utltravioletas conducen a la pérdida de su antigenicidad y la muerte (12,13). Esta última especie para su supervivencia en el medio ambiente depende de una humedad alta del suelo, un pH neutro o ligeramente alcalino y la presencia de materia orgánica. Igualmente, se encontraron similitudes entre especies patógenas que constituyen un punto divergente con especies saprófitas. Las especies L. interrogans y L. borgpetersenii tienen un número relativamente bajo de genes de transcripción ARN (ARNt) a diferencia de L. biflexa que presenta 35 genes de ARNt. Los investigadores consideran que el rápido crecimiento de L. biflexa está determinado por tener un mayor número de ARNt capaces de expresarse a temperaturas tan bajas como 13 °C (12,13).
Prueba de 8-azaguanina (2,25 mg/mL)
Las diferencias entre patógenas y saprófitas es justamente la inhibición del crecimiento de las primeras en un medio de cultivo selectivo rico en 8-azaguanina, pues no tienen la capacidad de incorporar bases de pirimidina exógenas en sus ácidos nucleicos (8,14). En este medio las leptospiras saprófitas crecen bien, en tanto las patógenas cesan su crecimiento después de 1-2 generaciones (8,14). Las ocho cepas en estudio no experimentaron crecimiento en medio suplementado con 8-azaguanina (2,25 mg/mL), por lo que se destaca su susceptibilidad a este compuesto, el cual inhibe su crecimiento. De igual forma no se observó crecimiento en la cepa vacunal control del proceso L. interrogans serovar Canicola y sí en la cepa control L. biflexa serovar Patoc (ATCC).
Para Leptospira se plantea que debido a la riqueza proteica de los medios utilizados para su cultivo en caso de encontrar contaminantes estos aparecen en el medio líquido alrededor de los 3-4 días postinoculación (8,14). Así mismo, la apariencia y motilidad de las leptospiras está en dependencia de la naturaleza del medio en que crecieron.
En el medio líquido en que se cultivó la cepa L. biflexa serovar Patoc (ATCC) las células aparecieron torcidas o enganchadas a uno o ambos extremos, donde se observaron los tres tipos de movimientos: el de rotación alrededor de un eje central, el progresivo y el circular (7). Haber observado cepas saprófitas de Leptospira con gran motilidad, típico de un crecimiento bajo condiciones favorables, reafirma la clasificación de los ocho aislados como patógenos, en los cuales no se observó crecimiento, ni movimiento de ninguno de los tipos anteriormente descritos.
Las diferentes especies de Leptospira presentan otro grupo de similitudes y diferencias metabólicas que también contribuyen a su desarrollo y que por tanto pueden, igualmente, ser explotados para el desarrollo de medios o condiciones diferenciales. Tanto las cepas saprófitas como las patógenas utilizan ácidos grasos de cadena larga (Tween), como fuente de carbono y las sales de amonio como fuente de nitrógeno (12). L. biflexa sintetiza la isoleucina por la vía piruvato y por la vía de la treonina; en cambio, L. interrogans y L. borgpetersenii sintetizan isoleucina solo por la vía del piruvato (12). Todas poseen mecanismos para contrarrestar el estrés oxidativo, pero se diferencian en los complejos enzimáticos presentes en cada caso. L. biflexa posee las enzimas superóxido dimutasa, ausentes en las especies patógenas y la enzima catalasa está presente en L. interrogans y L. borgpetersenii , pero ausente en L. biflexa (14).
Conversión a formas esféricas en NaCl (1M)
Producto de la alta sensibilidad y conformación elástica de la membrana citoplasmática de las cepas patógenas de Leptospira, estas adoptan una forma esférica ante la introducción de una suspensión de NaCl (1M), lo que conduce a que se observen como pequeñas bolitas de forma brillante en el microscopio de campo oscuro (8).
En este experimento se observó la conversión a formas esféricas de las ocho cepas aisladas. De igual forma se observó en la cepa patógena L. interrogans serovar Canicola. A los 20 min de aplicado el NaCl 1M se experimentó gran conversión a formas esféricas en las ocho cepas evaluadas y en la cepa control L. interrogans serovar Canicola. A medida que avanzaba el tiempo, hasta los 60 min, tiempo máximo evaluado, el 100% de las células observadas al microscopio de campo oscuro experimentaban forma esférica, comportamiento típico de las cepas patógenas (15).
En cada uno de los intervalos de tiempo de evaluación se monitorearon las características culturales de cada cepa evaluada. Tanto en las ocho cepas como en las dos cepas controles se observaron leptospiras motiles con una adecuada uniformidad celular. Solo en el caso de las ocho cepas evaluadas y la cepa patógena L. interrogans serovar Canicola (control positivo), fueron observadas la uniformidad celular al final del tiempo evaluado (60 min de haber sido expuestas al medio de cultivo fresco que contenía NaCl 1M). En estas cepas la conversión a formas esféricas fue ganando homogeneidad en cada toma de muestra a medida que avanzaba el tiempo.
De igual forma en cada evaluación se determinó, a la par de las características culturales, los controles de pureza del cultivo. No se observaron contaminantes en ninguna de las tres réplicas realizadas de los cultivos de las ocho cepas aisladas y los dos controles utilizados. Esto favorece la trazabilidad de los resultados de este experimento, ya que esta prueba se realizó con cultivos totalmente puros.
Las cepas saprófitas mantuvieron su forma de espiral al ser expuestas en este compuesto, lo que coincide con la alta resistencia a la conversión planteada para estos microorganismos (16). Se ha reportado la alta resistencia ante la presencia en el medio de los iones Cu y NaHCO3(1 mg/mL). Logran también un alto crecimiento en presencia de colorantes inhibidores como el verde de malaquita y fucsina básica (8).
Reacción en cadena de la polimerasa (RCP)
El desarrollo de novedosas técnicas de biología molecular desempeña un papel importante en el diagnóstico temprano de la leptospirosis, el cual está enfocado a la detección directa de secuencias blanco de ADN de leptospiras en muestras clínicas. Los métodos basados en el ADN, tales como la hibridación, RCP y Southern blot que emplean secuencias específicas, han permitido la identificación de especies de leptospiras patógenas y no patógenas. La RCP aplicada a Leptospira se ha estudiado con el fin de diferenciar cepas saprófitas de patógenas. Además, se utiliza con éxito en estudios epidemiológicos, lo que aporta un mayor grado de información al determinar la identidad (serogrupo/serovar específico) de las cepas circulantes (17).
Para determinar si una cepa es patógena o no se utilizan dos metodologías de RCP que se diferencian fundamentalmente en el cebador utilizado (9). En este sentido algunos investigadores establecen el uso de un cebador del 16S o 23S ARNs ribosomal y otros utilizan cebadores de genes que se obtienen a partir de proteínas bien conservadas en las especies de leptospiras patógenas, las cuales le confieren patogenicidad a este microorganismo (9,17).
Estas proteínas conservadas se clasifican en estructurales y funcionales. Las mismas se encuentran formando parte de la membrana externa de la pared celular de especies patógenas.
Una proporción grande de tales proteínas la forman las lipoproteínas con una abundancia relativa en la superficie celular: LipL32> LipL21> LipL41> LipL36> LipL45>LipL48 (2, 7, 12). Otras proteínas de la membrana interna como la porina OmpL1 (18), la proteína (T2SS) tipo dos o de sistema de secreción y la secretina GspD (12), también localizada en la membrana exterior. Dentro de las proteínas de mayor reconocimiento se encuentran las lipoproteínas y las porinas (12).
Aunque en nuestro estudio las cepas de interés crecieron adecuadamente para la realización de las pruebas fenotípicas, la edad de los cultivos y el estado de conservación de los mismos nos obligó a tomar como medida de precaución la realización simultánea de ambos métodos (fenotípicos y moleculares), previendo la pérdida de la capacidad de algunos de los cultivos de crecer en medios artificiales aún después de ser inoculados por animales susceptibles. Resultado que en no pocas ocasiones tiene lugar durante el trabajo y manipulación con las cepas patógenas de Leptospira.
En nuestro ensayo fueron amplificados los genes lipL32 y ompL1 , ya que está demostrado que estos genes son muy conservados en cepas patógenas de Leptospira y no están presentes en cepas saprófitas. Sus productos génicos confieren una alta capacidad inmunogénica, lo que los ha convertido en blancos para el desarrollo de candidatos vacunales (17).
Los resultados de la Figura 1 muestran la amplificación del gen ompL1 . En los carriles del 2 al 10 se observan las bandas características en el rango de las 960 pb, los cuales pertenecen en primer lugar a la cepa patógena L. interrogans serovar Canicola (control positivo) y luego las ocho cepas aisladas en esta investigación. De igual forma no se observó una banda en el carril 11 que pertenece a una cepa saprófita y tampoco en el carril 12 perteneciente a muestras procedentes de Treponema pallidum spp (ATCC).
La porina OmpL1 no se encuentra en cepas saprófitas, pues es típica de especies patógenas, ya que participa de forma activa en los mecanismos de entrada del microorganismo al tejido. Estas interactúan al igual que las lipoproteínas con el sistema inmune del hospedero (18,19). Tanto las porinas como la OmpL1 son proteínas integrales de membrana con asas expuestas en la superficie, que forman un poro o canal hidrofílico en la bicapa lipídica, permitiendo el paso de iones y nutrientes hidrosolubles (18).
Una vez amplificado el gen de la proteína OmpL1 se procedió a amplificar el gen lipL32 , cuyos resultados se observan en la Figura 2. Como se puede apreciar los carriles del 2 al 10 pertenecen a cepas patógenas y en ellos se observan las bandas típicas del gen lipL32 , el cual se encuentra en el rango de los 423 pb. El carril 2 pertenece a la cepa patógena L. interrogans serovar Canicola (control positivo) y del carril 3 al 10 se encuentran las cepas bajo investigación.
El carril 11 pertenece a una cepa no patógena y en el mismo no se observó resultados que están en conjunción con los hallados en la amplificación del gen ompL1 .
Tampoco fue observada la banda en el carril 12, el cual pertenece a Treponema pallidum spp (ATCC), aunque es una espiroqueta no presenta esta proteína como componente antigénico (10,17).
Las lipoproteínas en general carecen de segmentos transmembranal y el segmento polipeptídico, generalmente hidrofílico, se encuentra anclado a la membrana mediante residuos de ácidos grasos unidos covalentemente al extremo N-terminal de la cisteína (10, 17).
Aunque en el presente estudio se amplificaron genes de virulencia mediante RCP, se debe especificar que el ensayo no fue realizado con ese objetivo y que el mismo no es indicativo absoluto de esta propiedad. Utilizando cebadores de genes para proteínas conservadas en Leptospira solo es posible predecir si la cepa problema es patógena o saprófita. Se utiliza el RCP para distinguir cepas patógenas de saprófitas con fin diagnóstico (10, 17).
La sola presencia de un gen de una proteína implicada en la virulencia del microorganismo no determina que el mismo sea virulento. El gen puede estar presente pero no ser expresado; además, en la mayoría de las bacterias, incluyendo Leptospira, los factores de virulencia son redundantes (4). Para una determinada propiedad del microorganismo relacionado con la virulencia del mismo existen más de un factor de virulencia vinculado con la propiedad en cuestión. Con el objetivo de mejorar la sensibilidad también se ha utilizado con diferentes grados de éxito la combinación entre la RCP y la técnica serológica de MAT para determinar especies patógenas, así como diagnosticar de forma rápida en etapas tempranas la leptospirosis (20, 21).
En un estudio comparativo se evaluó la habilidad de la RCP para detectar ADN de Leptospira en muestras clínicas de pacientes con epidemiología y manifestaciones clínicas compatibles con leptospirosis, comparando esta técnica con la prueba MAT, utilizada en la confirmación de casos, pues es considerada la prueba de referencia (20).
Los resultados obtenidos demostraron que la RCP es capaz de detectar leptospiras en sangre antes que los anticuerpos puedan ser detectados por la prueba MAT, lo que afianza la hipótesis que relaciona el período leptospirémico como la fase de toma de muestra más adecuada y el éxito de la RCP en sueros (20). La RCP tiene como ventajas la confirmación rápida del diagnóstico en la fase inicial de la enfermedad y la detección del ADN del microorganismo, no dependiendo de la viabilidad del agente (20, 21). El punto crítico de la técnica RCP para el caso de Leptospira lo constituye la etapa de extracción del ADN, debiéndose ajustar a los diferentes tejidos y fluidos (20,21).
Los resultados obtenidos con esta técnica confirman los anteriores por métodos convencionales. Por lo que queda demostrado que las ocho cepas aisladas son patógenas. Estas cepas, además de presentar los genes ompL1 y lipL32 , no presentan crecimiento a 13 °C y tampoco en medio suplementado con 8-azaguanina (2,25 mg/mL). Además, se observó conversión a formas esféricas a los 60 min de estar expuestas en medio fresco suplementado con NaCl 1M.
La disposición de cepas de Leptospira patógenas provenientes de aislados clínicos resulta de gran importancia para estudios epidemiológicos y de patogénesis. En este caso, aunque las cepas sean positivas para los genes de lipL32 y ompL1, exclusivos de cepas patógenas, no es un indicativo de virulencia debido, en primer lugar, al carácter redundante de los factores de virulencia y en, segundo lugar, a los sistemas de regulación a los que está sometida la expresión génica.
La virulencia de estos microorganismos debe ser determinada en biomodelos susceptibles, pues en la actualidad ninguna de las proteínas descritas como factores de virulencia constituye un marcador definitivo de esta propiedad, lo que constituye nuestra recomendación.
REFERENCIAS
1. OPS. Enfermedades desatendidas. Enfermedades de la pobreza. Washington: OPS; 2009. Disponible en: http://www.paho.org/Spanish/AD/DPC/CD/psit-nd-poster.htm.
2. Adler B, de la Peña M. Leptospira and Leptospirosis. Veterinary Microbiology 2009;2:4382-92.
3. Levett P, Morey R, Galloway R, Steigerwalt A. Leptospira broomii sp. nov, isolated from humans with leptospirosis. International Journal System Evolution Microbiology 2006;56:671-3.
4. Rosario LA, Batista N, Arencibia DF, Valdés BY, Jirón W, Duttman CH. Efficacy of Leptospiral vaccine (vax-SPIRAL® ) against challenge with strains isolated from leptospirosis epidemic in Nicaragua using the hamster as biomodel. Veterinary World 2012;5(1):5-12.
5. NTO-Nicaragua. Norma Técnica Obligatoria Nicaragüense de Prevención y Control de la Leptospirosis Humana. NTON 24 001-05. La Gaceta 2006;27(2):1-53.
6. Batista N, Arencibia DF, Rosario LA, Jirón W, Duttman CH. Perfil antigénico celular de cepas aisladas de Leptospira en León y Chinandega, Nicaragua. ARS Pharmaceutical 2011;52(4):12-7.
7. Adler B, De La Peña M. Pathogenesis of Bacterial Infections in Animals. In: Gyles CL, Prescott JF, Songer G, Thoen CO Leptospira , 4 th ed. Hoboken, New Jersey, USA: Wiley-Blackwell; 2010. p.527-47.
8. Tepstra W, Hartskeerl R, Smits H, Korver H. International Course in Laboratory Techniques for the Diagnosis of Leptospirosis. Amsterdam: Royal Tropical Institute; 2006.
9. Gravekamp C, Van de Kemp H, Franzen M, Carrington D, Schoone GJ, Van Eys GJ, et al. Detection of seven species of pathogenic leptospires by PCR using two sets of primers. Journal General Microbiology 1993;139:1691-700.
10. Vaganova A, Freilikhman O, Stoyanova N, Tokarevich N. Interspecific Polymorphism of Gene lipL32 Restriction Profiles of Pathogenic Leptospires. Bull Experimental Biology Medical 2010;149(5):609-11.
11. Gallegos A, Sandí V. Leptospirosis. Rev Medicina Costa Rica Centroamericana 2010;592:115-21.
12. Xue F, Yan J, Picardeau M. Evolution and pathogenesis of Leptospira spp : lessons learned from the genomes. Microbiology Infection 2009;11:328-33.
13. Picardeau M, Bulach D, Bouchier C, Zuerner R, Zidane N, Wilson P, et al. Genome sequence of the saprophyte Leptospira biflexa provides insights into the evolution of Leptospira and the pathogenesis of leptospirosis. PLoS ONE 2008;3:1599-1607.
14. Ristow P, Bourhy P, Kerneis S. Biofilm formation by saprophytic and pathogenic leptospires. Microbiology 2008; 154:1309-17.
15. Slack A, Khairani-Bejo S, Symonds M, Dohnt M, Galloway R, Steigerwalt A. Leptospira kmetyi spp . nov, isolated from an environmental source in Malaysia. International Journal System Evolution Microbiology 2009;59:705-8.
16. Louvel H, Picardeau M. Genetic manipulation of Leptospira biflexa. Current Protocol Microbiology 2007;12(1):25-32.
17. Hernández P, Díaz C, Dalmau E, Quintero G. A comparison between polymerase chain reaction (PCR) and traditional techniques for the diagnosis of leptospirosis in bovines. Journal Microbiology Methods 2011;84(1):1-7.
18. Feng C, Li Q, Zhang X, Dong K, Hu B, Guo X. Immune strategies using single-component LipL32 and multi-component recombinant LipL32-41-OmpL1 vaccines against leptospira Braz. Journal Medical Biology Research 2009;42(9):796-803.
19. Dong H, Hu Y, Xue F, Sun D, Ojcius D, Mao Y, et al. Characterization of the ompL1 gene of pathogenic Leptospira species in China and cross-immunogenicity of the OmpL1 protein. BMC Microbiology 2008;8:223-7.
20. Moreno N, Agudelo P. Aplicación de las pruebas de PCR convencional simple y múltiple para la identificación de asilamientos de Leptospira spp. en Colombia. Revista Peruana Medicina Experimental Salud Pública 2010;27:548-56.
21. Vital J, Balassiano I, Oliveira F, Costa A, Hillen L, Pereira M. Multiplex PCR-based detection of Leptospira in environmental water samples obtained from a slum settlement. Memoria Instituto Oswaldo Cruz 2010;105(3):353-5.
Recibido: Marzo de 2012
Aceptado: Mayo de 2012