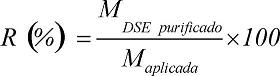Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Vaccimonitor
versión impresa ISSN 1025-028X
Vaccimonitor vol.22 no.1 Ciudad de la Habana ene.-abr. 2013
ARTÍCULO ORIGINAL
Cromatografía de adsorción para purificar el disacárido espaciador del ingrediente farmacéutico activo de la vacuna QuimiHib®
Adsorption chromatography to purify Spacer disaccharide of Active Pharmaceutical Ingredient of QuimiHib® vaccine
Belinda Díaz,1* Lázaro Heynngnezz,1 Alejandro Beldarraín,2 Yadira Iser,1 Abel Fernández,1 Jesús Díaz,1 Rainier Duarte,1 Yuliasne García1, Yaima Martorell,1 Iván Manuel Sosa1
1 Producción Vacuna QuimiHib®. Centro de Ingeniería Genética y Biotecnología. Ave 31 e/ 158 y 190. CP 10600. La Habana, Cuba.
2 Comité Técnico de Analítica. Consejo de Calidad del Polo Científico. Calle 198, número 1712, Cubanacán, Playa, La Habana, Cuba.
email: belinda.diaz@cigb.edu.cu
* Ingeniera Química y Máster en Ciencias en Ingeniería de los Procesos Biotecnológicos.
RESUMEN
En este trabajo se estudiaron las condiciones de la cromatografía de adsorción en Silicagel 60 para la purificación del disacárido espaciador (DSE), componente del ingrediente farmacéutico activo de la vacuna QuimiHib®. Para ello se realizó un desescalado a una escala analítica que representó el 1,8% del proceso industrial. Se logró reproducibilidad en términos de calidad de empaque, pureza y recobrado entre ambas escalas. Se determinó que la capacidad dinámica de carga de la resina Silicagel 60 por el DSE fuera de aproximadamente 125±0,2 mg/mL de resina empacada; 3,4 veces superior al proceso base. El perfil de elución que se obtuvo indicó la posibilidad de colectar una fracción única en el rango 195±2 y 260±2 min. Si se mantiene un correcto empaque de la resina cromatográfica, determinado por un factor de asimetría entre 0,8 y 1,2 se garantiza un recobrado de 58,9±4,5% y una pureza equivalente a la del patrón de referencia en el análisis por cromatografía de capa delgada. El ajuste de la condición de adsorción incrementa la productividad de la operación en 3,5 veces, indicando que la propuesta es económicamente factible.
Palabras clave: cromatografía de adsorción, disacárido espaciador, vacuna, Haemophilus influenzae.
ABSTRACT
In this paper we study the conditions of adsorption chromatography on Silica gel 60 for purification of Spacer disaccharide a component of Active Pharmaceutical Ingredient (API) of QuimiHib® vaccine. For that, we made a scale down on an analytical scale that represented at 1.8% of industrial process, indicating reproducibility between two procedures in terms of packing efficiency, purity and recovery. Dynamic binding capacity of the resin Silicagel 60 by the DSE was roughly 125±0.2 mg /mL, 3.4 times the base process. The elution profile obtained, showed the possibility of collecting a unique fraction at range 195±2 and 260±2 minutes, if it is maintained a proper packing of the chromatography resin determined by asymmetry factor from 0.8 to 1.2, which ensures a recovery of 58.9±4.5% and high purity analyzed by Thin Layer Chromatography. Adjusting the adsorption conditions increases the productivity of chromatographic operation up to 3.5 fold, indicating that it is feasible in economic terms.
Key words: adsorption chromatography, Spacer disaccharide, vaccine, Haemophilus influenzae.
INTRODUCCIÓN
El avance que ha experimentado la química, la ingeniería genética y la biotecnología en las últimas dos décadas han permitido el desarrollo y la aparición de un gran número de productos y procesos biotecnológicos de nueva generación, así como la sustitución de otros que se realizan en la actualidad por procesos convencionales. Un ejemplo de ellos es la vacuna cubana QuimiHib®, efectiva contra Haemophilus influenzae tipo b (Hib) (1).
Hib es un importante patógeno humano que por muchos años, antes de la introducción de la vacunación, constituía el principal responsable de tres enfermedades invasivas en la edad pediátrica: meningitis, neumonía y epiglotitis en el mundo (2-4).
La Organización Mundial de la Salud (OMS) estima que Hib causa, aproximadamente, 3 millones de casos con enfermedades serias y 400.000 muertes anuales (5). Casi todas las víctimas son niños menores de 5 años y los más vulnerables son los niños entre 4 y 18 meses. El 50% de los infantes que sobreviven aún con tratamiento antimicrobiano sufre de secuelas neurológicas permanentes (2-5).
El ingrediente farmacéutico activo (IFA) de la vacuna QuimiHib® está formado por unidades repetitivas de ribosa- ribitol-fosfato (polisacárido capsular de Hib) conjugado a una proteína portadora. A diferencia de las vacunas tradicionales, la fracción sacarídica empleada es un polisacárido, el cual se obtiene por síntesis química y después es conjugado a la proteína anatoxina tetánica (1).
Para alcanzar este objetivo se utiliza un disacárido, peracetato de ribosa-ribitol, como espaciador (DSE) que posibilita la conjugación del polisacárido a la proteína y expone el antígeno de forma más accesible al sistema inmunológico. El DSE es sintetizado químicamente y purificado por cromatografía de adsorción de fase normal empleando la resina cromatográfica Silicagel 60 dentro del proceso de síntesis, por lo que se requiere altos niveles de pureza y eficiencia del proceso de purificación (6).
En este trabajo se estudiaron nuevas condiciones de adsorción para purificar el DSE por Silicagel 60 para incrementar la productividad de la separación cromatográfica.
MATERIALES Y MÉTODOS
Los materiales utilizados, todos con la calidad requerida, fueron: acetato de etilo, acetona, metanol, etanol y ácido sulfúrico, suministrados por Applichem, Alemania, más la trietilamina para síntesis y la resina cromatográfica Silicagel 60, suministradas por Merck, Alemania. Las muestras se omaron del proceso de fabricación industrial y la preparación de las diferentes soluciones se realizó en correspondencia con los procedimientos vigentes.
Cromatografía de adsorción de fase normal en Silicagel 60 para purificar el DSE
El procedimiento industrial para la purificación del DSE utiliza una columna 7 x 50 cm/cm (Buchi, Suiza) empacada con Silicagel 60, utilizando una presión de aire comprimido a 1 MPa. Después de equilibrada la resina cromatográfica con dos volúmenes de columna de acetato de etilo, se aplica un material impuro de DSE a una capacidad de carga de 36,4 mg/mL de resina empacada y una concentración de 0,5 g/mL de acetato de etilo. Durante la aplicación las impurezas poco polares no son adsorbidas por la resina cromatográfica.
Para la elución del DSE se utiliza una mezcla de acetato de etilo, metanol, trietilamina 60:20:0,4 v/v en cuatro volúmenes de columna. La velocidad de flujo lineal es mantenida a 78 cm/h y la separación es seguida a 257 nm debido a la presencia de los grupos bencilos expuestos en la molécula del DSE. El pico de elución se fracciona a intervalos regulares y las muestras obtenidas analizadas por cromatografía de capa delgada (CCD). Aquellas que se corresponden con el patrón de referencia del DSE son mezcladas y secadas en un rotoevaporador Büchi modelo R205, con baño termostatado, a una velocidad de rotación de 100 rpm por 4 h a 40 °C. El DSE purificado es cuantificado en términos de masa por pesada y el recobrado del proceso cromatográfico determinado por la siguiente ecuación:
Donde: R, recobrado (%), MDSE purificado, masa de DSE purificado y Maplicada, masa de DSE impuro aplicada.
Después de cada ciclo cromatográfico la resina cromatográfica es regenerada con dos volúmenes de columna de la misma mezcla utilizada en la elución y reequilibrada con acetato de etilo para reiniciar un nuevo ciclo de purificación (6).
Capacidad dinámica de unión del DSE en la resina Silicagel 60
La capacidad dinámica de unión (Q) del DSE en la resina Silicagel 60 se determinó en modo frontal en una columna 0,94 x 25 cm/cm, aplicando cantidades crecientes de volumen de la muestra del producto purificado y no purificado por unidad de volumen de resina empacada, hasta alcanzar un máximo de absorbancia (A). La velocidad de flujo lineal, la concentración inicial de la muestra y la altura de la matriz se mantuvieron siempre constantes. La curva de ruptura fue construida representando los valores de A/Ao frente a Q.
La capacidad dinámica de unión fue calculada por la siguiente ecuación (8):![]()
Donde: Q, capacidad dinámica de unión (g/mL); Co, concentración inicial de la muestra (g/mL); t, tiempo (min); Qv, flujo volumétrico (mL/min) y Vg, volumen de resina empacado (mL).
La máxima capacidad de adsorción de la resina Silicagel 60 por el DSE se correspondió con el punto de ruptura, donde la curva cambia la pendiente. El valor máximo y su 50% fueron las capacidades de cargas seleccionadas para la evaluación de las nuevas condiciones de adsorción para purificar el DSE.
Condiciones para el desescalado
La escala analítica representó el 1,8% de la escala industrial, es decir 1/58 veces, donde se utilizaron los principios del desescalado en cromatografía. Se mantuvieron constantes la velocidad de flujo lineal, la altura de la resina empacada y la capacidad de carga aplicada de DSE por volumen de resina empacada, donde variaron los diámetros de columna, los volúmenes de proceso y los flujos volumétricos (7, 8). Antes de cada corrida cromatográfica se evaluó la calidad del empaque de la columna. Para ello se aplicó una solución de acetona en acetato de etilo al 2%, con una velocidad lineal de 78 cm/h y una longitud de onda de 280 nm. La eficiencia del empaque de la columna se determina por el cálculo del factor de asimetría (As), platos teóricos (N) y la altura del plato teórico (H) (8). Todas las corridas cromatográficas se realizaron en un sistema cromatográfico con un detector de arreglo de diodos Smartline (Knauer, Alemania), donde se utilizó el paquete informático ChromGate 3.1.7 (Knauer, Alemania) para la adquisición, procesamiento y análisis de los datos.
Pureza del DSE por CCD
Para realizar el análisis de pureza de las fracciones se utilizó la CCD, para lo cual se empleó placas cromatográficas con soporte de Silicagel 60 (CCD F254) suministradas por Merck. Las muestras se aplicaron a 0,05 cm del borde inferior con un capilar fino de vidrio. Para el desplazamiento se utilizó una mezcla de acetato de etilo, metanol, trietilamina a 60:20:0,4 v/v. La placa se reveló con la solución de ácido sulfúrico en etanol al 5%. Se consideraron como fracciones puras aquellas que alcanzaban un factor de retención similar al patrón de referencia equivalente a Rf=0,45±0,01.
Productividad
La productividad como masa de DSE purificado en un ciclo cromatográfico fue determinada por la ecuación (8):![]()
Donde: P, productividad (mg/mL min), Q, carga (mg/mL), R, recobrado (%), Rf, factor de retención y t, tiempo (min).
Análisis estadístico
El recobrado del DSE fue analizado por un análisis simple de varianzas (ANOVA) para un nivel de significación de 0,05 y se utilizó el Minitab v15 (Minitab Inc., USA).
RESULTADOS Y DISCUSIÓN
Capacidad dinámica de unión para la resina Silicagel 60 por el DSE
Un aspecto importante en las separaciones por cromatografía de adsorción es el conocimiento real de las condiciones específicas de trabajo y el aprovechamiento apropiado del volumen de la resina empacada (8). La curva de ruptura del análisis frontal del proceso de adsorción a un flujo lineal de 78 cm/h y una longitud de onda de 257 nm permitió determinar que 250±0,2 mg/mL es la máxima capacidad dinámica de unión para la resina Silicagel 60 por el DSE (Fig. 1). Este nuevo valor es 6,9 veces mayor que el utilizado en el proceso de fabricación vigente de 36,4 mg/mL y cercano a la capacidad de carga nominal informada para esta resina, de 200 mg/mL, indicando la posibilidad de incrementar la productividad de la operación de separación (9).
Al comparar el comportamiento de un material puro (Fig. 2) frente a un material impuro (Fig. 3), observamos una diferencia en la ruptura de tres min, aproximadamente, lo que indica que parte de los contaminantes de la síntesis química para la fabricación del DSE quedan adsorbidos durante la aplicación, lo cual repercute en el cálculo de la capacidad real de unión DSE-Silicagel.
Desescalado de la cromatografía de la adsorción para purificar el DSE
El proceso de purificación es una de las operaciones más importantes en la fabricación de fármacos y, por ende, la calidad del empaquetamiento de una resina cromatográfica puede convertirse en un parámetro crítico en la calidad y cantidad del producto a obtener. Un incorrecto empaquetado puede afectar significativamente la resolución de las poblaciones de moléculas a separar y en consecuencia el recobrado global de la operación de separación. Es por eso que la eficiencia de una columna cromatográfica está determinada por la calidad del empaque de la resina que contiene.
Los métodos para determinar la eficiencia de empaque deben ser simples, cuantitativos, no introducir ningún material que ocasione contaminación en la resina y que pueda ser utilizado para comprobar el desempeño y eficiencia en la separación. El mejor método para evaluar lo anterior es expresar la eficiencia de la columna empacada en términos de su asimetría y altura de plato (8).
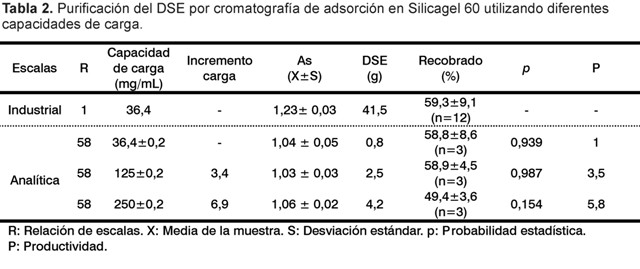
Los parámetros correspondientes a cada escala y la evaluación de la eficiencia del empaque en términos de As, N y H, se muestran en la Tabla 1. Con los parámetros calculados para la escala de analítica se realizaron todos los experimentos para el estudio de la cromatografía de fase normal del DSE.
En términos cromatográficos, el factor de asimetría indica la eficiencia de empaque por el perfil de elución resultante, el cual debe ser lo más simétrico posible.
Valores de asimetría cercanos a la unidad indican un acomodo o empaque homogéneo de la resina cromatográfica, lo que permitirá que la zona de transferencia de masa durante la separación sea compacta, con pocos fenómenos de difusión o dispersión axial que influyan en el proceso de separación (8). Sin embargo, en la práctica industrial los picos muy simétricos no son frecuentes y As de 0,8 hasta 1,5 son aceptables (10, 11). El valor de asimetría para la escala analítica de 1,04 ± 0,02 puede considerarse satisfactorio.
Los valores de platos teóricos constituyen una medida útil de la eficiencia de la columna; indicativo de su capacidad relativa para proporcionar bandas estrechas y separaciones con una resolución apropiada. Valores altos de N implican pequeños valores de H, lo que significa separaciones eficientes (8).
El valor de H obtenido en el presente estudio (0,019) es específico para la purificación del DSE en las condiciones descritas en la Tabla 1, no existiendo referencias de los suministradores para esta resina cromatográfica. No obstante, un valor empírico bastante aceptado en la literatura, es el cálculo de la altura del plato reducido (h) como relación entre la H y el diámetro de la partícula media de la resina cromatográfica, donde valores entre 3 y 5 son considerados apropiados para un buen empaque (8, 10). Los resultados obtenidos se encuentran dentro de los valores recomendados, indicando que la calidad de empaque de la resina Silicagel 60 a escala analítica reproduce los valores en términos de calidad del empaque de la escala industrial (Tabla 1).
Evaluación de nuevas condiciones de adsorción para purificar el DSE
La evaluación del proceso de purificación se realizó a partir de los resultados de la capacidad dinámica de unión calculada. Tres condiciones de adsorción se estudiaron a escala analítica: 36,4±0,2 mg/mL, 125±0,2 mg/mL y 250±0,2 mg/mL. Los resultados que se obtuvieron se presentan en la Tabla 2 y Figura 2, respectivamente.
Los perfiles de elución del DSE en las condiciones de adsorción evaluadas se caracterizaron por presentar dos poblaciones mayoritarias que eluyeron con solventes de diferentes polaridades (acetato de etilo y la mezcla de solventes acetato de etilo, metanol, trietilamina, respectivamente). Los tres perfiles que se obtuvieron con la variación en la carga inicial son muy similares, existiendo una diferencia esperada de incremento de áreas con el aumento de la masa aplicada. El recobrado del proceso de purificación del DSE que se obtuvo en la escala analítica (58,8±8,6%) no mostró diferencias significativas (p=0,939) con el recobrado histórico del proceso industrial (59,3±9,1%), lo que evidenció la efectividad del proceso de desescalado.
Con el aumento de la masa inicial 3,4 el recobrado es similar (p = 0,987) cuando se compara con la condición base, indicando un uso más racional del volumen de resina empacado. Sin embargo, en la condición más extrema de aumento de masa, el recobrado significativamente disminuye (p = 0,154), indicando que parte del DSE se pierde durante la aplicación. Esto se corresponde con el comportamiento observado durante la determinación de la capacidad dinámica de unión de DSE-Silicagel 60. En la Figura 4 se puede observar el perfil cromatográfico que se obtuvo para la condición de 125±0,2 mg/mL.
Para todos los casos estudiados, el análisis de pureza por CCD reveló que la población eluida con acetato de etilo estaba compuesta por impurezas provenientes del proceso de síntesis química para la obtención del DSE, con alguna estructura similar al material de interés. Por lo que se consideró que su absorbancia a 257 nm se debe posiblemente a la presencia de los grupos bencilos en su estructura, provenientes de los monosacáridos de partida peracetato de ribosa y ribitol.
También se observó otra impureza con mayor polaridad, comparada con la población que no es adsorbida durante la aplicación, que eluye en las primeras fracciones de la segunda población y que necesariamente tiene que ser separada del material de interés. El DSE purificado fue observado en la segunda población con un Rf de 0,45 y una pureza equivalente a la sustancia de referencia (Fig. 5).
Independientemente de los resultados alcanzados en términos de recobrado, el incremento de la productividad fue de 3,5 veces cuando se incrementa la carga a 125±0,2 mg/mL y de 5,8 veces cuando se trabaja a 250±0,2 mg/mL en comparación con la condición base de 36,4±0,2 mg/mL. Con estas evidencias se decidió establecer un proceso de purificación cargando la resina cromatográfica con 125±0,2 mg de DSE por mL de resina empacada, pues además de posibilitar una reducción apreciable en la cantidad de corridas, permitió la colección de una única fracción purificada entre los tiempos 195±2 y 260±2 min, cuando se mantiene un As entre 0,8 y 1,2, lo que reduce la manipulación de la muestra y la cantidad de ensayos de pureza para seleccionar las fracciones a mezclar (Fig. 6).
Los resultados de este trabajo indican que el proceso de purificación del DSE puede ser mejorado, incrementando su productividad 3,5 veces con la misma capacidad instalada. Se reducen tres veces los costos de operación con la disminución de ciclos de operación, donde se incluye el consumo de solventes químicos y el número de ensayos de pureza por la colección de una única fracción en el pico de elución. Para ello se debe mantener una calidad de empaque apropiada de la resina cromatográfica. Este procedimiento de purificación es simple, rápido, reproducible, racional en términos de costos y fácilmente escalable, lo cual es imprescindible para el cumplimiento de las Buenas Prácticas de Fabricación.
REFERENCIAS
1. Vérez V, Fernández V, Hardy E, Toledo ME, Rodríguez MC, Heynngnezz L, et al. A synthetic capsular polysaccharide vaccine against Haemophilus influenzae type b polysaccharide. Science 2004;305:522_4.
2. Peltola H. Worldwide Haemophilus influenzae type b disease at the beginning of the 21st century: global analysis of the disease burden 25 years after the use of the polysaccharide vaccine and a decade after the advent of conjugates. Clin Microbiol 2000;13(2):302-17.
3. Chandran A, Watt JP, Santosham M. Prevention of Haemophilus influenza type b disease: past success and future challenges. Vaccines 2005;4(6):821-9.
4. Agrawal A, Murphy TF. Haemophilus influenzae infections in the H. influenzae type b conjugate vaccine era. Clin Microbiol 2011; 49(11):3728-32.
5. Sharma H, Multani A, Dutta A, Joshi S, Malik S, Bhardwaj S, et al. Safety and immunogenicity of an indigenously developed Haemophilus influenzae type b conjugate vaccine through various phase of clinical trials. Human Vaccines 2009;5(7):483-7.
6. CECMED. Registro sanitario vacuna QuimiHib®. La Habana: Centro para el Control Estatal de los Medicamentos; 2003. Código B-03-150-J07.
7. Rathore A, Krishnan R, Tozer S, Smiley D, Rausch S, Seely J. Scaling down of biopharmaceutical unit operations. Part 2: Chromatography and filtration. BioPharm International 2005;18(4):58-64.
8. Hagel L, Sofer G, Gunter J. Handbook of process chromatography. Development, Manufacturing, Validation and Economics. Segunda ed. London: Academic Press; 2008.
9. Talomona A. Laboratory chromatography guide. Flawil, Swiss: Buchi Labortechnik AG; 2005.
10. Barry A, Chojnacki R. Biotecnology product validation. Part 8: Chromatography media and column qualification. Biopharm 1995;1:34-8.
11. Ettre L. More peak asymmetry calculation. LC-GC North America 2003;21(7):12-15
Recibido: Abril de 2012
Aceptado: Septiembre de 2012