Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Vaccimonitor
versión impresa ISSN 1025-028X
Vaccimonitor vol.22 no.2 Ciudad de la Habana mayo-ago. 2013
ARTÍCULO ORIGINAL
Características epidemiológicas y microbiológicas en casos confirmados de enfermedad meningocócica en Cuba, 1998-2007
Epidemiological and microbiological features of 86 confirmed meningococcal disease cases in Cuba, 1998-2007
Misladys Rodríguez,* Antonio Pérez, Rafael Llanes, Félix Dickinson, Iván Edelberto Cuevas, Kleich Pérez
Instituto de Medicina Tropical Pedro Kourí. Autopista Novia del Mediodía km 61/2. La Lisa, La Habana, Cuba. AP. 601. Marianao 13.
email: misladys@ipk.sld.cu
* Especialista de I Grado en Medicina General Integral, Máster en Epidemiología y Profesor Instructor.
RESUMEN
En la presente investigación se describió el comportamiento de la enfermedad meningocócica en 86 casos notificados con aislamiento de Neisseria meningitidis en Cuba, entre 1998-2007, a través de la distribución espacial y temporal de los casos, la caracterización fenotípica de las cepas aisladas y la identificación de algunos factores de riesgo del hospedero que pudieran incidir en su cambio fenotípico. Se calcularon los porcentajes y el índice de cambio de la estructura fenotípica del meningococo con diferentes criterios. Predominó el grupo de pacientes menores de un año (30,2%) y la forma clínica meningítica (76,7%). La letalidad fue de 15,1%. Enfermó con el mismo fenotipo de la cepa vacunal (B:4:P1.19,15) el 58,1% de los casos. Se detectaron cambios fenotípicos en el 41,9% de las cepas aisladas, principalmente en niños entre 5-9 años (2001 y 2007), residentes en la región occidental y central del país. Los que enfermaron en julio, septiembre, diciembre y abril y residían en las provincias de Matanzas, La Habana y Villa Clara, se asociaron con el cambio fenotípico de las cepas.
Palabras clave: enfermedad meningocócica, epidemiología, Neisseria meningitidis, factores asociados.
ABSTRACT
The present study describes the behavior of meningococcal disease in 86 cases notified with isolation of Neisseria meningitidis in Cuba from 1998-2007, through spatial and temporal distribution of cases, phenotypic characterization of isolated strains and identification of some host risk factors that may affect phenotypic switching of strains. Percentages and the rate of changes of the strain phenotypic structure with different criteria were calculated. Children under one year old (30.2%) and meningitis (76.7%) were predominant. Case-fatality rate was 15.1%. The 58.1% of cases were ill with the same vaccine strain phenotype (B:4:P1.19,15). Phenotypic changes were detected in 41.9% of the isolates, mainly in children of 5-9 years old who live in western and central regions. Children that fell ill in July, September, December and April and live in Matanzas, Havana and Villa Clara provinces were associated to phenotypic switching of strains.
Key words: meningococcal disease, epidemiology, Neisseria meningitidis, associated factors.
INTRODUCIÓN
Neisseria meningitidis causa la enfermedad meningocócica (EM), una de las infecciones bacterianas más agresivas que afecta a los humanos (1) con un mayor riesgo de enfermar en los niños de 1 a 4 años y en adultos jóvenes (2, 3).
Algunos autores describen una elevada mortalidad y letalidad (2, 3) y secuelas invalidantes en los enfermos que sobreviven a esta afección (4). Todo esto se traduce en una elevada carga por la enfermedad (5), lo cual tiene una importancia significativa para la salud pública (6).
La mayoría de los casos clínicos de EM son ocasionados por los serogrupos A, B y C y con menor frecuencia por los serogrupos Y y W135. Durante los últimos años los serogrupos B y C circulan con mayor frecuencia en Europa, Australia y América (6,7). El serogrupo B es responsable del 40-50% de los casos de EM esporádica en Estados Unidos y más del 90% de los casos notificados en algunos países europeos (8, 9).
Neisseria meningitidis es un diplococo gramnegativo, intracelular, casi siempre encapsulado y muy sensible a los agentes externos (1,10). La cápsula desempeña un papel importante en la determinación de la virulencia. Basado en su estructura antigénica se describen 12 serogrupos (A, B, C, E29, H, I, K, L, W135, X, Y y Z), cada uno con variaciones en su comportamiento epidemiológico (prevalencia, incidencia, virulencia, inmunogenicidad, distribución geográfica y temporal (6).
Los aislamientos de N. meningitidis pueden diferenciarse también en función de las proteínas de la membrana externa, para las cuales se reconocen cinco clases.
Las llamadas porinas PorA (de clase 1) definen el subtipo y las PorB (de clase 2/3) designan el serotipo. El serogrupo, serotipo y subtipo conforman en esta especie la clasificación fenotípica más utilizada (10).
La PorA constituye uno de los principales determinantes antigénicos de N. meningitidis, es cuantitativamente variable y algunas cepas no las expresan (10). Las vacunas basadas en la proteína PorA se utilizan con éxito para controlar epidemias (10).
En Cuba se utiliza desde 1989 la vacuna antimeningocócica (VA-MENGOC-BC®) contra los serogrupos B y C, a partir de la cepa CU385/83 (B:4:P1.19,15) (10). Posteriormente, esta vacuna se incorpora al Programa Nacional de Inmunizaciones (PNI) y su aplicación sistemática y mantenida logra el control de la EM hasta nuestros días (11).
No obstante al éxito obtenido, se debe mantener la vigilancia epidemiológica de esta enfermedad, así como la de los serogrupos, serotipos y subtipos de las cepas de N. meningitidis circulantes, dada la heterogeneidad de PorA (12), así como se realizan estudios que permiten el seguimiento de los cambios ocurridos a partir del uso de vacunas.
MATERIALES Y MÉTODOS
Se realizó un estudio observacional descriptivo y analítico en 86 casos diagnosticados como EM, confirmados por la obtención de un aislamiento de N. meningitidis, entre un total de 395 pacientes notificados con este diagnóstico y cuya fecha de los primeros síntomas ocurrió entre el 1ro de enero 1998 y el 31 de diciembre 2007, con un acumulado de 10 años de vigilancia. No se incluyeron 309 casos porque en ellos no se logró el aislamiento de este microorganismo.
La información se obtuvo a partir de los datos recogidos en los formularios clínico-epidemiológicos y microbiológicos del Sistema de Vigilancia Nacional de Síndromes Neurológicos Bacterianos (VNSNB) (11) y del libro de registro del Laboratorio Nacional de Referencia de Neisserias Patógenas del Instituto Pedro Kourí (LNRNP-IPK), considerando que todas las personas menores de 38 años de edad deben estar vacunados con VA-MENGOC-BC®.
Las cepas de N. meningitidis se aislaron de los casos con sospecha de EM, a partir de muestras clínicas invasivas de líquido cefalorraquídeo (100%) y hemocultivo (16,28%). Todas fueron inscritas en el libro de registro del LNRNP-IPK.
Las cepas se cultivaron en el medio modificado de Thayer Martin (Oxoid, Inglaterra); se incubaron a 37 °C en atmósfera húmeda con 5-10% de CO2 durante 48-72 h, en una incubadora Assab, Suecia, de acuerdo con lo establecido en el Manual de Operaciones y Procedimientos del LNRNP-IPK.
La identificación de las colonias de N. meningitidis se realizó mediante la observación morfológica y reacción a la coloración de Gram, así como por las pruebas bioquímicas y enzimáticas: oxidasa, catalasa, oxidación de la glucosa y la maltosa en el medio de agar Cistina Tripticasa (Difco, EUA) y la detección de la actividad g-glutamil aminopeptidasa (bioMérieux, Francia). Los serogrupos se clasificaron mediante la técnica de aglutinación en láminas portaobjetos, con antisueros policlonales comerciales de N. meningitidis A, B, C, X, Y, Z y W-135, (Difco, EUA).
Los serotipos y subtipos de N. meningitidis se caracterizaron mediante el ensayo inmunoenzimático (ELISA) de células enteras con anticuerpos monoclonales (AcM) (10). Para determinar los serotipos y subtipos se emplearon varios paneles comerciales o no de AcM de los Institutos Nacionales de Investigaciones para el Hombre y el Ambiente de Holanda (RIVM), Instituto Nacional para el Control Biológico y Estándares del Reino Unido (NIBSC) y el Instituto Adolfo Lutz, Brasil.
Para detectar los serotipos se utilizaron los AcM siguientes: MN3C6B (1), MN14G21 (4), MN7C (7), MN5C8C (14), MN15A14H6 (15), MN17C (17), y para la detección de subtipos se emplearon los AcM: MN14C2.3 (P1.1), MN16C13F4 (P1.2), MN20B9.34 (P1.4), MN22A9.19 (P1.5), MN14C11.6 (P1.7), MN5A10F (P1.9), MN24H10.75(P1.13), MN21G3.17 (P1.14), MN3C5C (P1.15), MN5C11G (P1.16) y MN P1.19, según lo descrito en el Manual de Operaciones y Procedimientos del LNRNP-IPK (13).
Análisis estadístico
Los datos se resumieron en número y porcentajes, considerando algunos factores del individuo: grupos de edades, género, formas clínicas, antecedentes de vacunación, la fecha de los primeros síntomas, la provincia y el municipio de residencia.
Se calculó el índice de cambio de la estructura fenotípica de la cepa, teniendo en cuenta el cociente, resultado de la división del número de cepas que cambian entre el número total de cepas caracterizadas en el LNRNP-IPK, durante el período de estudio, de acuerdo con la fecha de los primeros síntomas de los enfermos, en quienes se aisló la cepa en ese momento, multiplicado por 100.
Se realizó el análisis bivariado para explorar la asociación de algunas variables que se consideraron como riesgo para padecer la enfermedad: meningococemia, no vacunado, meses de ocurrencia, provincias y municipios de residencia (estos tres últimos con índice de cambio de cepas ³ 50), mediante el Riesgo Relativo (RR). Posteriormente, se realizó un análisis de regresión logística multivariada utilizando la Razón de Disparidad (RD) que incorporó aquellas variables con valor de RR> 1. Para ambos parámetros el intervalo de confianza (IC) fue del 95% y el nivel de significación estadística p<0,05.
Se definieron tres regiones geográficas, de acuerdo con la división político-administrativa del país (169 municipios y 14 provincias). La región occidental incluyó a las provincias de Pinar del Río, La Habana, La Habana, Matanzas y el municipio especial Isla de la Juventud; la región central agrupó a Villa Clara, Cienfuegos, Sancti Spíritus, Ciego de Ávila, y la región oriental abarcó a las provincias Camagüey, Las Tunas, Holguín, Granma, Santiago de Cuba y Guantánamo.
Se establecieron las definiciones operativas y criterios de riesgo siguientes:
. Cambio de cepas: cuando se detectó cambios en el serogrupo, serotipo o subtipo, respecto a la cepa B:4:P1.19,15, utilizada como cepa tipo de VA- MENGOC-BC®.
· Índice de cambio de cepas por grupos de edades: aquellos en que se caracterizaron cinco o más cepas y con resultado de índice de cambio de cepas ³ 50.
· Índice de cambio de cepas por años: aquellos en que se caracterizaron cuatro o más cepas y con resultado de índice de cambio de cepas ³ 50.
· Índice de cambio de cepas por meses: aquellos en que se caracterizaron cuatro o más cepas y con resultado de índice de cambio de cepas ³ 50.
· Índice de cambio de cepas por región: aquellas en que se caracterizaron 20 o más cepas y con resultado de índice de cambio de cepas ³ 50.
· Índice de cambio de cepas por provincias: aquellas en que se caracterizaron cinco o más cepas y con resultado de índice de cambio de cepas ³ 50.
· Índice de cambio de cepas por municipios: en los que se caracterizaron dos o más cepas y con resultado de índice de cambio de cepas ³ 50.
Para el análisis de la base de datos se utilizaron los programas Epi Info 2000 y Excel (versión 5.1); GVSIG (versión 1.0) para el análisis geográfico de la información, donde se diferenciaron los estratos mediante un tramado monocromático, y Microsoft Office Word 2003 (11.5604.5606) como procesador de texto.
Consideraciones éticas: El Ministerio de Salud Pública es la organización gubernamental responsable de la recolección de las notificaciones de enfermedades infecciosas, de la vigilancia de la población y de su manejo con propósitos de la salud pública. Por esta razón no se necesitó el consentimiento informado, no obstante, se respetó la confidencialidad y preservación de la información utilizada con fines estrictamente científicos.
RESULTADOS
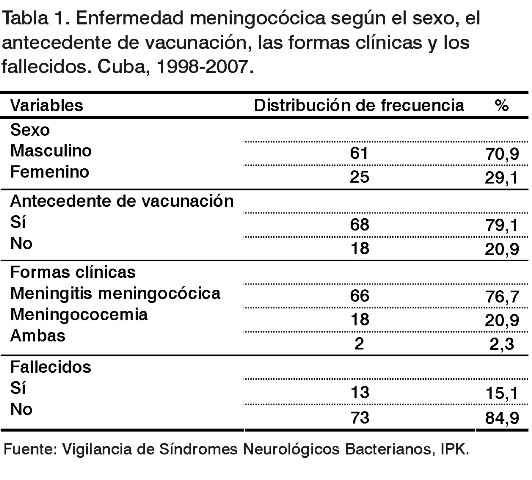
De los 86 casos de EM con aislamiento de N. meningitidis todos pertenecieron al serogrupo B. El sexo masculino representó el 70,9% de los individuos; la meningitis meningocócica el 76,7% de los casos y la letalidad fue 15,1%. Un total de 68 casos (79,1%) refirieron estar vacunados con VA-MENGOC-BC® (Tabla 1), de los cuales en 19 (27,9%) se documentó la información mediante la tarjeta de vacunación.
Con relación a la edad, predominó el grupo de menores de un año (26/86; 30,2%), seguido de los niños de 10-14 años (14/86; 16,3%) y de 1-4 años (11/86; 12,8%).
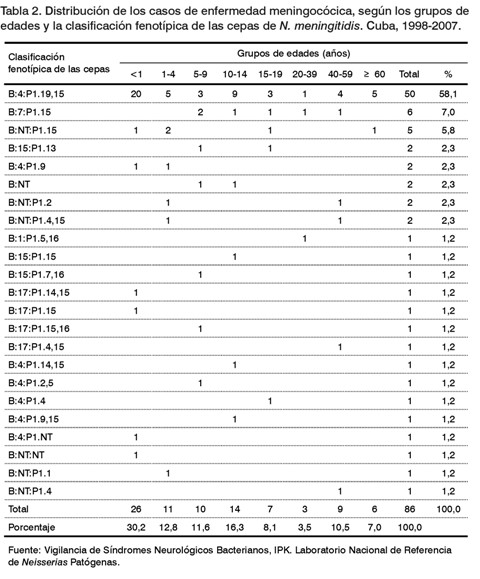
En la mayoría de los casos (50/86; 58,1%) se aisló N. meningitidis del mismo fenotipo vacunal (B:4:P1.19,15) y se identificaron cambios en los serotipos y subtipos en 36 de ellos (41,9%), tales como: el fenotipo B:7:P1.15 (7,0%) y el B:NT:P1.15 (5,8%). Además, se identificaron otras 20 cepas diferentes a la cepa tipo vacunal (Tabla 2). En los niños de 5-9 años se observó el mayor índice de cambio de cepas, seguido de los adultos de 20-39 años y los adolescentes de 15-19 años (Tabla 3).
Se muestran los índices de cambio de cepas según las regiones del país (Tabla 4). El mayor índice se observó en los pacientes residentes en la región occidental, seguido por los de la región central y oriental; mientras que el mayor índice de cambios, según las provincias, ocurrió en los enfermos de Matanzas con 70,6% (12/17), La Habana con 57,10% (4/7) y Villa Clara con 50% (6/12).
Se muestra el índice de cambio y no cambio de cepas de N. meningitidis aisladas según los municipios (Fig. 1). Mostraron 100% de cambios: Matanzas (3/3), Cárdenas (3/3) y Encrucijada (2/2); le siguieron con 66,7%: Jagüey Grande y Santa Clara (2/3); mientras que fue de 50,0% (1/2): Jovellanos, Palmira, Jatibonico, Minas, Habana Vieja y Habana del Este.
El mayor índice de cambio en forma descendente ocurrió en los años 2007 con 75% (3/4); 2001 con 66,7% (8/12); seguido del 2006 con 62,5% (5/8); 2002 con 50% (6/12); 2000 con 38,5% (5/13); 1998 con 28,6% (2/7) y 1999 con 12,5% (2/16). No se estudiaron los años 2003 y 2004 porque solo se recibió una cepa de N. meningitidis cada año.
Respecto a los meses de ocurrencia, el mayor índice de cambio de cepas se observó en julio, con 100% (5/5); diciembre, con 83,3% (5/6); seguido con 75% (abril 6/8 y septiembre 3/4) (Fig. 2).
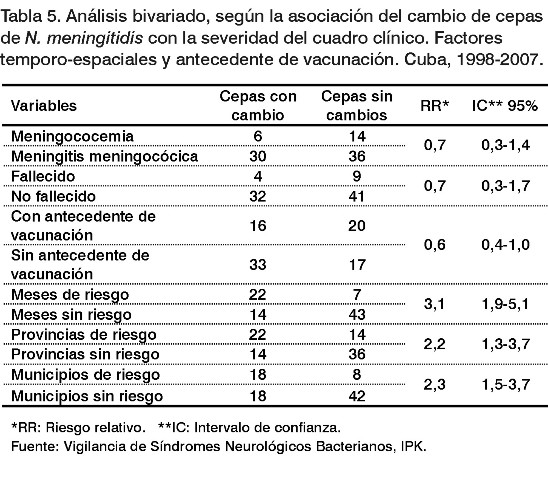
Teniendo en cuenta los criterios de riesgo de cambio de cepas, en el análisis bivariado se observó asociación significativa en los pacientes que enfermaron durante los meses de julio, septiembre, diciembre y abril, en los que residían en las provincias de Matanzas, La Habana y Villa Clara y en los municipios: Matanzas, Cárdenas, Encrucijada, Jagüey Grande, Santa Clara, Jovellanos, Palmira, Jatibonico, Minas, Habana Vieja y Habana del Este. Sin embargo, no se detectó asociación (RR<1) con el antecedente de vacunación con VA-MENGOC-BC®, la meningococemia y la muerte (Tabla 5).
En el análisis de regresión logística multivariado se observó una asociación significativa del cambio de cepas de N. meningitidis con la enfermedad en los meses de julio, septiembre, diciembre y abril y en los que residían en las provincias de riesgo: Matanzas, La Habana y Villa Clara.
En los casos no vacunados la RD fue de 1,7 1,7 (IC 95% = 0,5-6,0) y para los que residían en los municipios de riesgo: Matanzas, Cárdenas, Encrucijada, Jagüey Grande, Santa Clara, Jovellanos, Palmira, Jatibonico, Minas, Habana Vieja y Habana del Este que fue de 1,7 (IC 95% = 0,6-4,8). Para ambos la RD no fue significativa (Tabla 6).
DISCUSIÓN
La motivación para realizar este trabajo se fundamentó en los cambios ocurridos en el comportamiento de la EM en Cuba después de transcurridos 20 años de la aplicación masiva y mantenida de VA-MENGOC-BC® en el marco del PNI, donde la incidencia de la enfermedad se mantiene por debajo de 0,5/100 000 habitantes (14). El mayor número de cepas estudiadas procedían de pacientes del sexo masculino, menores de un año, seguido de los grupos de edades de 10-14 años y de 1-4 años, lo cual coincide con otros autores (11,15).
Los niños y jóvenes en Cuba están vacunados contra N. meningitidis B y C desde la etapa de lactante, con elevadas coberturas. Por otra parte, no fue posible identificar que el antecedente de no estar vacunado y la edad del paciente estuviesen asociados a los cambios fenotípicos detectados en las cepas de N. meningitidis. No obstante, es válido señalar que el mayor cambio de cepas se observó en los niños de 5-9 años.
En la mayoría de los enfermos se aislaron cepas de N. meningitidis con características fenotípicas similares a la cepa tipo vacunal, resultado que coincidió con lo descrito en otros estudios nacionales (1,10), así como por Pirez y cols en Uruguay (16).
Por otra parte, hubo pacientes en los que se aislaron cepas con al menos alguna diferencia en los serotipos y subtipos. Los resultados de este trabajo coincidieron con los reportados por González de Aledo en España (17), quienes describen una prevalencia de 6,3 y 7,2% de cepas con los fenotipos B:NT:P1.15 y B:7:P1.15, respectivamente. Otros fenotipos como B:15:P1.13; B:15:P1.15; B:4:P1.2,5; B:4:P1.4 y B:4:P1.NT se identifican en Cuba anteriormente (10).
Resultó interesante la detección de cuatro cepas de N. meningitidis del serotipo B:17, nunca antes notificado en Cuba. El Laboratorio Nacional de Referencia de Meningococo de Canadá realizó un estudio entre octubre del 2004 y marzo del 2005, detectando la emergencia de un nuevo clon circulante (ST-269) en cepas aisladas de pacientes con la EM en la provincia de Québec, pertenecientes al fenotipo B:17:P1.19 (18).
El mayor índice de cambio fenotípico prevaleció en los enfermos de la región occidental y central del país. No se encontraron en la literatura consultada artículos publicados en Cuba que permitan hacer comparaciones al respecto, aunque se señala el agrupamiento de casos con el diagnóstico de meningitis bacteriana en algunas provincias pertenecientes a esas regiones (11).
Además, el archipiélago cubano es largo y estrecho, y la región central cuenta con una mayor radiación solar y variabilidad climática, condiciones que pudieran favorecer la mayor incidencia de meningitis meningocócica en esa zona (11).
Los mayores índices de cambio de cepas de N. meningitidis se observaron, sobre todo, en los meses de julio, septiembre, diciembre y abril. Sin embargo, Pérez y cols, describen la estacionalidad de la meningitis bacteriana en los meses de septiembre, enero y marzo (11). Esto sugiere la influencia de posibles factores geográficos, físico-ambientales y meteorológicos junto a otros desconocidos, que pudieran ser motivo de nuevas hipótesis y futuras investigaciones.
El enfoque ecosistémico para el análisis de los problemas de salud facilita la comprensión de fenómenos complejos, en los cuales pudieran existir condiciones ambientales que depriman el sistema inmune del hospedero y lo hagan más susceptible a la agresión por los agentes biológicos, así como que faciliten las mutaciones o recombinaciones de estos últimos, proporcionando probables explicaciones del porqué surgen nuevos agentes o cepas más virulentas en determinadas regiones (19).
A pesar de que solo fue posible investigar las cepas de N. meningitidis en el 15,4% de los casos de EM reportados en el período de estudio, los resultados obtenidos revisten importancia epidemiológica y microbiológica dado que, por primera vez se aporta información sobre este enfoque en Cuba y se justifica la necesidad de continuar el monitoreo de las cepas circulantes. Esto permitirá alertar oportunamente sobre los cambios fenotípicos observados en esta bacteria.
En la presente investigación, la clasificación de las cepas de N. meningitidis no estuvo basada en los métodos moleculares como el “Multilocus Sequence Typing” (MLST) y el tipado según el gen opa, que en la actualidad son las principales herramientas empleadas para este fin (1, 11). Estudios recientes revelan importantes cambios en Cuba en la circulación de los complejos clonales de N. meningitidis, luego de la aplicación sostenida de VA-MENGOC- BC®.
La frecuencia y diversidad de los complejos clonales hipervirulentos (ST-32 y ST-41/44) en los enfermos y portadores disminuyen en los últimos años y han sido reemplazados por el complejo ST-53 (1). Este cambio de los complejos clonales pudiera ocasionar variaciones en el comportamiento de la morbilidad y la mortalidad de la EM en Cuba.
En este estudio, las cepas con cambio fenotípico no se asociaron con las formas clínicas graves de la enfermedad, ni con la muerte. Esto pudiera sugerir una baja virulencia a partir de la aplicación exitosa de VA-MENGOC-BC®, comportamiento ya señalado por otros autores (1).
El impacto de VA-MENGOC-BC® sobre los linajes diferentes del complejo ST-32 demuestran que esta vacuna confiere protección contra algunas cepas del serogrupo B diferentes a la cepa tipo vacunal (1, 11), lo que pudiera inducir a cambios en la circulación de fenotipos, comportamiento descrito en regiones donde se aplican vacunas contra N. meningitidis (20, 18). En Cuba también se observa una reducción de la cepa epidémica de meningococo en portadores nasofaríngeos (21).
Los cambios fenotípicos encontrados en las cepas analizadas alertan sobre la posibilidad de cambios en la circulación de otros fenotipos que pudieran constituir un riesgo para la salud. Esto refuerza la necesidad de continuar el fortalecimiento de la vigilancia epidemiológica y microbiológica de la EM en Cuba.
REFERENCIAS
1. Climent Y, Yero D, Martínez I, Martin A, Jolley KA, Sotolongo F, et al. Clonal distribution of disease-associated and healthy carrier isolates of Neisseria meningitidis between 1983 and 2005 in Cuba. J Clin Microbiol 2010;48(3):802-10.
2. Pereiro I, Diez-Domingo J, Segarra L, Ballester A, Albert A, Morant A. Risk factors for invasive disease among children in Spain. J Infect 2004;48(4):320-9.
3. McCall BJ, Neill AS, Young MM. Risk factors for invasive meningococcal disease in southern Queensland, 2000-2001. Intern Med J 2004;34(8):464-8.
4. Erickson L, De Wals P. Complications and sequelae of meningococcal disease in Quebec, Canada, 1990-1994. Clin Infect Dis 1998;26:1159-64.
5. Pérez A, de la Fuente L, Seuc A. Carga por enfermedad por meningitis bacteriana, Cuba 2006. Rev Cubana Med Trop 2012; 63(3):246-52.
6. Racloz VN, Luiz SJ. The elusive meningococcal meningitis serogroup: a systematic review of serogroup B epidemiology. BMC Infectious Diseases 2010;10:175.
7. Raghunathan PL, Bernhardt SA, Rosenstein NE. Opportunities for control of meningococcal disease in the United States. Annu Rev Med 2004;55:333-53.
8. Sharip A, Sorvillo F, Redelings MD, Mascola L, Wise M, Nguyen DM. Population-based analysis of meningococcal disease mortality in the United States: 1990-2002. Pediatr Infect Dis J 2006;25(3):191-4.
9. Trotter CL, Chandra M, Cano R, Larrauri A, Ramsay ME, Brehony C, et al. A surveillance network for meningococcal disease in Europe. FEMS Microbiol Rev 2007;31(1):27-36.
10. Martínez I. Contribución al transporte-conservación y caracterización de cepas aisladas en Cuba 1982-2002 [Tesis para optar al grado científico de Doctor en Ciencias Médicas]. La Habana: Instituto Finlay; 2004.
11. Pérez AE, Dickinson FO, Rodríguez M. Community acquired bacterial meningitis in Cuba: a follow up of a decade. BMC Infectious Diseases 2010;10:130.
12. Pace D, Cuschieri P, Galea A, Attard-Montalto S. Epidemiology of pathogenic Neisseria meningitidis serogroup B serosubtypes in Malta: Implications for introducing PorA based vaccines. Vaccine 2008;26:5952-6.
13. Laboratorio Nacional de Referencia de Neisseria. Manual de Operaciones y Procedimientos del Laboratorio. La Habana: Instituto “Pedro Kourí”; 2007.
14. Pérez A, Dickinson FO, Rodríguez M. Efectividad de la vacuna antimeningocócica VA-MENGOC-BC® en el primer año de vida, Cuba, 1997-2008. Rev Cubana Med Trop 2011;63(2):155-160.
15. Sierra G, Campa C, Valcárcel M, García I, Izquierdo L, Sotolongo F. Vaccine against group B Neisseria meningitidis: protection trial and mass vaccination results in Cuba. NIPH Ann 1991;14(2):195-207.
16. Pirez GM, Picón MT, Galazka CT, Quian RJ, Gutiérrez RS, Ferrari CA, et al. Enfermedad invasiva meningocócica en Uruguay. Informe epidemiológico y recomendaciones, mayo 2002. Rev Med Uruguay 2002;18:83-8.
17. González de Aledo, Viloria L. Serosubtipos de meningococo B causantes de enfermedad invasiva en Cantabria y concordancia con la cepa de la vacuna cubana. Gac Sanit 2004;18(1):45-9.
18. Law DK, Lorange M, Ringuette L, Dion R, Giguere M, Henderson AM, et al. Invasive meningococcal disease in Quebec, Canada, due to an emerging clone of ST-269 serogroup B meningococci with serotype antigen 17 and serosubtype antigen P1.19 (B:17:P1.19). J Clin Microbiol 2006;44(8):2743-9.
19. Hernández CE, Pérez AE. Factores geológicos relacionados con problemas de salud. Rev Habanera Cien Med 2010; 9(2):219-29.
20. Alcalá B, Arreaza L, Salcedo C, Uria MJ, de la Fuente L, Vázquez JA. Capsule switching among C:2b:P1.2,5 meningococcal epidemic strains after mass immunization campaign, Spain. Emerg Infect Dis 2002;8(12):1512-4.
21. Climent Y, Urwin R, Yero D, Martínez I, Martin A, Sotolongo F, et al. The genetic structure of Neisseria meningitidis populations in Cuba before and after the introduction of a serogroup BC vaccine. Infect Genet Evol 2010;10(4):546-54.
Recibido: Junio de 2012
Aceptado: Noviembre de 2012