Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Vaccimonitor
versión impresa ISSN 1025-028X
Vaccimonitor vol.23 no.2 Ciudad de la Habana Mayo.-ago. 2014
ARTÍCULO ORIGINAL
Utilización del ácido caprílico en la obtención de inmunoglobulina G de caballo antitoxina tetánica
Using the caprylic acid in obtaining the horse immunoglobulin anti tetanus toxin
Antonio Roger Miranda-Cruz,1*Rolando Sánchez-Artigas,1 Oscar Otero-Alfaro,2 Walter Góngora-Amores,1Dailín Cobos-Valdes,1Yordana Goya-Batista,1 Julio Balboa-González,2Oliver Pérez-Martín2
1Centro de Inmunología y Biopreparados. Universidad de Ciencias Médicas de Holguín. Ave de los Alamos, entre Avenida Lenin y Calle Mariana de la Torre. Holguín. Cuba.
2Vicepresidencia de Investigaciones, Instituto Finlay. Calle 17 e/ 198 y 200, RepartoAtabey, Playa, La Habana. Cuba. AP. 16017, CP. 11600.
email: antonio@cibho.hlg.sld.cu
*Licenciado en Química. Investigador Agregado. Profesor Auxiliar.
RESUMEN
Las inmunoglobulinas de caballo antitoxina tetánica purificadas, con altas concentración de anticuerpos y actividad biológica, se utilizan como sueros heterólogosy sueros estándar para la producción de la vacuna correspondiente. No obstante, la selección de agentes precipitantes para la purificación de las mismas constituye un problema en términos de pureza, rendimiento y de economía, aún por resolver. En este estudio se describieron las condiciones para el fraccionamiento de plasma antitoxina tetánica de caballo mediante precipitación con ácido caprílico. A las muestras se les añadió solución de ácido acético/acetato de sodio para alcanzar fuerzas iónicas de 0,05 a 0,4 moles/L y ácido caprílico para obtener concentraciones de 1 al 7 % (v/v), con agitación vigorosa. Las proteínas no-inmunoglobulinas precipitaron en estas condiciones, mientras que las inmunoglobulinas permanecieron en el sobrenadante. Se seleccionaron las mejores condiciones de fraccionamiento y se comparó esta metodología con la precipitación con sulfato de amonio. Los mejores resultados se obtuvieron cuando se añadió el ácido caprílico al plasma hasta alcanzar una concentración final de 3%, a una fuerza iónica de 0,2 moles/L y un pH ajustado a 4,5. La IgG antitoxina fraccionada con ácido caprílico se obtuvo con una media de recuperación de proteína de 91-95%, la concentración de proteínas fue de 27,1-29,3 mg/mL y la relación albúmina/inmunoglobulina de 0,019-0,021. Se alcanzó una pureza entre 91-95% y la actividad de antitoxina osciló entre el 93-96%.
Palabras clave: Inmunoglobulinas de caballo, antitoxina tetánica, ácido caprílico.
ABSTRACT
Purified horse anti tetanus toxin immunoglobulins with high antibody concentration and biological activity, are used as heterologous sera and standard serum for corresponding vaccine. However, the selection of precipitating agents for the purification of them is a problem in terms of purity, yield and economy, which still remains to be solved. In this study, a procedure to fractionation horse plasma anti tetanus toxin by Caprylic acid precipitation is described. A solution of acetic acid/sodium acetate was added to the samples to achieve different ionic strengths, 0.05-0.4 moles/L, and caprylic acid was added to each volume to reach final concentrations from 1 to 7% (v / v), with vigorous stirring for 60 min. Non-immunoglobulin proteins precipitated under these conditions, while immunoglobulins remained in the supernatant, which was then diafiltered to remove caprylic acid and concentrate inmunoglobulins. This methodology was compared to that based on ammonium sulfate fractionation. The best results were given when caprylic acid was added to plasma, until a final caprylic acid concentration of 3% was reached, at ionic strength 0.2 moles/L and pH adjusted to 4.5. The IgG recovery was 91-95% by using the caprylic acid method. It was achieved a protein concentration of 27.1-29.3 mg/mL and an albumin/immunoglobulins ratio of 0.019-0.021. The purity was 91-95% and the anti-tetanus toxin activity recovery of 93-96%.
Key words: Horse immunoglobulins, antitetanus toxin, caprylic acid.
INTRODUCCIÓN
El plasma humano y animal y las fracciones de los mismos juegan un papel importante en la medicina moderna. La producción de antitoxinas es un proceso biotecnológico que incluye el uso de sangre animal, obtenida por la inmunización de caballos, como materia prima, que se procesa y se purifica antes de obtener un producto final (1).
Los sueros antitoxinas fueron utilizados en los tratamientos de la difteria, el tétanos, la rabia y el envenenamiento por mordedura de serpientes. Aunque las Inmunoglobulinas (Igs) totales o sus fragmentos (Fab)2 a partir de plasma hiperinmune de caballo constituyen el principal recurso contra las mordeduras de ofídicos, la vacunación ha sustituido el uso de sueros hiperinmunes contra la difteria y el tétanos (2). No obstante, las antitoxinas siguen siendo necesarias tanto para el tratamiento en algunas regiones del mundo (3) como para la producción de los antígenos que forman parte de las formulaciones vacunales que incluyen el toxoide tetánico y la difteria.
Varios métodos se han implementado para la purificación de antitoxinas de plasma animal hiperinmune. Las técnicas cromatográficas, tales como la afinidad y de intercambio iónico, proporcionan un producto de alta calidad, pero el costo es más bien alto y requieren equipos especializados. Los métodos basados en precipitación de las IgGs o de sus fragmentos (Fab)2 con sulfato de amonio por lo general traen una pérdida en el rendimiento y la posibilidad de formación de agregados (4).
Un método alternativo para la purificación de IgGs se desarrolló basado en la capacidad de precipitación de los ácidos grasos de cadena mediana y corta (5). Estudios previos describieron el uso del ácido caprílico (ácido octanoico, AC) en la purificación de las Igs a partir de diversas fuentes, incluidos suero, líquido ascítico y anticuerpos de la yema de huevo IgY de gallina (5-7).
Varios investigadores utilizaron el AC para la purificación de anticuerpos policlonales antitoxinas (8-10,) debido a la capacidad selectiva del AC de precipitar la mayoría de las proteínas plasmáticas no-Igs, básicamente la albúmina, excepto la fracción de las Igs.
Este es un método simple, en una sola etapa de precipitación y ventajoso que proporciona una preparación muy enriquecida de Igs con alto rendimiento, en menor tiempo de procesamiento, un producto más puro y se reduce la posibilidad de formación de agregados dado que las Igs permanecen solubles (4,8,11).
Las variables estudiadas por estos autores fueron la concentración de AC, el pH, la velocidad de agitación y la intensidad y algunos han incluido la temperatura (12,13).
En el presente trabajo se evaluaron la influencia de la fuerza iónica, la concentración del AC y el pH en el fraccionamiento de plasma de caballo hiperinmune antitoxina tetánica y se determinaron las mejores condiciones para obtener IgGs con la más alta pureza y rendimiento.
MATERIALES Y MÉTODOS
Plasma hiperinmune
El plasma hiperinmune anti TT fue producido y recopilado de caballos inmunizados con el TT en una emulsión oleosa adyuvante (14).
Determinación de la fuerza iónica y la concentración de ácido caprílico en el fraccionamiento de la antitoxina plasmática de caballos
Para determinar las mejores condiciones de precipitación de los contaminantes proteicos del plasma no correspondientes a IgG se estudiaron tres variables: concentración de AC, pH y fuerza iónica. El plasma hiperinmune se filtró por membranas de 0,45 μm para eliminar las proteínas coaguladas. Volúmenes de 50 mL de plasma se diluyeron dos veces con solución tampón ácido acético/acetato de sodio (Merck) para alcanzar diferentes fuerzas iónicas de 0,05 a 0,4 mol/L. Las muestras se ajustaron a pH 5,0 mediante la adición de ácido acético 1,76 mol/L (16). El AC (Sigma- Aldrich, EEUU) se añadió a cada volumen lentamente con agitación vigorosa y constante hasta alcanzar concentraciones finales de 1 al 7% (v/v). Las mezclas se agitaron durante 1 h a 22-24 °C, se centrifugaron a 4800 x g por 30 min a 4 °C y los sobrenadantes se dializaron durante 48 h frente a agua destilada. Posteriormente, se añadió NaCl (Merck, Alemania) hasta una concentración final de 0,15 mol/L. Las soluciones se filtraron y su pH se ajustó a 7,2 mediante la adición de NaOH 1 mol/L (Merck, Alemania).
Determinación del pH para el fraccionamiento con ácido caprílico
Volúmenes de 50 mL de plasma hiperinmune se prepararon como se describió anteriormente, con la fuerza iónica seleccionada y su pH se ajustó a 3,6; 4,0; 4,5; 5,0 y 5,6 con ácido acético 1,76 mol/L. Luego el AC se añadió hasta la concentración seleccionada en el acápite anterior.
Purificación de IgG equina por precipitación con sulfato de amonio
A volúmenes de 100 mL se les añadieron 20 g de sulfato de amonio (20 % de saturación) (Merck, Alemania) con agitación. La mezcla se mantuvo durante 1 h a 4 ºC. Después se centrifugó a 4800 x g durante 20 min a 4 °C.
El precipitado se descartó y al sobrenadante se le agregó sulfato de amonio hasta una concentración del 50% de saturación. La mezcla se mantuvo durante una h a 4 ºC. Luego se centrifugó a 4800 g durante 20 min a 4 °C. El precipitado se lavó con una solución de sulfato de amonio al 50% de saturación de un volumen equivalente al 30% del inicial. Este se centrifugó bajo las mismas condiciones y el precipitado se resuspendió en solución salina tamponada con fosfato 0,15 mol/L, pH 8,0. Luego, se aplicó una diafiltración a 22-24 °C con la misma solución y fenol a 1,5 g/L. El pH se ajustó a 7,2 mediante la adición de NaOH 1 mol/L (Merck, Alemania).
Fraccionamiento con ácido caprílico
Bajo las condiciones seleccionadas de AC, pH y fuerza iónica se diluyó 100 mL de plasma hiperinmune 1:2 con solución tampón de ácido acético/acetato de sodio hasta alcanzar una fuerza iónica de 0,2 mol/L; el pH se ajustó a 4,5 con ácido acético 1,76 mol/L.
El AC se adicionó lentamente con agitación vigorosa hasta alcanzar una concentración de 3% durante 1 h a 23-26 °C y luego la mezcla se centrifugó a 4800 x g por 20 min a 4 °C. El sobrenadante se diafiltró en las mismas condiciones que el acápite anterior.
Determinación de las concentraciones de las proteínas totales y la albúmina
La concentración de proteínas totales se determinó por el método de Lowry (15). La concentración de albúmina en los sobrenadantes así como en los precipitados redisueltos, se determinó por el método del verde de bromocresol (16); los valores de absorbancia se registraron a 625 nm, los resultados representan el promedio de tres determinaciones independientes.
Cromatografía de gel filtración
Las muestras de 5 mL de cada antitoxina purificada por fraccionamiento con AC y sulfato de amonio se aplicaron a una columna de Sephacryl S-300 HR (2,6 x 100 cmPharmaciaBiotech).
La columna se equilibró y las proteínas se eluyeron con solución salina tamponada con fosfato, pH 7,2 a un flujo volumétrico de 2 mL/min. Cada fracción fue de 4 mL y las proteínas fueron determinadas en un espectrofotómetro a una longitud de onda de 280 nm. Marcador para elgel de filtración de alto peso molecular (GE HealthcareBio-Sciences AB).
Electroforesis en gel de poliacrilamida en presencia de dodecil sulfato de sodio
El análisis electroforético se llevó a cabo en gel de acrilamida al 12,5% en presencia de dodecil sulfato de sodio según Laemmli, 1970 (17).
Las muestras se prepararon en condiciones no reducidas. El gel se tiñó con R250 Azul Coomassie (Sigma, EEUU). Se emplearon proteínas como patrones de masa molecular con un rango entre 45 y 250 kDa (Sigma-Aldrich).
Las bandas se visualizaron y se analizaron en un escáner de imágenes (ImageMaster, PharmaciaBiotech, Suecia). Para el análisis de las muestras de gel filtración se utilizó un gradiente de 4- 15% de acrilamida.
Análisis estadístico
Todos los análisis estadísticos se llevaron a cabo utilizando el programa GraphPadPrism v4.00 (CA, EEUU). Los resultados fueron analizados aplicando ANOVA de un factor seguido de un estudio de comparaciones múltiples de Tukey. Se consideró diferencia estadísticamente significativa para los valores de p<0,05.
RESULTADOS
Determinación de las condiciones físico-químicas para la purificación de IgG de plasma de caballo hiperinmune anti TT utilizando ácido caprílico
Los resultados experimentales de la influencia de la fuerza iónica y la concentración de AC sobre la purificación de las IgGs de plasma hiperinmune anti TT de caballos, a pH 5,0 se muestran en la Figura 1.
Se observó que la recuperación de proteínas en el precipitado siguió cinéticas similares, aumentan cuando se utilizan concentraciones de AC ascendentes, alcanzan el máximo a una concentración de AC de 3% (59,1 mg/mL), en el rango de concentraciones de 3 al 5% las concentraciones de proteínas son similares y no existen diferencias estadísticamente significativas (p>0,05), al aumentar el AC a 6 y 7 % las cantidades de proteínas recuperadas decaen ligeramente.
La recuperación de proteínas en el sobrenadante es diferente a la recuperación de proteínas en el precipitado; con una tendencia a disminuir hasta alcanzar la cantidad de proteínas más baja cuando se adiciona AC hasta 3% y en el rango de concentraciones de AC entre 3 y 5% no presentaron diferencias significativas (p>0,05), luego aumentan ligeramente a concentraciones mayores de 5% (Fig. 1).
Las concentraciones de AC menores de 3% proporcionan un producto con una alta actividad anti TT, pero un alto contenido de proteínas.
Sin embargo, al utilizar concentraciones de AC mayores que 5% el porcentaje de proteína en el sobrenadante aumenta, pero la actividad de anticuerpos anti TT disminuye (Fig. 2).
La mayoría de las proteínas plasmáticas precipitan a la concentración de 3% de AC, a concentraciones mayores de 6% de AC precipitan proteínas adicionales.
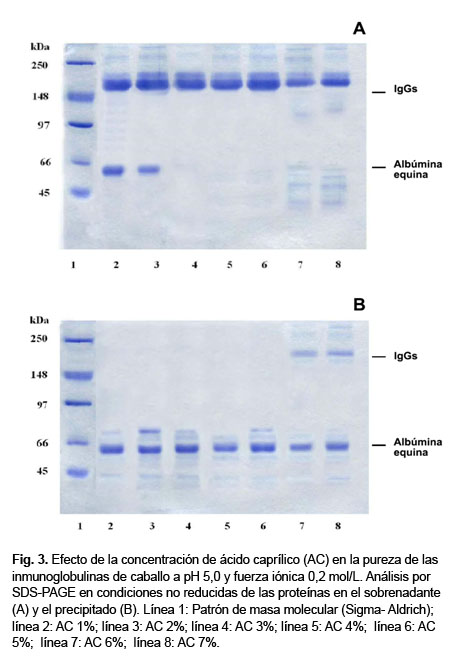
El análisis de proteínas por SDS-PAGE mostró que la albúmina precipitó casi completamente al 3% de AC y las IgGs no precipitaron entre las concentraciones 1-5%.
Sin embargo a concentraciones mayores de 5% algunas IgGs precipitaron (Fig. 3B); los sobrenadantes tuvieron cierta turbidez y se incrementó la contaminación con proteínas (Fig. 3A), además la recuperación de la actividad anti TT se redujo en dichos sobrenadantes (Fig. 2).
La recuperación de proteínas y actividad anti TT en el sobrenadante para las fuerzas iónicas 0,2 a 0,4 mol/L en el rango de 3% a 5% de AC no presentaron diferencias estadísticamente significativas (p>0,05), pero existieron diferencias significativas con respecto a las fuerzas iónicas 0,05 y 0,1 mol/L (p<0,001).
Cuando se consideró toda la información obtenida, los mejores resultados, incluyendo la pureza y la actividad anti TT, se obtuvieron a la concentración de AC de 3% y la fuerza iónica de 0,2 mol/L (Fig. 1).
El análisis proteico por SDS-PAGE reveló que todos los sobrenadantes contienen principalmente IgGs(Fig. 3A) y los contaminantes fueron mayores para al AC al 1 y 2% (Fig. 3A, líneas 2 y 3) que en el resto de las concentraciones.
Los precipitados estuvieron constituidos mayormente por albúmina (Fig. 3B).
Efecto del pH sobre el fraccionamiento de antitoxina de plasma equino
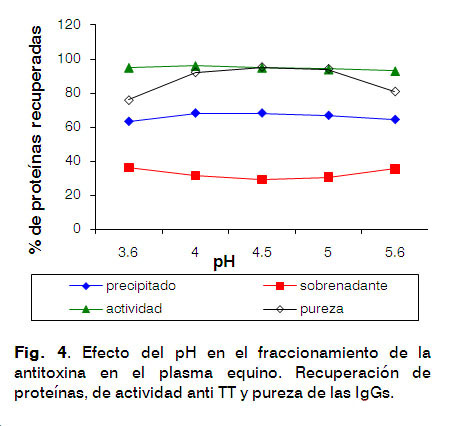
En la Figura 4, se muestra la influencia del pH sobre la purificación de IgGs del plasma de caballo.
Cuando se tomaron en cuenta la cantidad de proteína en el sobrenadante, la actividad anti TT y la pureza de las preparaciones, los mejores resultados se obtuvieron a pH 4,5; los valores de pH por debajo de 4,0 o por encima de 5,6 muestran un incremento de los contaminantes.
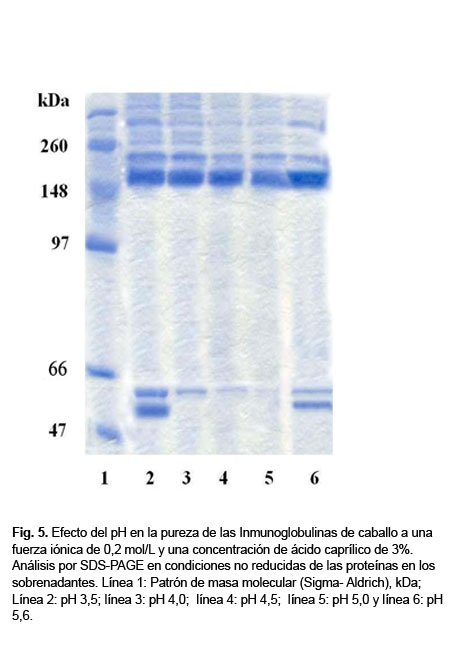
En la Figura 5 se muestra el SDS-PAGE donde se pudo observar la integridad y la pureza de las IgGs influenciadas por el pH del proceso de precipitación.
Las condiciones seleccionadas para la purificación de IgG a partir de plasma hiperinmune con AC fueron: pH 4,5;CA 3% y fuerza iónica 0,2 mol/L.
Comparación entre las antitoxinas obtenidas por fraccionamiento con ácido caprílico y precipitación con sulfato de amonio
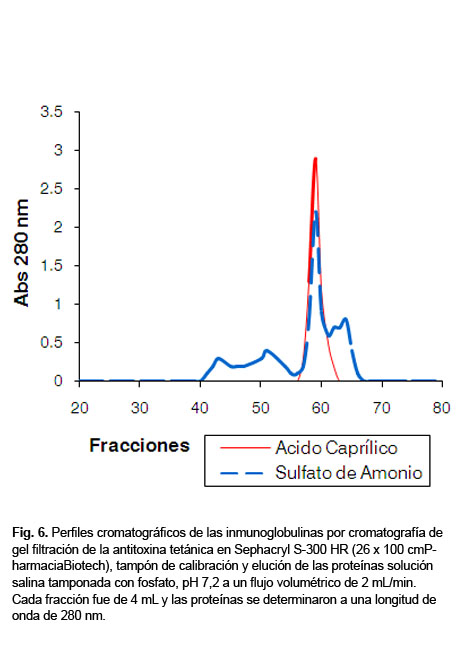
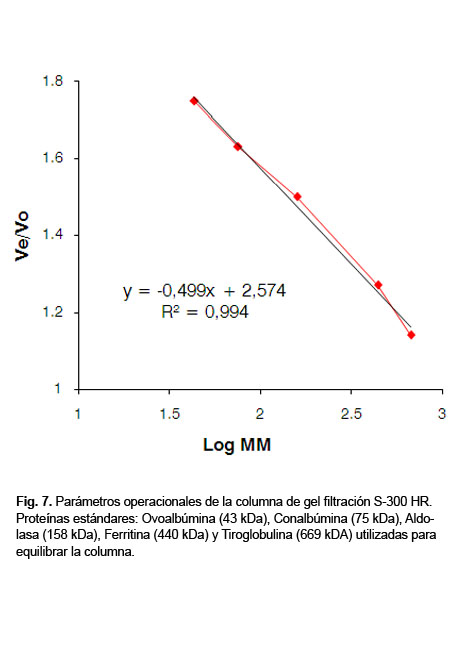
Los perfiles cromatográficos de ambas anti TT se muestran en la Figura6; uno y otro mostraron picos principales correspondientes a las IgGs y los volúmenes de elución fueron similares; picos de diferentes masas moleculares que correspondieron a valores de Ve/Vo 1,07; 1,30; y 1,73, se observan en aquella anti TT purificada por sulfato de amonio y estas disminuyeron en el proceso de purificación por AC (Fig. 6). Las masas moleculares para los valores de Ve/Vo, se determinaron por la curva de dichas masas estándares generada por la columna (Fig.7). La línea más adecuada se generó utilizando el valor Ve/Vo de las proteínas estándares contra el Log de sus masas moleculares, como se representa por la ecuación antes mencionada.
Las masas moleculares fueron cercanas a 990, 350 y 57 kDa respectivamente, correspondientes a las IgM, IgA y albúmina como contaminantes de la anti TT.
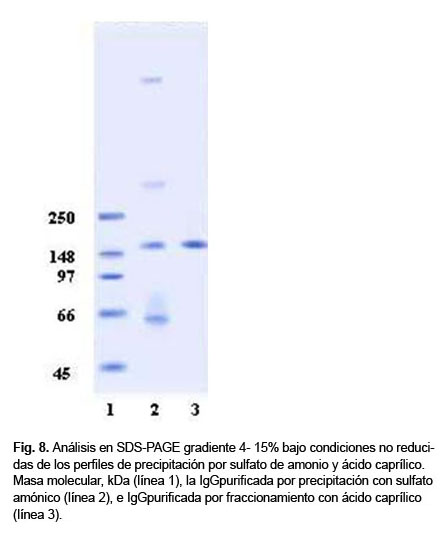
Los resultados de las cromatografías por gel filtración en SDS-PAGE se muestran en la Figura 8. Los niveles de albúmina y lo que pudieran ser IgM e IgA o proteínas agregadas se observan en la anti TT purificada por sulfato de amonio; estas fracciones están reducidas notablemente en la anti TT obtenida por fraccionamiento con AC.
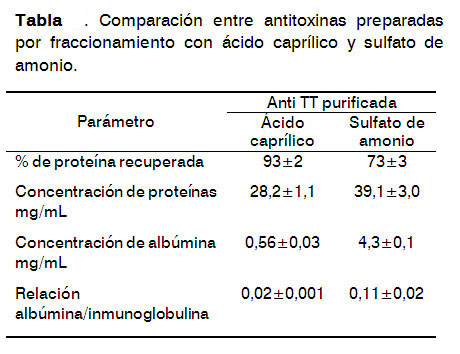
La Tabla presenta una comparación de las anti TT obtenidas por precipitación con AC y sulfato de amonio.
Los resultados indican que la antitoxina preparada por precipitación con CA fue la mejoren términos de recuperación (%) de proteínas, la concentración (mg/mL) de albúmina y proteínas y la relación albúmina/proteínas.
DISCUSION
Se ha demostrado que el AC precipita las proteínas no- IgGs del suero y otras fuentes bajo determinadas condiciones fisicoquímicas, manteniendo las inmunoglobulinas en el sobrenadante. Este proceso se utilizó y se describió su combinación con la digestión con pepsina (4) para purificar fragmentos F(ab)2.
A pesar de los estudios y utilización del AC es necesario mejorar las condiciones físico-químicas de los procedimientos para la purificación de antitoxinas de caballo y obtener productos, tanto para el diagnóstico como para el uso en la inmunoterapia, con un alto nivel de purezas y actividad específica de anticuerpos.
La fuerza iónica y el pH del medio donde se encuentra la proteína son los dos factores más importantes que afectan la solubilidad y las propiedades funcionales de las proteínas (18).
En el pH seleccionado para investigar la influencia de la fuerza iónica sobre la precipitación de las proteínas no IgGs del plasma de caballo, observamos que los niveles de proteínas precipitadas se incrementaron con el aumento de la fuerza iónica (Fig. 1); pero en ninguna de las condiciones experimentadas las proteínas contaminantes precipitaron en su totalidad, como se demuestra en la Figura 2 y la Tabla, donde se aprecia un contenido de albúmina aunque muy disminuida.
Resultados similares en los comportamientos de la recuperación de proteínas tanto en el sobrenadante como en el precipitado así como el comportamiento de la actividad de las IgGs reportaron Raweerith y Ratanabanangkoon(4).
Una dilución adecuada ayudaría a mejorar el proceso de precipitación con AC. En los experimentos se utilizó el plasma diluido 1:2, como proponen Morais y Massaldi, 2012 (13). Algunos autores utilizan el plasma sin diluir (11) para no aplicar un paso de concentración de las IgGs pues estas permanecen en el sobrenadante; otros recomiendan una dilución de 1:3 (5). Sería interesante evaluar la influencia de la concentración de proteínas totales en los rendimientos de la precipitación con AC.
La concentración de las proteínas no-inmunoglobulinas presentes en el plasma (principalmente albúmina) representa un 6 al 7%, por eso la masa determinada para la concentración de AC es de 3 a 4% para precipitar dichas proteínas del plasma diluido 1:2y en los experimentos representa una relación próxima a 1 en cuanto a la masa de proteínas no-inmunoglobulinas/AC, esto coincide con lo reportado por Morais y Massaldi, 2012 (13).
Otros investigadores declaran concentraciones de AC de 6,8% (5) y 7% (19) para el plasma sin diluir y otros utilizaron un 2,5% AC (5) para el suero diluido 1:3; esta concentración representaría un 7,5% si multiplicáramos por el factor dilución 3.
En el presente estudio correspondería a un 6% de AC. Al parecer esta variación está en dependencia de la cantidad de proteínas contaminantes presentes en los plasmas o sueros utilizados.
El pH 4,5 utilizado, está cerca del punto isoeléctrico de la albúmina, favoreciendo así la fuerza de la interacción hidrófoba. La hidrofobicidad del residuo octilo del AC, a pH bajos, domina, permitiendo que proteínas ácidas como la albúmina precipiten en la solución; las inmunoglobulinas, debido a su punto isoeléctrico (pI) básico y carga suficiente, contrarrestan dicha hidrofobicidad y permanecen en el sobrenadante (20).
Al definir las mejores condiciones para la producción IgGs de caballo, se decidió diluir el plasma 1:1 con una solución tampón de ácido acético/acetato de sodio, la fuerza iónica de 0,2 mol/L, el pH ajustado a 4,5 y añadir el AC hasta una concentración final de 3%, con agitación vigorosa durante 1 h a temperatura ambiente.
Cuando se respetan estas condiciones, se obtiene una preparación enriquecida de IgG que da un rendimiento de aproximadamente 91-95% de recuperación de proteínas pero tiene una actividad anti TT muy cercana al 100%.
Estas condiciones difieren de las descritas como óptima por otros investigadores (11) pero coincide con lo planteado por otros (5,13).Las condiciones de fraccionamiento por AC propuestas en este estudio mostraron resultados superiores (recuperación de proteínas de un 91-95% y una pureza de 91-95%) al ser comparados por los obtenidos en otros trabajos (13). Morais y Massaldi obtuvieron una recuperación de proteínas de un 90% y una pureza del 90% (13); Rojas y cols, informaron una recuperación de proteínas de un 53-67%.
Los resultados demuestran que la anti TT fraccionada con AC fue superior, con mayor rendimiento, menor contaminación de otras proteínas, además de la albúmina, que el plasma anti TT obtenido por fraccionamiento con sulfato de amonio, lo cual coincide con lo reportado por otros investigadores (11).
Se evidenció que la precipitación con AC es selectiva para las IgGs y es evidente el bajo nivel de albúmina y otras proteínas del plasma. Estas condiciones pudieran ser tomadas para la purificación de antitoxinas para el uso en humanos, pues la mayor pureza de las anti TT fraccionado con AC, junto con el bajo contenido de proteínas no-Igs y los agregados.
Estos resultados sugieren que podría inducir menos reacciones alérgicas, pues la presencia de estos contaminantes, juegan el papel más relevante en la incidencia de reacciones adversas tempranas que la presencia del fragmento Fc en IgG intactas ya que pueden estar involucrados en la actividad anticomplementaria de las antitoxinas (9).
En conclusión, se describieron condiciones para al fraccionamiento de plasma hiperinmune de caballo en la producción de antitoxinas, el procedimiento fue superior en comparación con la precipitación con sulfato de amonio, se obtuvo una preparación altamente enriquecida de IgGs con un alto rendimiento, actividad anti TT adecuada y buenas propiedades fisicoquímicas.
Debido a su eficacia y simplicidad, este procedimiento es útil en la producción de antitoxinas de caballos.
REFERENCIAS
1. Sjostrom L, Al-Abdulla I, Rawat S, Smith D, Landon J. A comparison of ovine and equine antivenoms. Toxicon 1994;32:427-33.
2. Morais VM, Massaldi H. Snake antivenoms: adverse reactions and production technology. J Venom Anim Toxins Trop Dis 2009;15(1):2-18.
3. Wagner KS, Stickings P, White JM, Neal S, Crowcroft NS, Sesardic D, et al. A review of the international issues surrounding the availability and demand for diphtheria antitoxin for therapeutic use. Vaccine 2010;28:14-20.
4. Raweerith R, Ratanabanangkoon K. Fractionation of equine antivenom using caprylic acid precipitation in combination with cationic ion-exchange chromatography. J Immunol Meth 2003;282:63-72.
5. Steimbuch M, Audran R. The isolation of IgG from mammalian sera with the aid of caprylic acid. Arch BiochemBiophys 1969;134:279-84.
6. Chen S, Lau H, Brodsky Y, Kleemann GR, Latypov RF. The use of native cation-exchange chromatography to study aggregation and phase separation of monoclonal antibodies. Protein Sci 2010;19(6):1191-1204.
7. Guang-Ping R, Li M, Xiao-Wei H, Min-Jie M, Yong Z, Ming-Qian Z, et al. Efficient production, purification, and application of egg yolk antibodies against human HLA-A*0201 heavy chain and light chain (β2m). Protein ExprPurif 2005;44:45-51.
8. Theakston RDG, Warrell DA, Griffiths E. Report of a WHO workshop on the standardization and control of antivenoms. Toxicon 2003;41:541-57.
9. León G, Lomonte B, Gutiérrez JM. Anticomplementary activity of equine whole IgGantivenoms: comparison of three fractionation protocols. Toxicon 2005;45:123-8.
10. Morais V, Massaldi H. Effect of pepsin digestion on the antivenomactivity of equine immunoglobulins. Toxicon 2005;46:876-82.
11. Rojas G, Jiménez JM, Gutiérrez JM. Caprylic acid fractionation of hyperimmune horse plasma: description of a simple procedure for antivenom production. Toxicon 1994;32:351-63.
12. Nudel BC, Perdoménico C, Iácono R, Cascone O. Optimization by factorial analysis of caprylic acid precipitation of non-immunoglobulins from hyperimmune equine plasma for antivenom preparation. Toxicon 2012;59:68-73.
13. Morais V, Massald H. A model mechanism for protein precipitation by caprylic acid: Application to plasma purification. BiotechnolApplBiochem 2012;59(1):50-4.
14. Miranda AR, Sánchez R, Góngora W, Mulet O. Obtención de sueros hiperinmunes de origen equino antitoxina tetánica, utilizando adyuvante oleoso. COCMED 2006;10(3). Disponible en: http://www.cocmed.sld.cu/no103/ n103ori8.htm
15. Lowry DH, Rosembroug NJ, Farr AL, Randal R. Protein measurement with foling phenol reagent. J Biol Chemical 1951;193:256-69.
16. Doumas BT, Watson WA, Biggs HG. Albumin Standards and the Measurement of Serum Albumin with Bromocresol Green. ClinChimActa 1971;31:87-96.
17. Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 1970;227(5259):680-5.
18. Vojdani F. Solubility. In: Methods of Testing Protein Functionality. GM Hall, ed. New York: BlackieAcademic& Professional; 1996.p.11-60.
19. Gutiérrez JM, Rojas E, Quesada L, León G, Núñez J, Laing GD, et al. Pan-African polyspecificantivenom produced by caprylic acid purification of horse IgG: an alternative to the antivenom crisis in Africa. Trans R Soc Trop Med Hyg 2005;99:468-75.
20. Wang J, Diehl T, Aguilar D, Dai XP, Arunakumari A. Precipitation of process-derived impurities in non-protein a purification schemes for antibodies. BioPharm International 2009;10(Suppl 3):4-10.
Recibido: Septiembre de 2013
Aceptado: Enero de 2014