Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Vaccimonitor
versión impresa ISSN 1025-028X
Vaccimonitor vol.23 no.2 Ciudad de la Habana Mayo.-ago. 2014
ARTÍCULO ORIGINAL
Validación del método de Ellman para la determinación de la concentración de grupos sulfhidrilosa muestras de la producción de la vacuna sintética contra el Haemophilus influenzae tipo b
Validation of Ellman's method for determining sulfhydryl group concentrationin samples of the synthetic vaccine against Haemophilus influenzae type b
Mayra Wood-Duque,*Neyda Hernández-Caso, Iliana Delgado-Martínez, Margela Montañez-Valdez, Julio Cesar Sánchez-García
Centro de Ingeniería Genética y Biotecnología (CIGB). Ave 31 entre 158 y 190. Cubanacán. Playa. La Habana, Cuba. Apartado Postal 6162.
email: mayra.wood@cigb.edu.cu
*Licenciada en Tecnología de la Salud. Especialidad Microbiología.
RESUMEN
Se validó el método de Ellman para la determinación de grupos sulfhidrilos de la producción del Ingrediente Farmacéutico Activo de la vacuna contra el Haemophilusinfluenzaetipo b (Hib). Se evaluaron los parámetros: linealidad, rango de trabajo, especificidad, exactitud y precisión. El método fue lineal en el rango de 0,25-4 mM/L. Se demostró que la técnica fue específica con una exactitud entre 95 y 105%. La repetibilidad y la precisión intermedia mostraron coeficientes de variación inferiores al 5% y 10% respectivamente, por debajo de los criterios de aceptación requeridos para estos parámetros. Se estableció el reactivo hidrocloruro de L-cisteína monohidratado como control positivo del método. Este ensayo por su precisión, especificidad y exactitud se convierte en una eficaz herramienta para el control del proceso de obtención de esta vacuna.
Palabras claves: Haemophilus influenzae, método Ellman, validación.
ABSTRACT
Ellman´s method for determining sulfhydryl groups in the Haemophilusinfluenzae type b vaccine was validated. The following parameters were evaluated: linearity and working range, specificity, accuracy and precision. The method has proven to be linear in the range from 4 to 0.25 mM/L, it also demonstrated to be specific with accuracy from 95 to 105%. Repeatability and intermediate precision showed coefficients of variation of less than 5% and 10% respectively, below the acceptance criteria required for these parameters. L-cysteine hydrochloride monohydrate reagent was established as a positive control. Taking into account its precision, specificity and accuracy; this method becomes a necessary tool for carrying out process control in order to obtain this vaccine.
Key words: Haemophilus influenzae, Ellman´s method, validation.
INTRODUCCIÓN
Las enfermedades producidas por Haemophilusinfluenzaetipob (Hib) son reconocidas a nivel mundial como una problemática de salud. Previo al empleo rutinario de la vacuna conjugada contra esta bacteria, este microorganismo era la principal causa de meningitis bacteriana y el responsable de un gran número de otras infecciones.
La vacuna Quimi-Hib es una vacuna conjugada frente a la enfermedad invasora producida por el germen Haemophilusinfluenzaede serotipo b. Gracias a su utilización masiva en la edad pediátrica esta enfermedad está prácticamente erradicada. El uso de vacunas conjugadas coincidió con una disminución de hasta un 97% de las enfermedades invasoras por Hib en países donde su aplicación es rutinaria (1).
En el Departamento de Control de Procesos del Centro de Ingeniería Genética y Biotecnología (CIGB), se analizan muestras procedentes del proceso de obtención del Ingrediente Farmacéutico Activo (IFA) para la vacuna contra el Haemophilusinfluenzae tipo b.La vacuna Quimi-Hib se conforma a partir de dos materias primas fundamentales: el polirribosilribitol fosfato (PRP) procesado que es una fracción del polisacárido capsular, que se obtiene por síntesis química (2) en el CIGB y la proteína portadora Anatoxina Tetánica Purificada Estéril (ATPE), suministrada por Vacunas Finlay, S.A.
En la obtención de Quimi-Hib se modifica la proteína portadora introduciéndole grupos sulfhidrilos en su cadena. Los pasos del proceso productivo correspondientes a la obtención de la Anatoxina Tetánica Modificada (ATM) y la Anatoxina Tetánica Conjugada (ATC) son muestreados para la determinación de grupos sulfhidrilos (SH) por el método de Ellman(3), que se fundamenta en la propiedad del reactivo Ellman (ácido 5,5'-ditiobis 2-nitrobenzoico) de oxidar los SH libres, interaccionando con el grupo tiol para dar ácido tionitrobenzoico en una reacción equimolar para cada residuo de cisteína en una solución estabilizadora de dihidrogenofosfato de sodio. Es una reacción cuantificable que mide el número de cisteína presente en una muestra. Como resultado se obtiene la formación de un complejo amarillo que absorbe luz en la región visible del espectro, con máxima absorción a una longitud de onda de 412 nm.
Los métodos analíticos que se utilizan en los laboratorios se validan como garantía de calidad (4). La validación es la metodología para la obtención de pruebas que documentan y demuestran experimentalmente que un proceso es lo suficientemente fiable para producir el resultado previsto dentro de los intervalos definidos (5). Las normas de Buenas Prácticas de Fabricación, la Convención de Farmacopeas y la Conferencia Internacional de Armonización plantean que la validación debe aplicarse tanto a los procesos de fabricación como a los métodos de análisis y control (6).
El uso rutinario de un procedimiento analítico requiere la implementación de controles que permitan detectar oportunamente errores que se cometen y facilitan el monitoreo continuo del ensayo mediante gráficos de control o tendencias para establecer las medidas correctivas y preventivas (7).
Basados en estos criterios se plantea como objetivo de este trabajo realizar la validación del método de Ellman para la determinación de grupos SH a muestras procedentes del proceso de producción del IFA de la vacuna sintética contra Hib, al cumplir con las exigencias de las organizaciones reguladoras nacionales como el Centro Estatal de Control de Medicamentos (CECMED) e internacionales que exigen validar los procedimientos analíticos y de control que se relacionan con todo el proceso de producción de un fármaco (8, 9).
MATERIALES Y MÉTODOS
Muestras y soluciones
Para la realización del método en estudio se utilizó el reactivo de Ellman (Merck) como agente oxidante a una concentración de 4 g/L, se utilizó la solución de hidrogenofosfato de disodio 1N; pH 8, (Merck) como solvente y estabilizante de la reacción. Las determinaciones se realizaron diluyendo en agua desoxigenada.
A partir de la solución de referencia Glutatión 4 mM (Applichem) empleada para la curva de calibración se prepararon diluciones para obtener concentraciones entre 0,25 y 4 mM/L, cubriendo el rango de trabajo establecido. Este experimento se realizó por duplicado para cada concentración.
Se utilizó el reactivo hidrocloruro de L-Cisteína monohidratado (Applichem), que contiene un grupo sulfhidrilo en su estructura, con peso molecular 175 g/mol, como control positivo del método.
Las muestras que se emplearon procedían de dos lotes del proceso de producción del IFA para la obtención de la vacuna contra Haemophillusinfluenzaetipo b. Se analizaron la ATM y la ATC. Se estudiaron los tampones correspondientes a estas muestras del proceso: ATM-Tampón PBS pH 7,4 y ATC-Tampón fosfato para formulación pH 6,8. Se estudió la ATPE con el fin de evaluar la posible interferencia de su estructura en el procedimiento en análisis.
Procedimiento del método Ellman
A un volumen de 50 µL de muestra, blanco (agua desoxigenada), sustancia de referencia y control positivo en tubo de ensayo se le añadió 50 µL de solución del reactivo Ellman 4 g/L.
Se adicionó 2,5 mL de la solución de hidrogenofosfato de disodio 1N pH 8, se homogenizó en vórtex durante 3 s y se mantuvo en reposo por 15 min a temperatura ambiente. Se leyó a 412 nm en un espectrofotómetro (modelo Ultrospec 2000 PharmaciaBiotech), siguiendo las instrucciones del procedimiento de operación del equipo.
Para el procesamiento de los resultados se empleó una hoja de cálculo en Excel. Se determinó el valor de concentración de cada punto de la curva de calibracion a partir de las absorbancias y se obtuvo un ajuste lineal a partir de la ecuación y = mx + b.
La concentración de las muestras y del control positivo se calculó a partir de los valores de absorbancias mediante el método de mínimos cuadrados. Se promediaron los valores de las concentraciones (mM/L) obtenidas cuyas absorbancias se encuentran dentro del rango de la curva de calibración y que su coeficiente de variación intra-ensayo fue inferior al 5%. Se utilizó el programa STATGRAPHICS Centurion XV para realizar los cálculos y procesamientos estadísticos.
Validación del método
El método se validó mediante la evaluación de los parámetros siguientes: linealidad y rango de trabajo, especificidad, exactitud y precisión, de acuerdo con la clasificación a la que pertenece: Métodos de contenido o potencia (4- 6, 8-10).
Linealidad y rango de trabajo. Se realizaron cinco curvas de calibración independientes, con dos réplicas para cada uno de los seis puntos, con la solución de referencia Glutatión 4mM en el rango: 0,25 y 4mM/L, para determinar la relación existente entre concentración del analito y la respuesta (absorbancia a 412 nm) (9). Se procedió al ajuste de los valores de absorbancia con los de concentración mediante el método de los mínimos cuadrados lineales. Se calculó el coeficiente de determinación (R2≥0,98) y el ANOVA de significación de la pendiente (p≤0,01). El rango de trabajo se estableció mediante el análisis de cada uno de los puntos del intervalo lineal de la curva de referencia. Se estudió la exactitud de cada punto de la curva, al calcular la t de Student experimental y se comparó con la tabulada, para un nivel de significación del 95% y n-1 grados de libertad y se calculó el intervalo de confianza con igual nivel de significación. Se determinó la precisión de cada punto, mediante el cálculo del Coeficiente de Variación (CV).
Especificidad. Se preparó una curva patrón en agua desoxigenada y otra con cada uno de los tampones que se utilizan en el proceso de producción de las muestras que se analizaron y con la ATPE. Se realizó una comparación mediante un ANOVA de la pendiente e intercepto de la curva de referencia y la curva preparada para cada solución en estudio (6). Se calculó el valor de la probabilidad para un 95% de confianza y los grados de libertad totales.
Exactitud. Se preparó una muestra de hidrocloruro de L-cisteína monohidratada en tres concentraciones diferentes: valor bajo (28,5 mM/L), valor medio (57,0 mM/L) y valor alto (114,0 mM/L) (4). Se calculó el valor de la t de Student para un nivel de significación del 95% y n-1 grados de libertad y el valor de probabilidad para cada concentración analizada. Se calculó el por ciento de recobrado, como el cociente entre el valor calculado y el valor esperado multiplicado por 100.
Se realizó un análisis de regresión lineal al utilizar como variable dependiente el valor obtenido y como variable independiente el valor esperado.Se determinaron el coeficiente de determinación (R2 ≥ 0,98) y el ANOVA de significación de la pendiente (p ≤ 0,01), así como los intervalos de confianza, tanto de la pendiente como del intercepto.
Precisión. Para la realización de este experimento cada analista preparó sus soluciones de trabajo. Se evaluaron los parámetros de precisión intermedia y repetibilidad (4,6). Para la precisión intermedia (inter-ensayos) se realizaron tres determinaciones en tres días diferentes por 2 analistas (CV ≤ 10%).
Para la repetibilidad (intra-ensayos) se estudió el comportamiento de las muestras al realizar tres determinaciones por muestra en un mismo ensayo (CV ≤ 5%). Para ambas se determinó media, desviación estándar y coeficiente de variación de cada muestra.
Establecimiento del control positivo
Para la utilización rutinaria de un procedimiento analítico es importante su monitoreo de manera que exista una vigilancia continua de la calidad que permita comprobar su funcionamiento de acuerdo con las aplicaciones para las cuales fue diseñado (8).
Este seguimiento se puede realizar mediante gráficos de control que representen los resultados de un parámetro específico (control interno, muestra control o estándar internacional) en el tiempo; los cuales proporcionen información valiosa sobre las tendencias, y demuestren el control, la consistencia y la fiabilidad de la prueba (7).
Se seleccionó el reactivo hidrocloruro de L-cisteína monohidratado (Applichem) paraestablecerlo como control positivo. Este reactivo fue conservado de forma adecuada a temperatura ambiente, fue estable durante al menos 5 años. Se pesó 0,01g de este aminoácido y se le adicionó 1 mL de agua desoxigenada. Se realizaron 50 determinaciones individuales en ensayos diferentes, se determinó el coeficiente de variación y se realizó un gráfico de control para establecer el valor de referencia y el rango de trabajo definido como µ±3DE (7). Se determinó la normalidad de la distribución. Se realizó la prueba de t deStudentpara evaluar la exactitud de las mediciones realizadas al compararse con el valor de referencia.
RESULTADOS Y DISCUSION
De acuerdo con diferentes Comités Internacionales de Armonización, la validación de un procedimiento analítico es necesaria para demostrar que el mismo ofrece resultados válidos y coherentes con el objetivo para el cual fue diseñado (6, 11, 12).
El diseño que se empleó en esta validación se realizó teniendo en cuenta la clasificación de las agencias regulatorias del uso de medicamentos (8, 9).
Acorde con las exigencias de los documentos que se consultaron, los parámetros que se evaluaron fueron: linealidad y rango de trabajo, especificidad (interferencia), exactitud y precisión.
Linealidad y rango de trabajo
En los 5 experimentos realizados se obtuvo un valor de probabilidad asociada al valor de F inferior a 0,01, lo cual indica que no se cumple la hipótesis nula (pendiente = 0) y que ajustando los valores obtenidos a una recta se elimina la dispersión de los valores de absorbancia respecto a la media de los mismos, por lo que se plantea que existe una relación lineal entre la relación de absorbancia a 412 nm y la concentración de la sustancia de referencia Glutatión. Se calculó el coeficiente de determinación (R2) y en todos los casos se obtuvieron valores
superiores a 0,99. Los resultados de los análisis estadísticos evidencian el cumplimiento de los criterios de aceptación propuestos para estas pruebas (Tabla 1).
El rango de trabajo que se estableció está comprendido en el intervalo de concentraciones desde 0,25 hasta 4 mM/L. La Tabla 2 muestra los resultados del análisis estadístico tanto para el cálculo de la tdeStudent, los intervalos de confianza y el coeficiente de variación.
Cada uno de los puntos de la curva, tienen un CV inferior al 10% y las concentraciones de referencia son comparables con los resultados experimentales obtenidos en los ensayos, así lo indican los valores de la tdeStudent calculados que son menores que la tdeStudenttabuladacon 9 grados de libertad. Los intervalos de confianza en todos los puntos incluyen el valor esperado
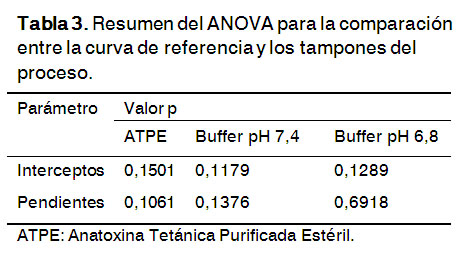
Especificidad (interferencia)
El valor de la probabilidad obtenido es mayor que 0,05, para un nivel de significación del 95% de confianza y 3 grados de libertad totales (Tabla 3). Esto demuestra que no hay diferencia significativa entre las pendientes e interceptos de la curva de referencia y las curvas que se realizaron con la ATPE y las soluciones tampones de las muestras del proceso analizadas.
Estos resultados corroboran que la estructura de la ATPE y los tampones del proceso no interfieren en la cuantificación de los grupos sulfhidrilos.
Exactitud
La recuperación analíticapor lo general se asociaconla preparación de muestras y laextraccióndel analitode una muestra (9).
Este recobradose reporta comoel cocientedela concentración obtenida ylaconcentración esperada, expresado en por ciento. Los valores obtenidos se encuentran en el rango de recobrado establecido entre 90 y 110% (Tabla 4), demostrándose la exactitud del método (13, 14).
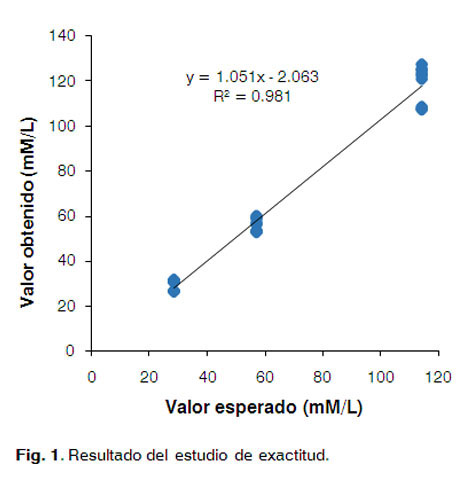
En la Figura 1 se observa la correlación entre el valor esperado y el observado, el valor de p es menor que 0,01, lo que indica que existe una relación estadísticamente significativa entre las variables estudiadas con un 99% de confianza.
Esto se corrobora con la determinación de los intervalos de confianza de la pendiente [-3,24613 - 5,34891] y del intercepto [-6,51487-2,38709], los cuales incluyen al valor unitario y al cero respectivamente.
El R2 (0,9818) indica que el modelo seleccionado explica el 98,18% de la variabilidad de los valores obtenidos. Se puede concluir que existe una relación estadísticamente fuerte entre ambas variables.
Estos resultados demuestran que el método en estudio es exacto en la determinación de los grupos sulfhidrilos libres.
Precisión
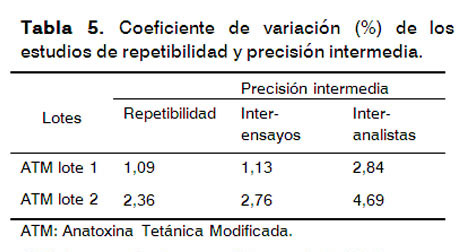
Para determinar la repetibilidad y precisión intermedia del ensayo se analizaron dos lotes de la muestra ATM. No se analizaron las muestras de ATC de estos lotes debido a que en el diseño del proceso productivo este producto intermedio no es cuantificable por este método y se cumplió con el criterio de aceptación establecido, CV ≤ 10% parala precisión intermedia y CV ≤ 5% para la repetibilidad (15). Los resultados se reflejan en la Tabla5.
En el estudio de precisión intermedia se demuestra, además, que el factor analista no contribuye a la variabilidad del ensayo. El ensayo permite cuantificar con precisión las muestras del proceso productivo.
Establecimiento de control positivo de la técnica
Las técnicas validadas deben ser monitoreadas a intervalos regulares a través de gráficos de control que posibiliten mantener el control sobre el desempeño rutinario del ensayo (6). Para esto es necesario el establecimiento de un control positivo, para asegurar el desempeño y la funcionalidad del sistema. Su establecimiento permite mantener el proceso bajo control, demostrar su fiabilidad, asegurar que las soluciones fueron correctamente preparadas, que mantienen su estabilidad y detectar errores de medición y tomar medidas correctivas (7, 16).
Para asegurar la confiabilidad de este ensayo se seleccionó el aminoácido hidrocloruro de L-cisteína monohidratado, como candidato a control positivo de esta técnica, que contiene un grupo sulfhidrilo en su estructura. Este grupo tiol le confiere gran reactividad a la molécula. Para esta selección se valoró que la reacción entre el aminoácido seleccionado y el reactivo de Ellman es estequiométrica, se produce un mol de producto por cada mol de sustancia reaccionante al igual que en la reacción entre el material de referencia y el reactivo de Ellman. Además las condiciones de pH en las que se desarrolla el método favorecen la reacción al convertirse en un procedimiento rápido y sensible para la determinación de grupos sulfhidrilos en el control de proceso (3).
En la Tabla 6 se muestran los estimadores calculados. Se puede apreciar que las determinaciones siguen un comportamiento normal pues tanto la kurtosis como la skewness estandarizada se encuentran en el rango de ±2.
El coeficiente de variación es inferior al 5% y el valor de probabilidad del estadígrafo t es mayor de 0,05 por lo que aceptamos la hipótesis de que la media de las determinaciones es igual a 57 mM/L con un 95% de confianza. El rango de trabajo quedó establecido entre 53,37 y 60,94 mM/L.
Teniendo en cuenta estos resultados se puede concluir que el ensayo es exacto y reproducible en el tiempo pues los valores que se obtienen cumplen con las premisas de los gráficos de control (Fig. 2), siguen un patrón aleatorio.
Los resultados de la validación del método demostraron que cumple con los criterios de aceptación para todos los parámetros de calidad que se evaluaron (6, 9).
Además, presenta la ventaja de ser una técnica rápida, poco costosa y sensible en la determinación de grupos sulfhidrilos libres por lo que puede ser una herramienta eficaz para el control de proceso en la obtención del IFA de la vacuna contra el Haemophilusinfluenzae tipo b.
REFERENCIAS
1. Bacardí D, Cosme K, Aldana L, Merino N, Suárez J, Mosqueda O, et al. Seguridad preclínica de la vacuna Quimi-Hib®adyuvada con fosfato de aluminio durante el desarrollo del producto. Biotecnología Aplicada 2013;30(2):111-7.
2. Vérez-Bencomo V, Fernández-Santana V, Hardy E, Toledo ME, Rodríguez MC, Heynngnezz L, et al. A Synthetic Conjugate Polysaccharide Vaccine against HaemophilusinfluenzaeType b. Science 2004;305(5683):522-5.
3. Ellman GL, Courtney KD, Andres V, Featherstone RM. A new and rapid colorimetric determination of acetylcholinesterase activity. BiochemicalPharmacology 1961;7:88-95.
4. Oficina de las Naciones Unidas contra la Droga y el Delito (UNODC). Directrices para la validación de métodos analíticos y la calibración del equipo utilizado para el análisis de drogas ilícitas en materiales incautados y especímenes biológicos. Nueva York: UNODC; 2010.
5. The United States Pharmacopeial Convention. Farmacopea de los Estados Unidos de América (USP 35); Trigésima Quinta Revisión. Rockville: United Book Press, Inc; 2012.p.1-100.
6. International Conference of Harmonization (ICH). ICH HarmonizedTripartiteGuideline, Q2 (R1) Validation of analytical procedures: Text and Methodology. Geneva: ICH; 2005.p.1-13.
7. Rego A, Pérez H, López L, Carlos N. Mejoras en el proceso evaluativo de la calidad del diagnóstico en los laboratorios con tecnología SUMA. Biotecnología Aplicada 2012; 29(4):230-3.
8. Centro para el Control Estatal de la Calidad de los Medicamentos (CECMED). Regulación No.37-2012: Validación de Métodos Analíticos. La Habana: CECMED; 2012.
9. National Association of Testing Authorities, Australia (NATA). Technical Note 17 Guidelines for the validation and verification of quantitative and qualitative test methods. Sydney: NATA; 2013.
10. Walfish S. Analytical Methods: A Statistical Perspective on the ICH Q2B Guidelines for Validation of Analytical Methods. BioPharm International 2006;19(12):9-14.
11. International Organization for Standardization (ISO). ISO/IEC 17025 General Requirements for the Competence of Testing and Calibration Laboratories. Geneva: ISO; 2005.p.1-120.
12. Thompson M, Ellison SLR, Wood R. Harmonized Guidelines for Single-Laboratory Validation of Methods of Analysis. IUPAC Technical Report, Pure and Applied Chemistry 2002;74:835-55.
13. Feinberg M, Granier G, Mermet JM. Interpretation of Interlaboratory Trial Based on Accuracy Profiles. Journal of AOAC International 2010;93(2):725-33.
14. Instituto de Salud Pública de Chile. Validación de métodos y determinación de la incertidumbre de la medición: Aspectos generales sobre la validación de métodos. Guía técnica 2010. Santiago de Chile: ISP; 2010.p.1-30.
15. Fontenay G. Is my method (still) valid? Some points to ponder. Technical Bulletin 62. Geneva: SGS LifeScience; 2013.p.1-5.
16. Meneces N, Olivera SA, Saccone CD, Tessore J. Effect of resolution of measurements in the behavior of exponentially weighted moving average control charts. PDA Journal of PharmaceuticalScience and Technology 2013;67:288-95.
Recibido: Diciembre de 2013
Aceptado: Febrero de 2014