My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Vaccimonitor
Print version ISSN 1025-028X
Vaccimonitor vol.23 no.3 Ciudad de la Habana Sept.-Dec. 2014
ARTÍCULO ORIGINAL
Establecimiento de un ensayo de potencia in vivo para el antígeno de superficie recombinante del virus de la Hepatitis B, en vacunas monovalentes y combinadas
Establishment of an in vivo potency assay for the recombinant hepatitis B surface antigen in monovalent and combined vaccines
Mabel Izquierdo-López,* Karelia Cosme-Díaz, Gerardo García-Illera, Zoe Núñez-Lamotte, Yamila Martínez-Cuéllar, Maribel Vega-Simón, Lourdes Costa-Anguiano, Marisel Quintana-Esquivel, Ileana Rosales-Torres, Omar Mosqueda-Lobaina
Centro de Ingeniería Genética y Biotecnología. Ave 31 e/ 158 y 190. Apartado Postal 10600. La Habana, Cuba.
email: mabel.izquierdo@cigb.edu.cu
* Máster en Ciencias en Tendencias de la Biotecnología Contemporánea, Jefa del Departamento de Biológicos. Dirección de Control de la Calidad, CIGB.
RESUMEN
En este trabajo se presenta el establecimiento de un ensayo de potencia en ratones con el objetivo de demostrar el poder inmunogénico del antígeno de superficie recombinante del virus de la Hepatitis B en vacunas monovalentes y combinadas producidas en el Centro de Ingeniería Genética y Biotecnología. El ensayo de potencia es un parámetro dentro del control de calidad y sirve como herramienta para la demostración de la consistencia del proceso productivo. Para el establecimiento del ensayo se evaluaron parámetros como: tiempo de duración, cantidad de animales a emplear, así como diferentes zonas para el mantenimiento de los animales. Se presentan los resultados obtenidos sobre la aplicabilidad de este ensayo a dos presentaciones de la vacuna; vacuna monovalente Heberbiovac HB, y la vacuna pentavalente líquida en un solo vial Heberpenta-L, para lo cual se realizaron estudios de especificidad y la evaluación de diferentes lotes de vacuna, el comportamiento de la linealidad y el paralelismo, así como también el establecimiento de las especificaciones de calidad del ensayo. Con el ensayo de potencia se han obtenido resultados confiables para las vacunas evaluadas y ha permitido la evaluación de forma consistente de su poder inmunogénico, así como el monitoreo de los diferentes procesos productivos.
Palabras clave: hepatitis B, ensayo de potencia, vacunas combinadas, vacuna anti-hepatitis B recombinante.
ABSTRACT
In this paper the development of potency assay in animals (mice) was made, with the objective of demonstrating the immunogenic power of the recombinant Hepatitis B surface antigen in monovalent and combined vaccines, produced at the Center of Genetic Engineering and Biotechnology. The potency test is a parameter in quality control and it is also a tool to demonstrate the consistency of the production process. Parameters such as duration of the test, number of animals in the test, as well as different areas for the maintenance of the animals were evaluated. The results on the applicability of the potency test, to two presentations of the vaccines; monovalent Heberbiovac HB and pentavalent liquid in one vial Heberpenta-L are shown, for which specificity studies, evaluating different vaccine lots, the behavior of linearity, and parallelism, as well as establishing quality specification of the test were performed. This assay led to the obtainment of reliable results for the vaccines evaluated, the consistent evaluation of the immunogenic power and the monitoring of different production processes.
Keys words: hepatitis B, potency test, combined vaccines, recombinant hepatitis B vaccine.
INTRODUCCIÓN
La infección con el virus de la hepatitis B es una enfermedad que azota a millones de personas en el mundo. Desde la década de los 80, muchos investigadores trabajaron en la búsqueda de una vacuna como medida preventiva para esta enfermedad. Las primeras vacunas obtenidas fueron contra el antígeno de superficie del virus de la hepatitis B (AgsHB) de origen plasmático.
Con el avance en la genética molecular y la química de los ácidos nucleicos, se obtuvieron vacunas por la tecnología del ADN recombinante mediante la inserción del gen que codifica para el antígeno de superficie del virus de la hepatitis B (AgsHBrec) en células de levadura como Saccharomyces cerevisiae y Pichiapastoris al igual que en células de mamíferos. La Organización Mundial de la Salud (OMS) estableció requerimientos para la producción y control de la vacuna para garantizar y asegurar la seguridad, calidad, eficacia y potencia de la misma (1, 2). Dentro de estos requerimientos se plantea que la vacuna debe tener una respuesta de anticuerpos específica para el AgsHBrec en animales de laboratorio, por lo que recomiendan un ensayo de potencia en animales (ratones) con el objetivo de garantizar el poder inmunogénico previo a la fase de estudios clínicos.
De igual forma la Farmacopea Europea en su edición 7.3 del 2012 (3), recomienda los criterios de aceptación del lote y el ensayo. En ambos documentos oficiales se establece que este ensayo se debe emplear en el control de calidad del producto terminado, como un criterio de liberación lote a lote. La OMS plantea que los estudios preclínicos (ensayos de potencia, estudios de toxicidad) son herramientas de gran valor para identificar posibles riesgos de la vacunación y establecer posibles protocolos de estudios clínicos (4), por lo que el ensayo de potencia en ratones como técnica de control de calidad debe cumplir con las buenas prácticas de laboratorio y con las regulaciones nacionales e internacionales. Los aspectos fundamentales para el establecimiento del ensayo de potencia en animales son los siguientes: el animal que incluye información sobre la línea y el sexo, el ensayo analítico para la detección de anticuerpos y el valor del corte del sistema para el análisis de la seroconversión.
Desde la década de los 90, la tendencia actual entre los productores de vacunas es el uso de vacunas combinadas, las que son definidas por la OMS (4) de la siguiente forma: las vacunas combinadas son vacunas constituidas por dos o más antígenos, estos antígenos los combinan los productores o los mezclan en el momento antes de la administración con el objetivo de proteger contra diferentes enfermedades infecciosas o contra enfermedades infecciosas causadas por diferentes cepas o serotipos de un mismo organismo. Las vacunas combinadas presentan dos grandes ventajas que justifican su amplia aceptación en el campo de la vacunación: 1) con una sola inmunización las personas quedan protegidas contra varios antígenos y 2) es más factible económicamente su uso en campañas masivas de inmunización, disminuyendo los costos. Esto hace que se preste una especial atención desde el punto de vista regulatorio, al establecer requerimientos productivos y de control de calidad al mismo nivel que los componentes monovalentes. La demostración del poder inmunogénico para cada uno de los componentes es un requerimiento y la no interferencia entre ellos es un requisito indispensable como criterio de calidad de la vacuna.
Para evaluar la potencia biológica de una vacuna se impone el empleo de un material de referencia para asignarle esta propiedad; este material de referencia se calibra contra una preparación de referencia internacional comercialmente disponible (4) y para la vacuna antihepatitis B recombinante tiene que ser previamente evaluado en la clínica (1).
Por ser la primera vacuna que se obtiene por la tecnología de ADN recombinante en nuestros laboratorios, se enfocó el trabajo al cumplimiento de las regulaciones nacionales e internacionales para el establecimiento de las pruebas biológicas, para poder demostrar en estudios clínicos la seguridad y eficacia de la vacuna y obtener un producto altamente competitivo (4).
MATERIALES Y MÉTODOS
Materiales biológicos, reactivos, y equipamiento que se utilizaron en el ensayo de potencia para la vacuna antihepatitis B recombinante
Material biológico
Animales. Ratones hembras de la línea BALB/c isogénicos de haplotipo H-2d o H-2K de 5 a 6 semanas de nacidos con un peso promedio de 16 g. Obtenidos, transportados y mantenidos en condiciones controladas, suministrados por el Centro Nacional de Producción de Animales de Laboratorio (CENPALAB).
Materiales de referencia. Material de referencia secundario de la vacuna recombinante contra la hepatitis B, preparado en el Centro de Ingeniería Genética y Biotecnología (CIGB), código Vac HB 07- 0209.Preparación de referencia internacional (Vacuna contra la Hepatitis B derivada de plasma) para ensayos de inmunogenicidad Código: 69/19.
Muestras. Lotes de vacuna antihepatitis B recombinante y lotes de vacuna combinada pentavalente líquida en un solo vial Heberpenta–L contra difteria, tétanos, pertussis (DTP), hepatitis B y Haemophilus influenzae tipo b (Hib). Ambas se produjeron en el CIGB, así como lavacuna contra DTP suministrada por el Instituto Finlay, Lote 4004.
Reactivos Biológicos. Suero de ratón negativo alAgsHB y de anticuerpos anti-hepatitis B. AgsHB conjugado con peroxidasa, producido por el CIGB de Sancti Spíritus. AgsHBrec producido en el CIGB de La Habana. Suero humano negativo de AgsHB y de anticuerpos anti-hepatitis B. Patrón de impurezas proteicas de levadura no transformada (Pichiapastoris), obtenido en el CIGB de La Habana, Cuba y anticuerpo policlonal humano anti-AgsHBrec.
Establecimiento del ensayo de potencia para la vacuna antihepatitis B recombinante
En el ensayo de potencia que se desarrolló en las instalaciones de animales y en los laboratorios de control de la calidad del CIGB, se establecieron las recomendaciones que se describen a continuación:
Ratones BALB/c, haplotipo H-2d o H-2K. Vía de inoculación intraperitoneal. Tiempo de duración de la respuesta de anticuerpos 6 semanas. Sistema ELISA para la evaluación de la respuesta de anticuerpos anti-AgsHB. Como criterios de validez del ensayo se estableció el cumplimiento de la linealidad, el paralelismo, la dosis efectiva 50 (DE50) con valores entre la dosis mínima y máxima inoculada, los intervalos de confianza del estimado de potencia con valores entre un 33-300% y el límite superior del estimado de potencia relativa mayor o igual que 1.
Adicionalmente se estableció 0,5 como límite inferior para la potencia relativa al basarse en lotes que se evaluaron en estudios clínicos.
Sistema ELISA para la determinación de anticuerpos anti-AgsHB
Para la determinación de la respuesta de anticuerpos anti-AgsHB en el suero de los animales, se empleó un sistema ELISA basado en el principio del sándwich (6). La placa que constituye la fase sólida fue recubierta con AgsHBrec. Posteriormente se adicionó las muestras y se incubó a 37°C durante 2 h. A continuación se añadió el AgsHB marcado con peroxidasa de rábano picante que constituye el conjugado. Como cromógeno de la reacción se empleó ortofenilendiamina y como sustrato el peróxido de hidrógeno. La presencia de anticuerpos se detectó mediante la aparición de un complejo amarillo-naranja, cuya lectura se realizó a una longitud de onda de 492nm.
Cálculo del valor de corte de la placa para declarar muestras positivas y negativas de anticuerpos
Cálculo del valor de corte
Valor de corte = 0,4 (N + Pl)
N: media de los controles negativos de los placebos.
PI: media de los controles positivos bajos del sistema ELISA.
Análisis de la positividad o negatividad de las muestras:
Muestra positiva de anticuerpos anti-AgsHB: Cuando la densidad óptica de la muestra sea igual o mayor que el valor de corte de los placebos.
Muestra negativa de anticuerpos anti-AgsHB: Cuando la densidad óptica de la muestra sea inferior al valor de corte de los placebos.
Calculo de la potencia
Al calcular los porcientos de seroconversión (porciento de animales, cuyas unidades de absorbancia del suero están por encima del valor de corte del sistema ELISA), se procedió al cálculo de la DE50 y la potencia relativa al utilizar el programa Potencia que se desarrolló en la Dirección de Control de Calidad para este ensayo, siguiendo lo propuesto por Finney (7).
El programa Potencia realiza una transformación Probitt de los % de seroconvertidos. La DE50 se calculó al ajustar por separado los datos de las muestras y el patrón, en tanto para la potencia se ajustó los datos del patrón y la muestra a dos rectas paralelas.
En el establecimiento del ensayo se estudió la fuente de mayor variabilidad que es el animal, al centrarse en los siguientes aspectos:
-Estudio de la reducción del número de animales.
-Estudio de duración del ensayo en animales realizado para 28 y 42 días.
-Estudio de las diferentes zonas para la realización del ensayo.
Estudio de reducción del número de animales
Para el estudio de reducción del número de animales, se empleó en el ensayo la n de 20 ratones que recomienda la OMS (1) y la n de 10 ratones con el objetivo de disminuir el número de animales a la mitad. Se evaluaron tres lotes de vacuna Heberbiovac HB, cada lote se ensayó de forma paralela en ambos grupos. Los sueros colectados se almacenaron a -20°C y se evaluaron para las dos condiciones en el mismo ensayo ELISA, para la determinación de anticuerpos anti-AgsHB. Se calculó el intervalo de confianza al 95% y para la demostración de la existencia o no de diferencias significativas se empleó el estadígrafo Chi cuadrado y un α=0,05 (5).
Estudio de duración del ensayo para28 y 42 días
Para este estudio se evaluaron de forma paralela 5 muestras de vacuna Heberbiovac HB, cada lote de vacuna se evaluó por duplicado en el mismo ensayo y los animales fueron desangrados a los 28 y 42 días de la inoculación. Los sueros de los animales para las dos condiciones de ensayo se almacenaron a -20°C y se evaluaron de forma similarel estudio de reducción del número de animales con el mismo análisis estadístico.
Estudio de las diferentes zonas de animales para la realización del ensayo
Para evaluar las condiciones de mantenimiento de los animales en zonas protegidas y en zona de barreras, se ensayaron 6 muestras de vacuna Heberbiovac HB según las generalidades descritas del ensayo de potencia para la vacuna antihepatitis B. Los sueros colectados se almacenaron a -20°C y se evaluaron de forma similarel estudio de reducción del número de animales con el mismo análisis estadístico.
Ensayo de potencia para el AgsHB como componente de vacunas combinadas
Heberpenta –L
Para demostrar la aplicabilidad del ensayo para vacunas combinadas se seleccionó el parámetro de especificidad y la evaluación de lotes según se establece en el procedimiento para el ensayo de potencia de la vacuna monovalente, para lo cual se realizaron los siguientes diseños:
Especificidad
Se inocularon los animales según el procedimiento que se establece para la vacuna monovalente. Un grupo de 10 ratones hembras de la línea BALB/c de haplotipoH-2d ó H-2K de 5-6 semanas de edad con un peso mínimo de 16 g, se inmunizaron con 1 mL de diferentes dosis de la vacuna por vía intraperitonial. Posteriormente a esto los ratones permanecieron en condiciones controladas durante la duración del ensayo. Pasado 28 días se extrajo sangre por vía retro-orbital y el suero que se obtuvo al centrifugar la sangre se utilizó por un sistema ELISA para la evaluación de la respuesta anti-AgsHB.
Las muestras que se evaluaron fueron; un lote de vacuna Heberpenta-L, el material de referencia VacHB 07-0902 para la hepatitis B y una formulación de DTP-Hib con el mismo proceso de formulación de la pentavalente líquida, para la posterior evaluación de la respuesta de anticuerpos anti-AgsHB. Este estudio se realizó en dos ensayos independientes. Como criterio de aceptación de la especificidad se empleó la ausencia de señal de anticuerpos para la formulación de DTP-Hiben el sistema ELISA para la determinación de anticuerpos anti-AgsHB.
Evaluación de lotes de vacuna
Con el objetivo de determinar si el ensayo de potencia es aplicable al componente hepatitis B ante la presencia de otros antígenos se evaluaron 10 lotes de vacuna combinada Heberpenta-L. Como criterio de aplicabilidad se empleó que exista cumplimiento de los requerimientos del ensayo y el criterio de aceptación del componente individual de hepatitis. El 95% de los ensayos y de los lotes deben cumplir con la especificación (3).
RESULTADOS Y DISCUSÍON
Establecimiento del ensayo de potencia para la vacuna antihepatitis B recombinante
Estudio de reducción del número de animales
Los resultados demostraron que no existen diferencias significativas en la respuesta de anticuerpos con la disminución del número de animales (p=0,53), debido a que existe un solapamiento de los intervalos de confianza para un 95%, donde los valores de potencia relativa para el ensayo con 10 animales, se encuentra dentro de los intervalos de confianza para un 95% de los que se obtienen para el ensayo con 20 animales (Tablas 1 y 2).
Además no existen diferencias significativas para el estadígrafo Chi cuadrado, siendo la probabilidad para cada uno de los lotes mayor de 0,05. Con este resultado se comprobó que las condiciones controladas de realización del ensayo y la aplicación de la aleatorización de los animales (5) evita el sesgo y disminuye el error experimental.
Los intervalos de confianza de los lotes que se evaluaron con 10 animales fueron mayores que los del estudio con 20 animales;aunque se cumplió con el criterio de amplitud de los intervalos de confianza y en todos los casos con los criterios de validez del ensayo y de la muestra, aspecto el cual es de esperar ya que al disminuir la n experimental la variabilidad de los ensayos es mayor, pero continua siendo aceptable a los propósitos del método.Estos resultados ponen en práctica uno de los principios de las 3R (Reemplazo, Refinamiento y Reducción), la reducción del número de animales (8).
Estudio de duración del ensayo en animales para 28 y 42 días
El comportamiento del ensayo corrobora el alto poder inmunogénico de la vacuna, el cual se demostró en el estudio de la respuesta de anticuerpos en diferentes especies animales (9), donde se evidenció que pasado 11 días después del estímulo inmunogénico se comenzó a observar una fuerte respuesta de anticuerpos anti-AgsHB.
Los resultados de reducción del tiempo del ensayo no difirieron significativamente en valores de potencia relativa, aspecto que permite disminuir el tiempo de la prueba a 28 días. En la prueba de Chi cuadrado no se observó diferencias significativas (p=0,94). En todos los casos se cumplió con la amplitud de los intervalos de confianza, linealidad y paralelismo, lo que evidencia que no se afectó la respuesta de anticuerpos en ratones por reducción del tiempo de ensayo (Tablas 3 y 4).
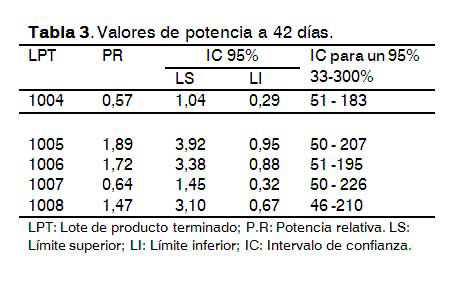
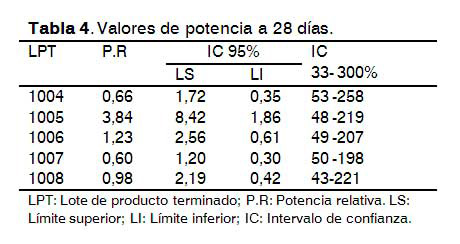
Este resultado coincide con el tiempo que emplean otros productores de vacuna, los cuales establecieron 28 días de duración, para inducir una adecuada respuesta de anticuerpos (10), lo que tiene gran importancia desde el punto de vista comercial pues se disminuyen los tiempos de liberación de analítica, ya que el ensayo de potencia es la técnica de mayor duración en el control de calidad de la vacuna antihepatitis B recombinante
Estudio de las diferentes zonas para la realización del ensayo
Los resultados demuestran que no existen diferencias significativas (p=0,56) en los valores de potencia relativa para los lotes de vacuna que se evaluaron en las dos zonas (Tablas 5 y 6), por lo que las diferencias entre los parámetros ambientales que puedan existir en las salas de estudio, no afectan la respuesta de anticuerpos contra el AgsHBrec. En todos los casos se cumplieron los criterios de validez del ensayo, así como la especificación para potencia relativa. En las dos salas la amplitud de los intervalos de confianza tuvo similar comportamiento.
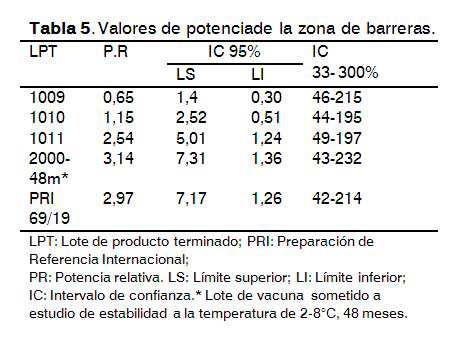
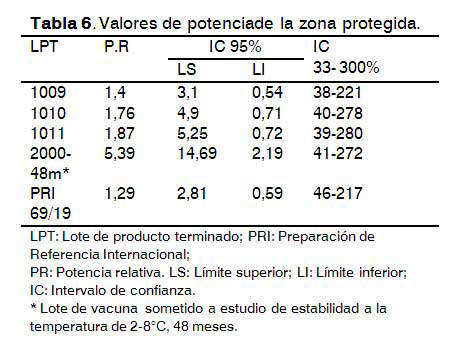
Está demostrado que para inducir una respuesta de anticuerpos en animales se necesitan adecuadas condiciones de iluminación, humedad, carga de animales en el área y niveles de amoniaco aceptables, producto a que puede existir una afectación de la respuesta de anticuerpos de manera general (11).
El control de estos parámetros permite que no exista supresión de la respuesta de anticuerpos y que no aumente la variabilidad de la misma dentro de un mismo lote de vacuna o en diferentes lotes.
El comportamiento similar de las zonas de barreras y zonas protegidas del CIGB permite utilizarlas indistintamente para dar respuestas a las demandas productivas y estudios de estabilidad como parte del control de la calidad de las vacunas.
Con los resultados obtenidos de los tres diseños experimentales, quedo establecido el ensayo de la siguiente forma:
Evaluación de la potencia de la vacuna antihepatitis B recombinante
El ensayo quedo establecido según la siguiente metodología: el uso de un grupo de 10 ratones hembras de la línea BALB/c de haplotipo H-2d, H-2K de 5-6 semanas de edad con un peso mínimo de 16 g, con un volumen a inmunizar de 1 mL de diferentes dosis de la vacuna por vía intraperitonial. Posteriormente los ratones deben permanecer en condiciones controladas durante la duración del ensayo. Pasado 28 días se deben desangrar los animales por vía retro-orbital y el suero obtenido debe evaluarse por un sistema ELISA para la determinación de la respuesta anti-AgsHB.
Para el cálculo de la DE50 se debe emplear el método Probitt y para el cálculo de la potencia se emplea un programa de líneas paralelas con pendiente común (7).Este procedimiento debe realizarse en paralelo con un material de referencia calibrado previamente con la preparación de referencia internacional.
Aplicabilidad del ensayo de potencia para lotes de vacunas combinadas DTP-HB-Hib (Heberpenta-L)
El estudio de especificidad para la vacuna pentavalente líquida, tiene como objetivo reevaluar el ensayo de potencia de la hepatitis B en el contexto de las vacunas combinadas, para asegurar que los otros componentes de la vacuna, excipientes y el adyuvante no afectan al ensayo en cuestión (12). Los resultados obtenidos son los siguientes:
Especificidad
Para la muestra experimental DTP-Hib, la potencia relativa no se pudo calcular en los dos ensayos que se realizaron al no haber seroconversión en los animales inoculados con este producto, la señal de los sueros ensayados en el sistema ELISA para la determinación de anticuerpos anti-AgsHB estuvo por debajo del valor de corte de la placa y de los placebos (Tabla7).
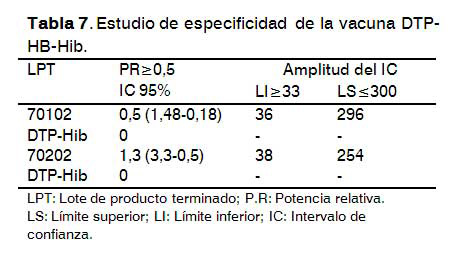
Para la vacuna pentavalente EPL70102 y EPL70202 la potencia relativa fue posible calcularla, con valores entre 0,5 y 1,3 respectivamente, lo que demuestra la especificidad de la prueba de potencia in vivo para la vacuna DTP-HB-Hib.
Con estos resultados se cumple lo establecido en regulaciones dela ICH (13) y la guía de validación del CECMED (5), donde establecen que el sistema debe detectar de forma inequívoca el antígeno de interés, en este caso el AgsHBrec, combinado con los antígenos de difteria, tétanos, pertussis y Haemophilus influenzae tipo b.
Evaluación de lotes de vacunas
En los cuatro ensayos realizados a 10 lotes de producción a escala industrial se cumple con los criterios de aceptación del ensayo y de la muestra, al obtenerse valores de potencia relativa >0,5 y el límite superior del intervalo de confianza es mayor o igual a 1 (Tabla 8).
El cumplimiento de la linealidad y el paralelismo en todos los lotes, evidencia que la presencia de los antígenos de difteria, tétanos, pertussis y Haemophilus presentes en la vacuna pentavalente no afecta el comportamiento del componente hepatitis B, al tener este ultimo similar comportamiento que el material de referencia (vacuna monovalente) y describirse una adecuada curva dosis-respuesta).
Para la vacuna combinada la Farmacopea Europea (12) refleja que cada componente de la vacuna debe evaluarse con los ensayos descritos para el componente individual y deben ser aplicables las mismas especificaciones de calidad. Estos resultados reflejan que el producto cumple con las exigencias de esta farmacopea.Para las vacunas combinadas es muy importante demostrar que cumplen con los requisitos del componente individual (vacuna antihepatitis B) para el ensayo de potencia, lo que evidencia que la potencia inmunológica en animales no se afecta por la presencia de otros antígenos. Para este tipo de vacunas no es aceptado el uso de materiales de referencia de vacunas combinadas, debido a que estas son poco estables en el tiempo y uno de los requisitos que deben cumplir estos materiales para su uso es que sean de larga duración (14).
CONCLUSIONES
Se estableció un ensayo de potencia en ratones para la vacuna anti hepatitis B recombinante que cumple con las exigencias internacionales declaradas por la OMS y la Farmacopea Europea.
Para la vacuna combinada se demostró la aplicabilidad del ensayo y la no interferencia de los antígenos de difteria, tétanos, pertussis y Haemophilus influenzae tipo b.
El ensayo de potencia para la vacuna recombinante contra la hepatitis B es una herramienta muy útil para el control de calidad y los productores de vacunas monovalentes y combinadas, además en la selección de diferentes formulaciones.
El establecimiento de este ensayo forma parte de la mejora continua del proceso de producción.
REFERENCIAS
1. World Health Organization. Requirements for Hepatitis B vaccines made by recombinant ADN techniques. Technical Report Series No786. Geneva: WHO; 1989.
2. World Health Organization. Requirements for Hepatitis B vaccines made by recombinant ADN techniques. Technical Report Series No 889. Geneva: WHO; 1999.
3. European Pharmacopoeia. Assay of Hepatitis B Vaccine (rADN); General Chapter (2.7.15). In: EuropeanPharmacopoeiaSupplement7.3 Edition. Strasbourg: European Pharmacopoeia; 2012.p.670-1.
4. World Health Organization. Guidelines non clinical evaluation of vaccines (Annex 1). Technical Report Series No. 927. Geneva: WHO;2005.
5. Festing MFW. Guidelines for the Design and Statistical Analysis of Experiments to Papers Submitted to ATLA. ATLA 2001;29(4):427-46.
6. Ramírez V, González-Griego A, Alerm A, Izquierdo M, Peña M, Vega I, et al. Método inmunoenzimático para la cuantificación de anticuerpos anti-HBs. Biotecnología Aplicada 1993;10(2):102.
7. Finney DJ. Statistical Methods in Biological Assays. 2nd Ed. London: Charles Griffin & Company Lmtd; 1964.
8. Russell WMS, Burch RL. The principles of humane experimental technique. London: Methuen& Co. Ltd; 1959.
9. Izquierdo M, Ramírez V, Peña M, González-Griego A, Muzio V, Pentón E, et al. Inmunorespuesta para la vacuna recombinante contra la hepatitis B derivada de levadura. Biotecnología Aplicada 1993;10(2):103.
10. Ferguson M1, Heath A, Minor PD. Report of collaborative study for assessing the potency of hepatitis B vaccine. Biologicals1990;18(4):345-50.
11. World Health Organization. Global Programmer for Vaccines and Immunization Vaccine Supply and quality. In: Manual of LaboratoryMethods. Geneva: WHO; 1997.p.19-23.
12. European Pharmacopoeia. Diphtheria, Tetanus, Pertussis (acellular component), Hepatitis B (rADN) and Haemophylus type b conjugated vaccine (adsorbed), Poliomyelitiesinactived. In: EuropeanPharmacopoeia 7.0. Edition 6th. Strasbourg: EuropeanPharmacopoeia; 2008.p.758-67.
13. Expert Working Group ICH. Validation on Analytical Procedures: Text and Methodology Q2 (R1). In: HarmonisedTripartiteGuideline. Geneva: ICH; 2005.p.1-13.
14. World Health Organization. Informal Consultation on Potency Testing of Hepatitis B Vaccines (Draft). Geneva: WHO August; 2008.
Recibido: Marzo de 2014 Aceptado: Mayo de 2014













