Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Vaccimonitor
versão impressa ISSN 1025-028X
Vaccimonitor vol.23 no.3 Ciudad de la Habana set.-dez. 2014
ARTÍCULO ORIGINAL
Estudio de protección de la vacuna Labio-Marek frente al desafío con la cepa JM en pollos SPF
Protection study of the Labio-Marek vaccine against the JM strain challenge in SPF chickens
MayelinPaneque-Sayas,1 Digna Contreras-González,1 Anniet Fresneda,1 Gladys Proenza,1 Tania Irene Tabares-Beltrán,2 Eloy Diaz-Fernández3
1Unidad de Producciones de Vacunas Virales y Bacterianas. Grupo Empresarial de Producciones Biofarmacéuticas y Químicas. LABIOFAM. Ave Independencia, km 16 ½ .Santiago de las Vegas. Municipio Boyeros. La Habana. Cuba, CP 10800.
2Laboratorio de Control Estatal, Instituto de Medicina Veterinaria. Avenida Independencia Km 16 ½, Boyeros, La Habana, Cuba. CP 10800.
3Laboratorios Chemical Ibérica Veterinaria S.L. Carretera Burgos-Portugal Km 256 37448 Calzada de D. Diego Salamanca, España.
email: mpaneque@ipk.sld.cu
* Licenciada en Bioquímica. Jefa del Departamento de Virología de la Subdirección Investigación-Desarrollo de la Empresa Productora de Vacunas Virales y Bacterianas de LABIOFAM.
RESUMEN
Marek es una enfermedad linfomatosa y neuropática de las aves domésticas causada por herpesvirus. La forma aguda de la enfermedad, con linfomas viscerales extendidos, es la más común en la actualidad con una incidencia del 10-30%. El objetivo del presente estudio fue evaluar la eficacia de la vacuna Labio-Marek producida por el grupo empresarial LABIOFAM contra la cepa virulenta JM en pollitos libres de patógenos específicos. Se utilizó una dosis por vía subcutánea de la vacuna conteniendo 1000 unidades formadoras de placas en 0,2 mL en pollos al día de nacidos. Los pollos seconfrontaron con 103 dosis infectiva media en cultivo de tejidos (DICT50)de la cepa JM y se observaron durante 7 semanas para detectar signos neurológicos como parálisis y otros asociados con la enfermedad. Se mantuvo un grupo de pollos no vacunados, los cuales se confrontaron y un grupo de pollos que no se vacunaron ni se confrontaron. A los pollos que sobrevivieron al desafío se les realizó la necropsia al día 54 después de la vacunación, así como evaluación histológica de los órganos. Los pollos vacunados no presentaron síntomas clínicos de la enfermedad ni lesiones microscópicas relacionadas al virus de Marek. Sin embargo el 71% de los pollos controles confrontados murieron y el 83,87% presentaron lesiones de Marek. Se pudo concluir que la vacuna evaluada puede utilizarsepara la prevención de la enfermedad de Marek en pollos.
Palabras clave:vacuna Labio-Marek, enfermedad de Marek, vacunación.
ABSTRACT
Marek's disease is a lymphomatous and neuropathic disease of the domestic chickens caused by herpesvirus. Currently the acute form of the disease, with extended visceral lymphomas, is the most common with an incidence of 10-30%. The objective of the present study was to evaluate the effectiveness of the vaccine Labio-Marek prepared by LABIOFAM against the challenge of the virulent JM strain in specific pathogen free chickens. A dose of the vaccine containing 1000 plate-forming units in 0.2 mL was inoculated in one-day old chickens by subcutaneous route. The chickens were challenged with 103 TCID50 of the JM strain and observed during 7 weeks to detect neurological signs such as paralysis and others associated with the disease. One group of chickens remained as a control of non-vaccinated chickens, which were challenged, and another group of chickens that was not vaccinated nor challenged. Autopsy was carried out at day 54 after vaccination on chickens that survived the challenge and histological evaluation of the organs was performed. The vaccinated chickens showed no clinical symptoms of the disease and had no microscopic lesions related to Marek's disease virus. However, 71% of non-vaccinated challenged chickens died and 83.87% showed lesions of Marek's disease. It is concluded that the evaluated vaccine can be used for the prevention of Marek's disease in chickens.
Key words: Labio-Marek vaccine, Marek's disease, vaccination.
INTRODUCCIÓN
Marek (EM) es una enfermedad linfomatosa y neuropática de las aves domésticas y comerciales causadas por herpesvirus. El primer caso de esta enfermedad se observó en Hungría en 1907 (1) y fue descrito como una polineuritis. El virus de la enfermedad de Marek (VEM) pertenece a la familia Herpesviridae y dentro de esta a la subfamilia Alphaherpes virinae. Dentro del género Mardivirusse dividen en tres especies Gallid herpesvirus 2, que agrupa las cepas del VEM tipo 1, Gallidherpesvirus3, agrupa las cepas cepas del VEM tipo 2 y Meleagrid herpesvirus 1 a los herpesvirus de pavo (2).
La forma clásica de la enfermedad se caracteriza por complicaciones nerviosas y la mortalidad no suele superar el 10-15%.En la forma aguda, en la que normalmente hay formación de linfomas en las vísceras, la incidencia es del 10-30% en las aves y puede alcanzar hasta un 80% (3). En su forma clásica, el síntoma clínico más corriente de la EM es la parálisis parcial o completa de las patas y las alas. En la forma aguda, las aves muestran a menudo una grave depresión y algunas pueden morir sin mostrar signos previos (4).
El control de la EM es a través de la vacunación por lo que contar con vacunas eficaces y seguras es de vital importancia. Las vacunas comerciales contra el virus de la EM incluyen la vacuna del serotipo 3, la cual se conoce también como herpesvirus de pavo (HVT), combinación del serotipo 2 y 3 y vacunas atenuadas del serotipo 1 (5). A partir de 1978 se introduce la vacunación en Cuba y se logra controlar la EM con el uso de la vacuna liofilizada que emplea la cepa HVT.
El objetivo del presente estudio fue evaluar la protección conferida por la vacuna Labio-Marek producida por LABIOFAM contra el virus de la enfermedad de Marek (cepa JM) en pollitos libres de patógenos específicos, por sus siglas en inglés conocidos como SPF.
MATERIALES Y MÉTODOS
Cultivos celulares
Se utilizaron cultivos primarios de fibroblastos de embrión de pollo (FEP), SPF de 9-11 días de incubación, provenientes de los laboratorios Valo, España evaluados para virus de la anemia del pollo, bronquitis infecciosa aviar, laringotraqueitis infecciosa, influenza tipo A, leucosis linfoide aviar, Newcastle, bursitis infecciosa, Marek, reovirus aviar, Mycoplasma gallisepticum y synoviae, Salmonella thiphimurium, Salmonella pullorum, Salmonella enteritidis, nefritis aviar, adenovirus aviar (Serotipo 1 - 12, EDS), adenovirus aviar (Serotipo II y III), neumovirus aviar, encefalomielitis aviar, viruela aviar, reticuloendoteliosis viral y rinotraqueítis del pavo.
Para el crecimiento de las células se empleó el medio de crecimiento 199 con 10% suero fetal bovino (SFB) de la firma comercial Sigma. Los huevos SPF fueron incubados a 37 ˚C y 60% de humedad relativa.
Virus
En el ensayo se empleó la cepa de confrontación JM de la colección de la American Type Culture Collection de sus siglas en inglés (ATCC) con el número VR-585, lote 2416101. El virus se tituló y su concentración se ajustó a 103 dosis infectiva media en cultivo de tejidos (DICT50) en 0,2 mL, la cual fue la dosis que se empleó para la confrontación.
Vacuna
Se empleó la vacuna viva liofilizada con el nombre comercial Labio-Marek, elaborada con cepa herpesvirus de pavo (HVT), producida por la Empresa Productora de Vacunas Virales y Bacterianas del Grupo Empresarial LABIOFAM. El lote que se utilizó en este estudio fue el 13002 con fecha de fabricación del 12/02/2013. Los frascos de vacunas presentaban un contenido de 1000 dosis y cada dosis de 0,2 mL contenía 1000 unidades formadoras de placas (UFP). La vacuna se conservó a temperatura de 2-8 ºC hasta el momento de la vacunación donde se reconstituyó cada frasco en 200 mL del diluente y posteriormente se administró a los pollos antes de las 4 h de su reconstitución.
Animales
Se emplearon pollos de un día de nacidos de ambos sexos con buen estado de salud de raza Leghornblanca, tipoSPF para virus de la anemia del pollo, bronquitis infecciosa aviar, laringotraqueitis infecciosa, influenza tipo A, leucosis linfoide aviar, Newcastle, bursitis infecciosa, Marek, reovirus aviar, Mycoplasma gallisepticum y synoviae, Salmonella thiphimurium, Salmonella pullorum, Salmonella enteritidis, nefritis aviar, adenovirus aviar (Serotipo 1-12, EDS), adenovirus aviar (serotipo II y III), neumovirus aviar, encefalomielitis aviar, viruela aviar, reticuloendoteliosis viral y rinotraqueítis del pavo. Los pollos provenían de huevos SPF de la firma comercial Valo de España.
Condiciones de tenencia, manejo y alimentación
Los pollos seubicaron en naves de experimentación separadas en jaulas JUP 113, con alimentación ad libitum durante todo el experimento y catorce horas de luz. Permanecieron a una temperatura de 29 ºC durante la primera semana y posteriormente a temperatura ambiente. La humedad relativa se mantuvo entre un 60-68%.
Titulación de la vacuna y del virus de confrontación
La titulación del contenido viral se realizó en placas de cultivo de 60 mm de diámetro. Se realizó un cultivo secundario de FEP a partir de huevos embrionarios de 9-11 días de incubación. Se realizaron diluciones seriadas de la suspensión viral y se inocularon 0,1 mL de las mismas en el cultivo. Luego se procedió a la adsorción del virus durante 30 min y posteriormente las placas fueron colocadas a 38 ºC en presencia de CO2 durante 6 días en medio de mantenimiento que contenía un medio de cultivo 199 y 2% de SFB. La lectura del título viral se realizó por conteo del número de placas producidaspor el virus en el cultivo, expresadas en UFP.
Inmunización y confrontación
Se emplearon 95 pollitos,se dividieron en tres grupos y se mantuvieron en locales separados tal como se describe en la Tabla 1.

La vacuna se reconstituyó con 200 mL del diluente consistente en sacarosa, fosfato de potasio monobásico y dibásico y cloruro de sodio. Se inyectaron los pollos con 0,2 mL en la parte posterior del cuello, consistente en una dosis, la cual contenía 1000 UFP del virus de Marek cepa herpesvirus de pavo (HVT).
Confrontación
Las aves pertenecientes a los grupos 1 y 2 se confrontaron con 103 DICT50 de la cepa JM de la enfermedad de Marek 5 días posteriores a la inmunización por la vía intramuscular, según lo descrito en el ensayo de inmunogenicidadque se estableció en el capítulo 113.330 del código de regulaciones federales de los Estados Unidos (CFR, 2014) para el control y liberación de las vacunas vivas virales (6).
Los grupos se mantuvieron en locales separados y el grupo 3 se utilizó como control negativo para validar y comparar las lesiones con los otros grupos.
Observaciones clínicas
Las aves se observaron diariamente dos veces al día por un período de tiempo de 7 semanas después de la confrontación y se registraron los signos neurológicos, parálisis y otros signos asociados con síndromes neurológicos.
Determinación del peso corporal
Al finalizar el período de observación las aves sobrevivientes de los tres grupos se pesaron.Se calcularon las medias de los pesos corporales y la desviación estándar de cada grupo.
Necropsia
A las aves que sobrevivieron y los controles que no se confrontaron se les realizó la eutanasia al transcurrir 7 semanas posteriores a la confrontación. La eutanasia se realizó por inhalación de CO2 (7).
Los cadáveres se inspeccionaron en busca de lesiones nodulares en la piel o en la musculatura esquelética.
Se evaluaron las lesiones macroscópicas compatibles con la enfermedad de Marek como: linfomas en órganos (infiltrados difusos que determinan una hipertrofia en los órganos), hiperplasia de los nervios periféricos, especialmente concentrados en los plexos nerviosos y vagos, branquiales y ciáticos.
Además se evaluaron las lesiones en el bulbo del ojo que incluyó opacidad de la córnea, pigmentación del iris e irregularidad de la pupila y por último se evaluaron lesiones en la piel (lesiones cutáneas en los folículos de las plumas y crestas).
En la evaluación histopatológica se analizaron los nervios periféricos: vago, branquial y ciático, encéfalo, bolsa de Fabricio, timo, bazo, corazón, hígado y proventrículo.
Las muestras antes mencionadas se fijaron mediante inmersión en formol tamponado al 10% durante 2 días. Posteriormente, se incluyeron en parafina para su posterior estudio histológico mediante la tinción de hematoxilina-eosina (H.E).
Análisis estadístico
Para la evaluación de los resultados se empleó el paquete estadístico GraphpadPrism versión 5.01.
Las diferencias de las medias de los pesos corporales entre los grupos estudiados se realizaron por el análisis de varianzas (ANOVA), seguido de un análisis posterior con Tukeypara la comparación entre los grupos. En todos los casos se consideró comodiferencia significativa una p<0,05.
RESULTADOS
Síntomas clínicos y lesiones macroscópicas
Dos pollos del grupo 1, cuatro del grupo 2 y uno del grupo 3 murieron antes del desafío. Estos pollos no presentaron lesiones macroscópicas al ser examinados. En la Tabla 2 se muestra el comportamiento clínico de los pollos en el transcurso del experimento.
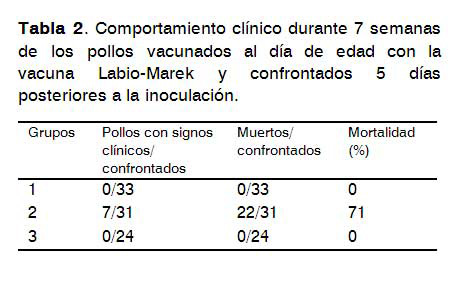
Se observó que todos los pollos vacunados correspondientes al grupo 1 fueron protegidos frente al reto con un virus virulento de Marek, ningún pollo enfermó, ni presentaron síntomas clínicos de la enfermedad. Sin embargo, en el grupo 2 se observó que el 71% de los pollos murieron y 7 presentaron síntomas clínicos de la EM al concluir el experimento, mientras que en el grupo 3 ninguno de los pollos enfermó.
En la Tabla 3 se presentan los resultados que se obtienen a partir de la observación macroscópica de los pollos afectados como consecuencia de la confrontación viral. Las mayores lesiones en este grupo ocurrieron en la bolsa de Fabricio (grupo 2) y tres de ellos presentaron hemorragias petequiales en el hígado. Ninguno de los pollos del grupo 1 y 3 mostraron lesiones macroscópicas.
Los pollos que murieron a los 40 días post infección mostraron en sentido general no solo un menor tamaño con respecto a los restantes grupos experimentales, sino además una disminución de la bolsa de Fabricio, con respecto a los grupos 1 y 3.
Determinación del peso corporal
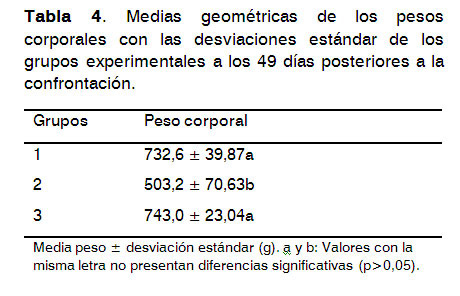
Los animales que sobrevivieron al finalizar el experimento en el grupo no vacunado/confrontado en este caso n=9 fueron pesados. Del resto de los grupos se seleccionaron y pesaron 9 pollos.
En la Tabla 4 se presentan las medias geométricas de los pesos corporales con las desviaciones estándar de cada grupo experimental. La media del peso corporal del grupo no vacunado/confrontado fue significativamente menor (p<0,05) que el resto de los grupos. No existieron diferencias significativas entre las medias de los pesos corporales de los animales vacunados/confrontados y el grupo control no vacunado/no confrontado(p>0,05).
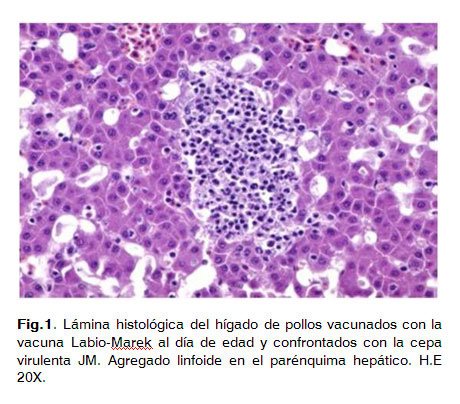
Ninguno de los pollos vacunados mostró lesiones macroscópicas o histológicas compatibles con la enfermedad de Marek.
En estos animales se observó la presencia de agregados linfoides en diversos órganos (hígado, pulmón y proventrículo) formados por linfocitos bien diferenciados y de morfología homogénea (Fig. 1).
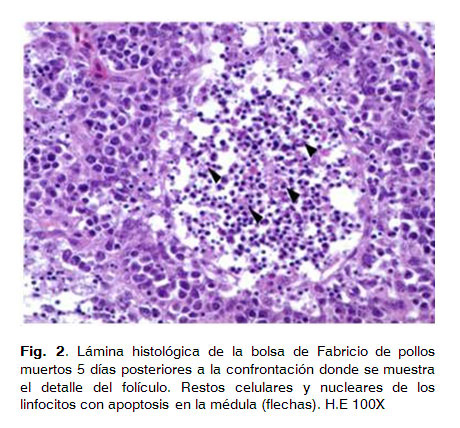
La aparición de estos agregados linfoides en aves se asocia a una proliferación fisiológica de células linfoides (linfopoyesis) como consecuencia de una exposición a antígenos en este caso a la vacuna que se administró.Los animales estudiados del grupo que no fueron vacunados y que fueron confrontados con el virus de la enfermedad de Marek JM (grupo 2) y que murieron el día 5 (n=18), 19(n=1) y 40 (n=3) post infección (PI) no presentaron lesiones nodulares en la inspección macroscópica de los órganos evaluados. Durante la realización de la necropsia, tres animales de los que murieron el día 5 PI mostraron hemorragias petequiales en el hígado. No se observaron tumoraciones en los órganos viscerales ni de engrosamiento de los nervios periféricos en ninguno de los pollos estudiados.
Histológicamente, 9 de los 18 animales que murieron el día 5 PI mostraron lesiones graves en la bolsa de Fabricio, donde se apreció necrosis linfocitaria en la médula de la mayoría de los folículos linfoides estudiados (Fig. 2). En estos, la médula folicular se encontraba infiltrada por un gran número de macrófagos, delimitando el área de necrosis linfocitaria. Estas lesiones eran de carácter agudo, yaque en las áreas de necrosis, la gran mayoría de los linfocitos mostraron picnosis y cariorrexis.Cinco pollos pertenecientes a este grupo (muertos el día 5 PI) mostraron lesiones leves en la bolsa de Fabricio. Estas lesiones se caracterizaban por una ligera hipocelularidad y edema intercelular de la región medular en los folículos linfoides.
A mayores aumentos se observó infiltración de esta región por un escaso número de macrófagos y la aparición ocasional de restos celulares asociados afenómenos de necrosis linfocitaria (Fig. 3).
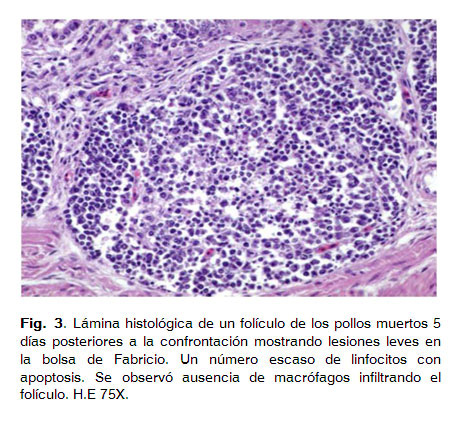
Los cuatro pollos restantes muertos a los 5 días PI no presentaron lesiones histológicas. Un animal muerto el día 19 posterior a la confrontación mostró una proliferación neoplásica de linfocitos en el proventrículo. Esta se caracterizó por un infiltrado difuso y pleomórfico de linfocitos en la lámina propia de la mucosa superficial, llegando a invadir los pliegues epiteliales (Fig. 4).
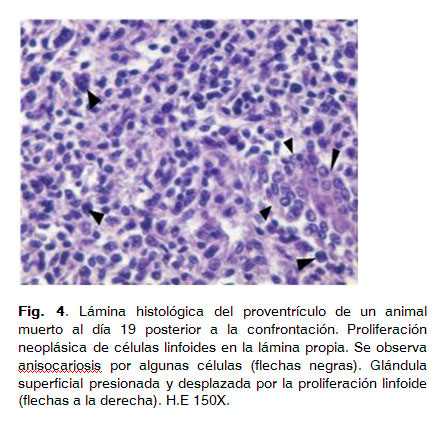
Ocasionalmente, también se apreciaron agregados de células neoplásicas en la zona basal entre los túbulos secretores de las glándulas mucosas.En el tejido de las muestras de nervios ciáticos no se apreciaron lesiones, sin embargo, en el tejido conjuntivo del perineuro se observaron dos agregados perivasculares de células neoplásicas de naturaleza linfoide, estas características fueron similares a las observadas en el proventrículo (Fig. 5).
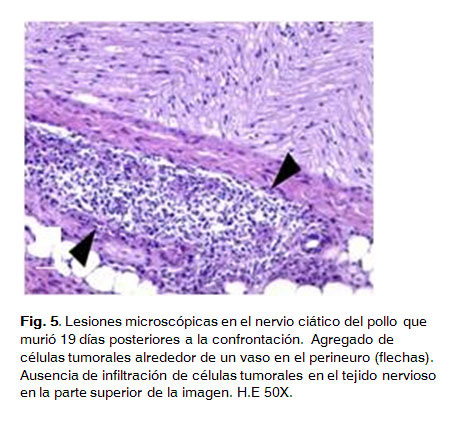
Los pollos que murieron el día 40 PI presentaron proliferación neoplásica linfoide en el nervio ciático, encefalitis e infiltración de células linfoides neoplásicas en el corazón. Los pollos que se evaluaron al final del experimento y que no murieron del grupo 2 mostraron lesiones muy similares a los que murieron el día 40 PI. Once de los doce pollos estudiados presentaron infiltración de células linfoides neoplásicas en algunos órganos, principalmente en el nervio ciático y en corazón (Fig. 6).

Al igual que lo descrito anteriormente en el animal estudiado en el día 19 posterior a la confrontación, el componente celular de este infiltrado se caracterizó por ser difuso y pleomórfico. Los tres animales que murieron el día 40 mostraron además un número escaso de focos de hipercelularidad en el neuropilo.
DISCUSIÓN
La prevención y el control de la EM se basa en tres aspectos fundamentales: vacunación, una buena bioseguridad y resistencia genética. Estos dos últimos criterios tienen mayor utilidad como herramientas complementarias a la vacunación. Existen varios tipos de vacunas para proteger a los pollos contra la EM. En el caso de las vacunas vivas al inocular aves de un día de edad, el virus se reproduce activamente y produce una viremia que persiste de por vida (8). El virus vacunal impide que el virus de campo infecte a la célula huésped por un mecanismo de interferencia por bloqueo de receptores. La inmunidad contra los herpesvirus se asocia frecuentemente con la inmunidad mediada por células, donde una activación temprana de las células T y el incremento de la expresión del complejo mayor de histocompatibilidad clase II en estas células activadas producto de la vacunación, se relaciona con una elevada protección (9). Sin embargo los anticuerpos también protegen contra el virus, al neutralizarlo, prepararlo para la fagocitosis y activar el sistema del complemento para lisar células infectadas (10).
En el caso de las vacunas elaboradas con cepas HVT se demostró un incremento en la carga viral del genoma luego de una infección con el virus virulento en los pulmones y folículos de las plumas al sugerir que la infección con el virus virulento estimula la replicación del virus vacunal (11). Las cepas del serotipo 3 o herpesvirus del pavo (HVT) son capaces de proteger frente a virus virulentos, aunque cuando se combinan con cepas del serotipo 2 confieren una protección adecuada frente a cepas muy virulentas (vv o veryvirulent).
Otros estudios se deben realizar con la vacuna Labio-Marek combinada con cepas del serotipo 2 para demostrar la eficacia frente a cepas muy virulentas aunque hasta el momento la vacunación con cepas HVT logra controlar la enfermedad en el país, esto podría explicarse por una baja circulación o la no existencia de cepas muy virulentas. Antigénicamente el HVT tiene una alta relación con los VEM del serotipo 1 (12) y se considera que la protección conferida por el HVT frente a los virus virulentos del serotipo 1 es de base inmunológica. Es importante resaltar la similitud antigénica de la glicoproteína B (gB) en estos dos serotipos, ya que se considera a esta proteína como uno de los antígenos más relevantes en la inmunidad conferida por las vacunas.
En el presente estudio se evaluó la protección conferida por una vacuna elaborada con la cepa HVT en la forma libre de células, aplicada a pollitos de un día de edad frente a la cepa JM. Aunque son varios los países que utilizan las vacunas bivalentes y trivalentes para el control de la EM, las vacunas que emplean la cepa HVT se utilizan ampliamente con buenos resultados en protección e inmunogenicidad, sobre todo en aquellos países que no disponen de los medios para la transportación en nitrógeno líquido de las vacunas asociadas a células (13,14). Además las vacunas a partir de la cepa HVT pueden ser liofilizadas y por lo tanto es más barata, fácil de manipular y almacenar que las vacunas asociadas a células donde se requiere de conservación en nitrógeno líquido.
Los resultados de esta investigación mostraron que los pollos vacunados con la vacuna Labio-Marek fueron protegidos al 100%, ningún pollo presentó lesiones macroscópicas ni microscópicas compatibles con la EM. Del grupo no vacunado/confrontado, un 83,87% de los animales mostraron lesiones compatibles con la enfermedad de Marek en las diferentes fases que se asocian a este proceso infeccioso. En los pollos que murieron a los 5 días PI se observó afectación grave en la bolsa de Fabricio y en otros una afectación ligera.
En pollos infectados con el virus de EM se ha observado una marcada atrofia del timo y la bolsa de Fabricio con necrosis de células linfoides, resultados similaresse obtuvieron en el presente estudio en el grupo de pollos no vacunados y confrontados, este hallazgo se nombra síndrome de mortalidad temprana donde la mortalidad ocurre de 5-10 días después de la infección con el virus y se asocian además los síntomas clínicos y la mortalidad a la fase citolítica del virus la cual se presenta durante la replicación viral productiva de 3-6 días PI (4). La atrofia de la bolsa de Fabricio está descrita que ocurre en la presentación de la EM en su forma aguda. Estudios anteriores demuestran que la cepa JM que se utilizó en la confrontación causa las afectaciones observadas en esta forma de presentación de la enfermedad (15,16).
En el pollo que murió el día 19 post infección se apreció una proliferación neoplásica de células linfoides en el proventrículo y nervios ciáticos. Se plantea que estas lesiones son compatibles con la forma aguda de la EM, lesiones tipo A o TII (17). Los pollos que murieron el día 40 PI mostraron, además de las lesiones clásicas linfoproliferativas en el nervio ciático, lesiones inflamatorias en el encéfalo compatibles con un síndrome neurológico que se asocia a la enfermedad de Marek (18). En la observación macroscópica la bolsa de Fabricio presentó un menor tamaño en los pollos que murieron el día 40 PIy en los pollos que sobrevivieron del grupo no vacunado/confrontado con respecto al grupo control y al grupo vacunado/confrontado, esto ocurrió como consecuencia de la atrofia de la bolsa la cual está determinada por la depleción de la población linfoide de la bolsa de Fabricio y su posterior reemplazo por tejido conectivo y sucede en una etapa temprana cuando no se ha producido ninguna lesión tumoral (19). Estos pollos tenían además una disminución significativa (p<0,05) del peso corporal con respecto al resto de los grupos del experimento que pudiera atribuirse a la inmunodepresión que causa el virus de la EM.
Los pollos que no murieron del grupo no vacunado/confrontado padecían lesiones clásicas linfoproliferativas compatibles con la enfermedad. En el caso del grupo control donde los pollos no se vacunaron ni tampoco se confrontaron no ocurrió mortalidad y no se presentaron signos clínicos asociados a la EM. Los resultados obtenidos en el presente estudio solo fueron frente a la confrontación con la cepa JM siendo necesario realizar en futuras investigaciones ensayos de eficacia frente a aislados del virus de Marek que estén circulando en el país, para demostrar la protección conferida con la vacuna Labio-Marek en las condiciones de campo.
Sobre la base de los resultados discutidos con anterioridad se concluye que la vacuna Labio-Marek, producida por LABIOFAM, fue eficaz frente a la confrontación con la cepa virulenta JM del virus de Marek.
REFERENCIAS
1. Marek J. Multiple Nervenentzündung (Polyneuritis) beiHühnern. DeutTierarztlWoch 1907;15:417-21.
2. Fauquet CM, Mayo MA, Maniloff J, Desselberger U, Ball LA. Virus taxonomy;Eighth Report of the International Committee on the Taxonomy of Viruses. San Diego: Elsevier Academic Press;2005.
3. Biggs PM, Nair V.The long view: 40 years of Marek's disease research and Avian Pathology. Avian Pathol 2012;41(1):3-9.
4. Carvallo FR, French RA, Gilbert-Marcheterre K, Risatti G, Dunn JR, Forster F, et al. Mortality of one-week-old chickens during naturally occurring Marek's disease virus infection. Vet Pathol2011;48:993-8.
5. Gimeno IM, Witter RL, Cortes AL, Reddy SM, Pandiri AR. Standardization of a model to study revaccination against Marek's disease under laboratory conditions. Avian Pathol 2012;41(1):59-68.
6. Code of Federal Regulations USDA, FDA. Immunogenicity. Title 9, vol 1 sec. 113.330. California: FDA;2014.
7. AVMA. American Veterinary Medical Association Guidelines on Euthanasia.Schaumburg: AVMA;2013.
8.Schat KA, Markowski-Grimsrud CJ. Immune responses to Mareks disease virus infection. Curr Topics in MicrobiolImmunol2001;255:91-120.
9. Gimeno IM, Cortes AL, Witter RL, Pandiri AR. Optimization of the protocols for double vaccination against Marek's disease using commercially available vaccines: evaluation of protection, vaccine replication, and activation of T cells. Avian Dis2012;56:295-305.
10. Haq K, Faizal MAC, Shanmuganthan S, Thanthrige-Don N, Read LR, Sharif S. Vaccine-induced host responses against very virulent Marek's disease virus infection in the lungs of chickens. Vaccine2010;28(34):5565-72.
11. Haq K, Fear T, Ibraheem A, Abdul-Careem MF, Sharif S. Influence of vaccination with CVI988/Rispens on load and replication of a very virulent Marek's disease virus strain in feathers of chickens. Avian Pathol 2012;41(1):69-75.
12. Kingham BF, Zelnik V, Kopacek J, Majerciak V, Ney E, Schmidt CJ. The genome of herpesvirus of turkeys: comparative analysis with Marek's disease viruses. J Gen Virol2001;82:1123-35.
13. Bublot M, Sharma J. Vaccination against Marek's disease. In: Davison TF, Nair V. Marek's Disease–An Evolving Problem. London: Academic Press; 2004.p.168-85.
14. Gimeno IM. Mareks disease vaccines: A solution for today but a worry for tomorrow? Vaccine 2008;26(Supplement 3):31-41.
15. Sevoian M, Chamberlain DM, Counter FT. Avian lymphomatosis. I. Experimental reproduction of the neural and visceral forms. Veterinary Medicine 1962;57:500-1.
16. Dunn JR, Silva RF, Lee LF, Witter RL. Competition between two virulent Marek's disease virus strains in vivo. AvianPathol 2012;41(3):267-75.
17. OIE. Marek´s disease. 2.3.13 Chapter. In: Manual of Diagnostic Tests and Vaccines for Terrestrial Animals. Paris: OIE; 2012.Disponible en: http://www.oie.int/fileadmin /Home/eng/Health_standards/tahm/2.03.13_MA-REK_DIS.pdf.
18. Gimeno IM, Witter RL, Reed WM. Four distinct neurologic syndromes in Marek's disease: effect of viral strain and pathotype. AvianDis 1999;43:721-37.
19. Morales OE. La enfermedad de Marek como factor inmunodepresor. En: AMEVEA. Memorias I seminario técnico avícola. Santa Cruz: AMEVEA–Bolivia;1993.p.1-3.
Recibido: Mayo de 2014 Aceptado: Junio de 2014













