My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Vaccimonitor
Print version ISSN 1025-028X
Vaccimonitor vol.23 no.3 Ciudad de la Habana Sept.-Dec. 2014
ARTICULO ORIGINAL
Biomodelos para la evaluación de cepas atenuadas como candidatos vacunales contra el cólera humano. Estudio de la toxigenicidad, inmunogenicidad y protección
Biomodel for evaluating attenuated Vibrio cholerae strains as human cholera vaccine candidates. Study of toxigenicity, immunogenicity and protection
Reynaldo Oliva-Hernández,* Hilda María García-Sánchez, Juan Francisco Infante-Bourzac, José Luis Pérez-Quiñoy, Bárbara Cedré-Marrero, Tania Valmaseda-Pérez, Arturo Talavera-Coronel, Gemma Año-López, Viviana Margarita Pérez-Amat, Luís García-Imía
Instituto Finlay. Centro de Investigación-Producción de Vacunas. Ave 27 No. 19805, e/ 198 y 202.La Lisa, La Habana. Cuba.
email: roh@finlay.edu.cu; reyolivacuba@gmail.com
* Doctor en Medicina Veterinaria y Zootecnia. MSc en Medicina Veterinaria Preventiva. Especialista en Tecnología de Avanzada de Nivel I y Profesor Asistente. Director de Preclínica, Vicepresidencia de Investigación-Desarrrollo, Instituto Finlay.
RESUMEN
El cólera es en muchos países un problema para la salud humana al mantenerse como una enfermedad epidémica o endémica, que afecta tanto a niños como adultos y causa la muerte en casos no tratados. Una vacuna viva oral contra esta enfermedad puede contribuir a controlar importantes epidemias, principalmente en países donde las condiciones higiénicas sanitarias no son adecuadas o hay escasez de agua potable. En el presente trabajo se seleccionaron y aplicaron biomodelos para la evaluación de cepas atenuadas genéticamente de Vibrio cholerae, como candidatas vacunales contra el cólera. Para evaluar latoxigenicidad, inmunogenicidad y protección se utilizaron los modelos: IlealLoop, inoculación intraduodenal y RITARD en conejos F1 (Nueva Zelanda x Semigigante Blanco) adultos jóvenes con un peso entre 1,8-2,3 kg. Los resultados que se obtienen con los biomodelos utilizados demuestran que las cepas atenuadas genéticamente son no toxigénicas, son inmunogénicas y protectoras. Se concluye que los biomodelos que se utilizaron en este trabajo permiten la evaluación de cepas candidatas para vacunas vivas orales contra el cólera.
Palabras clave: Vibrio cholerae, IlealLoop, inoculación intraduodenal, RITARD.
ABSTRACT
In many countries, Cholera remains being a problem for human health, since it continues being an epidemic or endemic disease, which affects either children or adults and it is a death cause when cholera cases are not treated. A live oral vaccine against this disease can contribute to control important epidemics, mainly at countries where the sanitary hygienic conditions are not good or drinking water is not available. In this work, bio models were selected and applied for the selection of genetically attenuated Vibrio cholerae strains as vaccine candidates against cholera. Their toxigenicity, immunogenicity and protection were evaluated by means of Ileal Loops, intraduodenal inoculation and RITARD models in F1 (New Zealand x White Semi giant) young adults rabbits weighing from 1.8 to2.3 kg. The results obtained with the used bio models, show that the Vibrio cholerae genetically attenuated strains are no toxigenic, but are immunogenic and protective. As conclusion, these bio models are available for the evaluation and selection of oral vaccine candidates.
Key words: Vibrio cholerae, Ileal Loop, intraduodenal inoculation, RITARD.
INTRODUCCIÓN
Los modelos animales permiten caracterizar a candidatos vacunales vivos orales contra el cólera. Existen diversos puntos de vista sobre la utilidad de los mismos para los ensayos de efectividad de los candidatos vacunales contra el cólera, debido a la inexistencia de una especie animal que reproduzca fielmente la etiopatogenia de Vibriocholerae; no obstante, animales neonatos y adultos se utilizan con estos fines (1).
Dentro de los animales adultos que más se utilizan para el estudio de V. cholerae, está el conejo, al emplear en este la vía oral o realizando modificaciones quirúrgicas de sus tractos intestinales (2-4). Mediante los procedimientos quirúrgicos se inoculan los microorganismos viables en un área específica del lumen intestinal, el cual se expone artificialmente a concentraciones deseadas de bacterias y antígenos (1, 5).
Un modelo que se utiliza con alta frecuencia para estudiar la virulencia de las cepas de V. cholerae, así como el efecto que producen las diferentes toxinas excretadas por los vibrios, es el modelo de intestino ligado de conejo adulto o IlealLoop, desarrollado en la India en 1953 (6).
En este modelo el potencial toxigénico de las cepas de V. cholerae se evalúa a través de la acumulación de fluido que se produce como consecuencia de la excreción de toxinas en los segmentos de íleon inoculados, además de permitir la evaluación simultánea de varias cepas en un mismo animal (1, 7).
El modelo de inoculación intraduodenal en conejo adulto se utiliza previo a los ensayos controlados en voluntarios humanos con el objetivo de evaluar la inmunogenicidad de cepas de V. cholerae atenuadas por ingeniería genética. Este modelo descrito por García, et al (3) logra una exitosa colonización intestinal de la cepa administrada y una correcta presentación antigénica que permite evaluar la respuesta inmune frente a estos inmunógenos (4).
Uno de los modelos animales que más ampliamente se utiliza es el de diarrea en conejo adulto con lazo intestinal removible (de las siglas en inglés RITARD) descrito por Spira y Sack (8).
En este modelo se utiliza un lazo corredizo de forma temporal en el intestino delgado que es retirado 2 h después de la inoculación de vibrios. Este modelo permite que ocurra diarrea masiva y frecuentemente fatal en las primeras 48h a 5 días posteriores a la inoculación.
El modelo RITARD se utiliza después de la inmunización oral, con el objetivo de evaluar la inmunogenicidad protectora inducida por cepas de V. cholerae, al ser desafiados los conejos con vibrios vivos (5,9).
La diarrea acuosa letal también puede inducirse en un modelo de perro adulto, pero este modelo se utiliza poco (10,11) al igual que de cerdos enanos (12).
Las ratas también se usan como modelo para estudios de cepas de V. cholerae, en orden de preferencia después de los ratones y conejos (2),pues se consideran más útiles en los estudios toxicológicos de vacunas contra el cólera humano (13). Igualmente se utilizan curieles como modelo experimental en estudios de infecciones mixtas con V.cholerae y Salmonella Typhi (14).
La importancia de la interpretación de los resultados y la apreciación de la extrapolación de estos de una especie a otra depende del modelo experimental que se utilice, ya que no existe un modelo perfecto extrapolable al hombre, pero existe una infinidad de biomodelos experimentales, cuyas respuestas fragmentarias incrementan el significado biológico del fenómeno observado (15).
El objetivo de este trabajo fue seleccionar y utilizar biomodelos para evaluar la toxigenicidad, inmunogenicidad y protección en conejos, que a su vez permitieran concluir y evaluar los primeros resultados obtenidos en el biomodelo ratón neonato (16) en la fase de investigación básica, para seleccionar candidatos vacunales contra el cólera antes de su desarrollo tecnológico y clínico.
MATERIALES Y MÉTODOS
Animales
Se emplearon conejos adultos jóvenes híbridos F1 del cruce de las líneas Nueva Zelanda Blanco x Semigigante Blanco (NZB x SGB) con un peso vivo entre 1,8 y 2,3 kg, procedentes del Centro Nacional para la Producción de Animales de Laboratorio (CENPALAB), con sus correspondientes certificados de calidad higiénica-sanitaria y genética. Los animales se mantuvieron bajo condiciones ambientales convencionales con un régimen de iluminación de 12 h luz y 12 h oscuridad. La temperatura ambiental de las habitaciones así como la humedad relativa se controlaron y registraron en la mañana y en la tarde a través de un equipo de medición habilitados en cada habitación; siendo entre 18-22oC y 45-65% respectivamente. El alimento se suministró por el CENPALAB y consistió en pienso concentrado para la especie con sus correspondientes certificados de calidad bromatológica, e higiénico-sanitaria y se suministró agua potable, ambos fueronad libitum.
Los conejos se alojaron en módulos de plásticos móviles de 6 plazas individuales de marca INPUD. A todos los animales se les aplicó un período de adaptación menor a 15 días en los locales donde posteriormente se realizaron los ensayos. Los diseños experimentales y protocolos de ensayos, incluyendo los métodos de eutanasia, se les solicitó su aprobación por la comisión ética de la institución, teniendo en cuenta lo establecido por las regulaciones de seguridad biológica. Todos los ensayos se realizaron por triplicado para cada cepa, con el objetivo de garantizar la repetibilidad y confiabilidad de los resultados.
Cepas empleadas
Las características de las cepas que se evaluaron en este trabajo así como los controles se resumen en la Tabla 1. Se utilizaron cepas de V. choleraedel serogrupo O1, serotipos Inaba y Ogawa, de los biotipos clásicos y El Tor, así como del serogrupo O139. Las cepas se conservaron a una temperatura de -70°C en caldo triptona soya (TSB) con leche descremada al 10% y glicerol al 20%.
Biomodelo en conejo (IlealLoop) para evaluar la toxigenicidad en cepas de V. cholerae
El biomodelo del intestino ligado en conejo (IlealLoop) es muy utilizado para estudiar el efecto que producen las diferentes toxinas excretadas por V. cholerae.
Este biomodelo se utilizó como prueba de caracterización para evaluar la toxigenicidad de las cepas modificadas genéticamente y comprobar su atenuación.
Los conejos se anestesiaron con pentobarbital sódico en una dosis de 25 mg/kg de peso, por vía intravenosa. Seguidamente se realizó la laparotomía de 2-3 cm en la línea media del abdomen; el intestino delgado se localizó y se dividió por ligaduras con hilo de algodón estéril en 10 segmentos de 5-6 cm. Las ligaduras se comenzaron a realizar próximas al apéndice y de su ligamento, separando cada uno de estos con segmentos de 1 cm aproximadamente(Fig.1). Posteriormente los animales se inocularon con 0,5 mL de una suspensión bacteriana de 107 unidades formadoras de colonias por mL (UFC/mL) en tampón fosfato de sodio (PBS) 1x estéril. Se utilizó como control negativo del experimento la cepa K-12. Se retornó el órgano a su cavidad y se reconstruyó la laparotomía.

La preparación de la suspensión bacteriana se realizó a partir del cultivo de las cepas en TSBdurante 6 h a 200 r.p.m. en una zaranda orbital a una temperatura de 37ºC. Seguidamente se preparó la suspensión bacteriana, de cada cepa a inocular, al ajustarse a una concentración de 107 UFC/mL.
A las 18 hse les practicó la eutanasia a los animales con una sobredosis de pentobarbital sódico de 50 mg/Kg de peso corporal, los segmentos se localizaron inmediatamente después de la eutanasia y se midió el largo en cm de los mismos, así como el volumen de fluido que se acumuló en su interior.Los resultados se expresaron como volumen de fluido acumulado (FA) en mL/cm de segmento intestinal (7).
Se utilizaron un total de 15 animales, se evaluó en cada animal dos cepas, con tres segmentos de intestino para cada una de las cepas; dos segmentos se inocularon sólo con PBS estéril y dos segmentos con la cepa K-12. En cada experimento se trabajó con tres animales y las inoculaciones en cada segmento se realizaron al azar y a doble ciegas.
El criterio de aceptación que deben cumplir las cepas modificadas genéticamente en esta prueba es que los valores de FA deben ser inferiores a 1 mL/cm de intestino (7).
Biomodelos en conejo (inoculación intraduodenal y RITARD) para evaluar la inmunogenicidad y protección
El biomodelo de inoculación intraduodenal permite evaluar la inmunogenicidad de los antígenos de V.cholerae, este proceder permite evadir la acidez del estómago, que se encuentra cuando se utiliza la vía oral y garantiza una mejor presentación de los antígenos (3).
El procedimiento quirúrgico RITARD que se utilizó, reproduce aspectos clínicos de la enfermedad colérica humana (8).
Inoculación intraduodenal
Este biomodelo se realizó según García et al(3), el cual se utilizó como prueba de potencia para evaluar la inmunogenicidad.
La preparación de la suspensión bacteriana para este estudio se ajustó a una concentración de 109 UFC/ml.En un primer paso los animales se prepararon un día antes a la intervención quirúrgica, se les depiló y rasuró la región abdominal bajo el uso de un tranquilizante para minimizar de esta forma el estrés y daños a los animales (Clorpromazina y Diazepan, en dosis de 1mg/kg en cada una), luego se anestesiaron con pentobarbital sódico (25 mg/kg de peso, por vía intravenosa). Seguidamente se les realizó una laparotomía de aproximadamente 2-3 cm de longitud en la línea media del abdomen próximo al cartílago xifoides. Se visualizó el duodeno y se inyectó en el lumen intestinal 5 mL de la suspensión bacteriana que contenía 109 UFC de cada cepa (Fig. 2). Se retornó el órgano a su cavidad y se reconstruyó la laparotomía. Una hora más tarde, se les administró atropina intramuscularmente (0,2 mg/Kg) con el objetivo de prolongar la inhibición de la motilidad intestinal luego de la administración del anestésico (3).
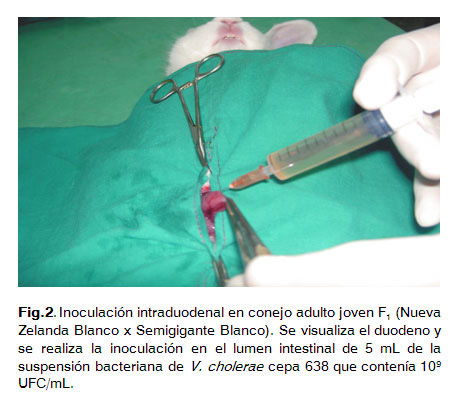
Se utilizaron un total de 33 animales; los conejos controles recibieron solo PBS estéril en lugar de la suspensión de bacterias viables.
La sangre de los animales inoculados se colectó por punción en la arteria central de la oreja. Se realizaron 5 extracciones, una antes de la administración del inóculo y las otras a los 7, 14, 21 y 28 días después de inoculados con el fin de obtener el suero.
Los sueros fueron colectados y almacenados a -20ºC hasta su análisis para la determinación de anticuerpos bactericidas mediante el ensayo vibriocida y de anticuerpos IgG anti-LPS Ogawamediante la técnica de ELISA.
Las cepas de referencia VC12, VC13 y MO45 se utilizaron como antígenos en la reacción bactericida. Se determinó el título de anticuerpos vibriocidas por el método que estableció Cedré, et al(17). Los anticuerpos IgG anti-LPS se midieron por ELISA al utilizar placas de poliestireno con fondo plano de 96 pocillos (Nunc Maxisorp) (18).
Los criterios de aceptación en ambas pruebas para evaluar la capacidad inmunogénica de cepas atenuadas en el modelo intraduodenal, fueron que los títulos de anticuerpos bactericidas deben ser ³1:160 y los títulos de IgG anti LPS entre 1,24-2,72 (3).
Para realizar el análisis estadístico de la respuesta inmunológica se calcularon los títulos medios geométricos (TMG). Se utilizó ANOVA simple para comparar la media de los logaritmos de los títulos obtenidos tanto por ELISA como por el ensayo vibriocida.
Biomodelo RITARD
Los resultados en el experimento de inmunogenicidad se utilizaron para la seleccionó de la cepa atenuada 638 de segunda generación en el estudio de protección (RITARD). Resultó ser la cepa candidata para evaluarse en los futuros ensayos clínicos, toda vez que pertenece al biotipo Ogawa, el cual es el de mayor circulación mundial. Para este estudio se utilizó un total de 19 animales, de estos 13 se inocularon intraduodenalmente con la cepa 638 y 6 conejos se inocularon con PBS (controles). A los animales se les retiró el alimento 24 h antes de la inoculación. En el ensayo se utilizaron dos concentraciones bacterianas para el desafío al utilizar la cepa 3008 para el estudio de protección, del total de conejos inmunizados, 7 de ellos y sus 3 controles se desafiaron con 1x106 UFC y con 1x107 UFC a los restantes 6 conejos y sus 3 controles.
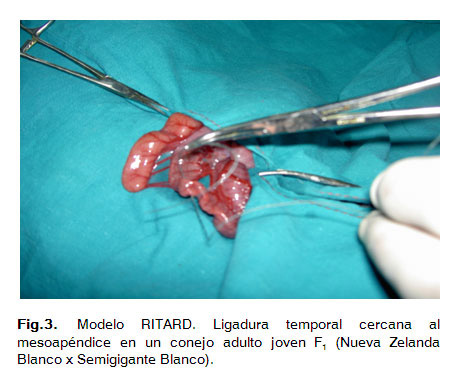
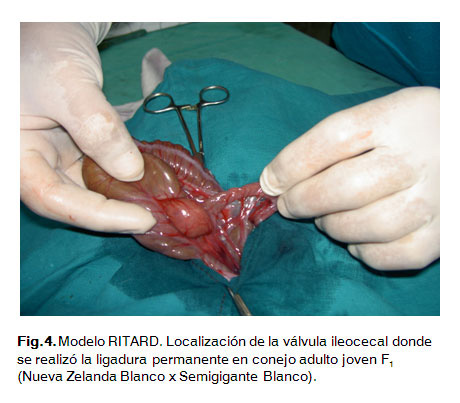
La suspensión bacteriana se preparó al seguir la misma metodología que se utilizó en la inoculación intraduodenal pero con la cepa 3008. Se realizaron diluciones hasta obtener inóculos con una concentración celular de 1x106 y 1x107 UFC/mL respectivamente. Se realizó la misma metodología de trabajo quirúrgico que para la inoculación intraduodenal, solo se varió el lugar de la laparotomía que igualmente es a nivel de la línea media abdominal pero a partir de la cicatriz umbilical hacia la pelvis y de aproximadamente 5 cm de longitud. Se localizó la válvula ileocecal realizando una ligadura permanente sin comprometer el riego sanguíneo de la zona, posteriormente en el ileon se realizó una ligadura temporal o lazo corredizo cercano al mesoapéndice, finalmente se le administró el inóculo bacteriano en el lumen del intestino delgado, específicamente en el ángulo de Treyi.Después de dos horas de administrado el inóculo se retiró la ligadura temporal o lazo corredizo (Fig. 3, 4, 5 y 6).

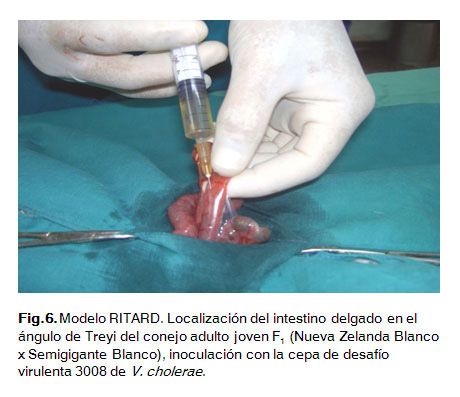
Con el objetivo de prolongar la inhibición de la motilidad intestinal luego de la administración del anestésico se les administró a los animales atropina por vía intramuscular (0,2 mg/Kg de peso vivo) (3).
Los animales inoculados se mantuvieron en aisladores standard flexible (presión negativa) marca La Calene. Luego se les realizó hisopado rectal a las 0, 24, 48 y 72 h y se cultivó las muestras en tubos que contenían agua-peptona alcalina (APA). Del APA se tomó una azada y se sembró por agotamiento en placas de Agar-Tiosulfato-Citrato-Sales Biliares-Sacarosa (TCBS) con el fin de determinar la presencia de colonias de V. cholerae.
Los fragmentos que se tomaron del duodeno, yeyuno e ileon de los animales muertos, se fijaron en formaldehído al 10%, para realizar el examen histológico, los fragmentos se embebieron en parafina y se tiñeron utilizando la técnica de hematoxilina-eosina (H.E) (19).
RESULTADOS Y DISCUSIÓN
Evaluación de la toxigenicidad
En la Figura 7 se muestran los fluidos acumulados promedio que se obtienen en el modelo de intestino ligado con las cepas modificadas genéticamente, las cepas epidémicas y el control negativo (cepa de E. coli K-12).
Se observaron diferencias estadísticas entre las cepas modificadas de primera, segunda y tercera generación y las cepas parentales epidémicas (p<0,05). No se observaron diferencias entre las cepas modificadas y la cepa de E. coli K-12 (p>0,05), con valores inferiores a 1 mL/cm de intestino.
Con el uso del modelo de intestino ligado de conejo o IlealLoop, se evaluó mediante la medición del fluido acumulado en un segmento de intestino ligado, la toxigenicidad de las cepas modificadas genéticamente. Estas cepas resultaron no tóxicas por los valores inferiores de fluido acumulado por cm de intestino al compararse con sus correspondientes parentales que mostraron niveles mayores que difirieron significativamente.
Este modelo se utiliza como prueba para la selección de nuevas variantes de cepas atenuadas a las quese les elimina el profago CTXf o se les aplica cualquier otra manipulación genética en busca de su atenuación. Otros autores obtuvieron resultados similares cuando evaluaron un candidato vacunal de V.cholerae, (1) al cual se le eliminaron los genes de la toxina de cólera y además utilizaron este modelo como ensayo de desafío.
Existen otras investigaciones que utilizan este biomodelo para describir la capacidad protectora del suero positivo de voluntarios inmunizados por vía oral con un candidato vacunal de células vivas atenuadas(7), de esta forma comprueban la inhibición de la toxigenicidad de cepas virulentas, con resultados similares a los obtenidos en este trabajo.
Evaluación de la inmunogenicidad (inoculación intraduodenal) y protección (RITARD)
En la Tabla 2 se muestran los resultados de los TMG de anticuerpos vibriocidas e IgG anti LPS del biomodelo de conejo adulto inoculado por vía intraduodenal, el cual se empleó para medir la capacidad inmunogénica de las cepas modificadas genéticamente.
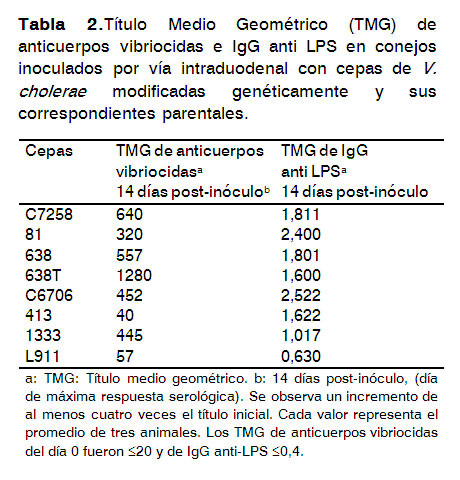
Los títulos corresponden a los 14 días después de la inoculación, que es el de máxima respuesta serológica. Se observó que en el suero de los animales inoculados existen niveles altos de anticuerpos vibriocidas que inducen las cepas parentales y las atenuadas, con valores de seroconversión superiores al 80%. No se encontraron diferencias significativas (p>0,05), excepto con las cepas 413 y L911 donde los títulos de anticuerpos vibriocidas inducidos fueron más bajos que el resto. Aunque los anticuerpos vibriocidas no son los responsables de la protección a nivel de mucosa, se conoce que existe una estrecha correlación entre los títulos de anticuerpos vibriocidas y la protección contra la colonización y la enfermedad (1).
Resultados similares se obtuvieron en los títulos de anticuerpos IgG anti LPS Ogawa, Inaba y O139 que se detectaron por ELISA. Estos títulos de anticuerpos se elevaron, al igual que los anticuerpos vibriocidas; tampoco se encontraron diferencias en la inducción de anticuerpos por las cepas parentales y atenuadas (p>0,05), con excepción de la cepa L911 que no cumplió con el criterio de aceptación para esta prueba por el bajo título de anticuerpos que indujo. Estos resultados concuerdan con Chatterjee,et al (20), quiénesplantean que la respuesta antibacteriana es dirigida fundamentalmente contra el LPS, que constituye el antígeno protector más importante en este microorganismo.
Los 7 animales inmunizados con la cepa 638 que se desafiaron con una dosis de 1x106 UFC sobrevivieron, para un 100% de protección, no así los 3 animales controles que recibieron esta misma dosis, los que murieron antes de las 24 h. Sin embargo, de los 6 animales que se inmunizaron y desafiaron con la dosis de 107 UFC, 4 sobrevivieron para un 66,6% de protección y 2 murieron 48 h después de inocularse la cepa de desafío, estos animales resultaron ser los de más bajos títulos de anticuerpos vibriocidas entre los animales que sobrevivieron (p<0,05). Con la dosis de 107 UFC los animales controles murieron antes de las 24 h.
Al estudiar la capacidad protectora de la cepa atenuada frente al desafío con la cepa virulenta 3008, se corroboró la relación existente entre el título de anticuerpos vibriocidas y la protección in vivo, ya que se encontró que animales con títulos superiores o iguales a 1280 estaban protegidos contra la enfermedad lo cual coincide con Ledón, et al (2).
Los resultados de esta investigación indican que realmente los conejos que sobrevivieron al desafío con la cepa virulenta estaban protegidos por la cepa 638 y no por su resistencia natural a la enfermedad, lo que se confirma cuando se compara con la respuesta de los animales no inmunizados, los cuales mostraron un severo cuadro clínico de diarrea característico de la infección.
Con el fin de comprobar que la bacteria virulenta (3008) inoculada colonizó adecuadamente al intestino y por último que se excretó, se realizó el hisopado rectal, donde se aisló V. cholerae en los animales muertos después del desafío. Sin embargo, en los animales inmunizados con la cepa 638 que sobrevivieron al desafío no se aisló V. cholerae en los 7 días que duró el ensayo de protección. Este resultado demuestra que los animales inmunizados que sobrevivieron al desafío adquirieron una inmunidad de mucosa, que afecta la colonización intestinal y la proliferación de la cepa inoculada. Este hallazgo apoya la posibilidad de alcanzar protección luego de la administración de una dosis única de la cepa atenuada 638 (3).
Estudios donde se utilizó el modelo RITARD después de una inmunización oral, con el objetivo de evaluar la inmunogenicidad protectora inducida por cepas de V. choleraeal desafiarse con vibrios vivos, brindan gran información sobre los preparados vacunales que se evaluaron en este estudio (7).
En los exámenes anatomopatológicos de las muestras obtenidas de los animales que murieron después de ser confrontados con la cepa virulenta 3008, evaluados con el modelo RITARD, se observaron graves daños en la mucosa intestinal, encontrándose áreas de necrosis, edemas a nivel de las glándulas de Lieberkühn, infiltrados de células plasmáticas en la mucosa y posibles colonias bacterianas a nivel de las glándulas. Resultados similares fueron obtenidos utilizando este modelo con cepas de V. choleraeNo-O1 (5).
Con el uso de los diferentes biomodelos en conejos se seleccionaron las cepas en estudio como candidatas a vacunas humanas contra el cólera. Cuando se va a desarrollar una nueva vacuna, la respuesta inmune es un punto importante a estudiar. Es importante utilizar un biomodelo animal adecuado para su futura extrapolación al humano, pues esta no es posible en aquellos casos en los que no se reporta la identidad entre la enfermedad del hombre y la del animal que se utiliza, y tener en cuenta que la inmunidad mucosal es importante en la protección contra la mayoría de los microorganismos patógenos (18).
El uso del modelo de ratón neonato se restringe a experimentos de colonización de corta duración y estudios de patogenicidad (16). Para la evaluación inmunológica de cepas candidatas a vacuna es más útil un modelo de inoculación intraduodenal en conejo adulto según García,et al (4). Mediante una sencilla y rápida intervención quirúrgica se coloca el inóculo bacteriano directamente en el duodeno, evitando la acidez estomacal a la cual es sensible V. cholerae. Este biomodelo permitió comprobar que los niveles de anticuerpos medidos tanto por ELISA como por la determinación de anticuerpos vibriocidas son comparables entre cepas atenuadas y virulentas.
La utilidad de modelos como perros, conejos y ratones, para el desarrollo y evaluación de vacunas vivas orales contra el cólera es limitado, porque los vibrios no colonizan los intestinos de los animales lo suficiente como para inducir una inmunidad local (21), ya que necesitan superar la acidez estomacal. A pesar de la administración de fármacos antiácidos, no se garantiza que la mayor parte de los vibrios lleguen vivos al intestino, colonicen y se adhieran para garantizar una respuesta local adecuada y protectora. Por esta razón, la inoculación intraduodenal logra evadir esta barrera al garantizar que la totalidad de los vibrios tengan la posibilidad de colonizar y adherirse a la mucosa intestinal, además que exista una respuesta inmunológica más adecuada según plantea García,et al (4). Recientemente se utilizó un modelo en ratón adulto donde se realiza tanto la inmunización como el desafío por vía nasal, este biomodelo se puede considerar para estudios preclínicos aunque no simula la vía natural de la infección (22).
La diarrea es una de las principales reacciones adversas producidas por vacunas de microorganismos vivos atenuados contra el cólera y define la condición de reactogenicidad para una cepa que se administre por vía oral. Esta fue simulada experimentalmente con el biomodelo RITARD (5, 9, 10), que se utiliza además para investigar la patología, colonización bacteriana y el volumen de fluido intestinal. Por las posibilidades que brinda este biomodelo se utilizó en conjunto con el modelo intraduodenal para evaluar la inmunidad protectora de la cepa atenuada 638 en conejos inmunizados luego del desafío con una cepa virulenta. Desde el punto de vista anatomopatológico se observó la protección en los animales inmunizados sin la evidencia de daños histológicos a nivel intestinal, no ocurriendo así en los animales controles (no inmunizados), donde se observó graves daños en la mucosa intestinal.
Estos biomodelos en conejoson confiables y útiles, aunque no reproducen de forma natural la enfermedad, no son totalmente extrapolables al hombre y se necesita realizar operaciones quirúrgicas de diferentes grados de complejidad;sin embargo el tracto intestinal y la mucosa oral es similar al del humano (23).
CONCLUSIONES
Los biomodelos en conejos permiten evaluar cepas candidatas vacunales contra Vibrio cholerae. Estas cepas resultaron ser no toxigénicas en el modelo de intestino ligado en conejos (IlealLoop). Exceptuando a las cepas 413 y L911 todas las demás resultaron inmunogénicas al igual que sus cepas parentales en el biomodelo de inoculación intraduodenal. Los animales inmunizados con una dosis de 1 x 109 UFC de la cepa atenuada 638 mostraron protección al desafío con la cepa virulenta 3008 en una dosis de 1 x 106 UFC mediante elbiomodelo RITARD.
REFERENCIAS
1. Liang W, Want S, Yu F, Zhang L, Qi G, Liu Y, et al. Construction and evaluation of a safe, live oral Vibrio cholerae vaccine candidate. IEM108.Infect Immun 2003;71(10):5498-504.
2. Ledón T, Ferrán B, Pérez C, Suzarte E, Vichi J, Marrero K, et al. TLP01, an msha mutant of Vibrio cholerae O139 as vaccine candidate. Microbes and Infection 2012;14:968-78.
3. García L, Oliva R, Cedré B, Valmaseda T, García H, Talavera A, et al. Intraduodenal inoculation of adults rabbits for evaluating the immunogenicity of genetically attenuated Vibrio cholerae strains. Lab Animal Science 1998;48(5):267-70.
4. Eko FO, Schukovskaya T, Lotzmanova EY, Firstova VV, Emalyanova NV, Klueva SN, et al. Evaluation of the protective efficacy of Vibrio cholerae ghost (VCG) candidate vaccines in rabbits. Vaccine 2003;21(25-26):3663-74.
5. Russell RG, Tall BD, Morris JG. Non-O1Vibrio cholerae intestinal pathology and invasion in the removable intestinal tie adult rabbit diarrhea model. InfectImmun 1992;60(2):435-42.
6. De SN, Chatterjee DN. An experimental study of the mechanism of action of Vibrio cholerae on the intestinal mucous membrane. J PatholBacteriol 1953;66:559-63.
7. Pérez JL, García L, Talavera A, Oliva R, Valmaseda T, Año G, et al. Passive protection of serum from volunteers inoculated with attenuated strain 638 of Vibrio cholerae O1 in animal models. Vaccine 2001;19:376-84.
8. Spira WW, Sack RB. Kinetics of early cholera infection in the removable intestinal tie-adult rabbit diarrhea model. InfectImmun 1982;35:952-7.
9. Kirn TJ, Taylor RK. TcpF is a soluble colonization factor and protective antigen secreted by El Tor and classical O1 and O139 Vibrio choleraeserogroups. InfectImmun 2005;73(8):4461-70.
10. Sack RB, Carpenter CJ. Experimental canine cholera. I. Development of the model. J InfectDis 1969;119:138-49.
11. Sack RB, Johnson J, Pierce NF, Keren DF, Yardley JH. Challenge of dogs with live enterotoxigenic Escherichia coli and effects of repeated challenges on fluid secretion in jejunalThiry-Vella loops. J InfectDis 1976;134(1):15-24.
12. Isupov IV, Podoprigora GI, Dushkin VA, Gorkova AV, Nazarova LS. Use of gnotobiotic animals for the study of the pathogenesis of cholera intoxication. ZhMikrobiolEpidemiolImmunobiol1988;12(12):44-8.
13. López Y, Infante JF, Sifontes S, Díaz D, Pérez V, Año G, et al. Pharmacology and toxicology of an oral tablet whole cells inactivated cholera vaccine in Sprague Dawley rats. Vaccine 2011;29(19):3596-9.
14. Lobanov VV, Kolpikova LD, Sharikov AM, Gavrilov BB. Experimental study of mixed infection by Vibrio cholerae and Salmonella typhi. ZhMikrobiolEpidemiolImmunobiol 1998;5(9):17-9.
15. Infante JF, Sifontes S, Sierra G, Campa C, Fariñas M, Oliva R, et al. Los biomodelos aplicados al desarrollo de vacunas y sueros en el Instituto Finlay. Animales de Experimentación, La Revista Hispanoamericana 1998;3(3):30-40.
16. Oliva R, García H, Infante JF, García L, Pérez JL, Cedré B, et al. Biomodelo para la evaluación de cepas atenuadas como candidatos vacunales contra el cólera humano. I. Estudio de la virulencia, capacidad de colonización y adherencia a la mucosa intestinal. VacciMonitor 2008;17(1):1-6.
17. Cedré B, García HM, García LG, Talavera A. Estandarización y evaluación del ensayo vibriocida modificado. Revista Cubana de Medicina Tropical 1999;51(3):156-9.
18. Alvarez N, Sarmiento ME, Mohd-Nor N, Acosta A. Uses of immunoglobulin A in the control of the infectious. Biotecnología Aplicada 2014;31(1):1-6.
19. Vacca LL. Laboratory Manual of Histochemestry. New York: De Raven Press Books; 1985.
20. Chatterjee SN, Chaudhuri K. Lipopolysaccharides of Vibrio cholerae. I. Physical and chemical characterization. BiochimBiophys Acta 2003;1639(2):65-79.
21. Ledón T, Ferrán B, Vichi J, Suzarte E, Oliva R, Fando R. Evaluación en modelos animales de cepas vivas atenuadas de Vibrio cholerae O139. Revista CENIC Ciencias Biológicas 2010;41(Edición Especial 1):1-12.
22. Kang SS, Yang JS, Kim KW, Yun CH, Holmgren J, Czerkinsky C, et al. Anti-bacterial and anti-toxic immunity induced by a killed whole-cell-cholera toxin B subunit cholera vaccine is essential for protection against lethal bacterial infection in mouse pulmonary cholera model. MucosalImmunology 2013;6(4):826-37.
23. Kondo M, Yamato M, Takagi R, Murakami D, Namiki H, Okano T. Significantly different proliferative potential of oral mucosal epithelial cells between six animal species. J Biomed Mater Res 2014;102(6):1829-37.
Recibido:Junio de 2014 Aceptado: Agosto de 2014













