Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Vaccimonitor
versión On-line ISSN 1025-0298
Vaccimonitor vol.26 no.1 Ciudad de la Habana ene.-abr. 2017
ARTÍCULO ORIGINAL
Dot Blot para determinar la identidad antigénica en vacunas conjugadas contra Streptococcus pneumoniae serotipo 19F
Dot Blot to determine the antigenic identity in conjugated vaccines against Streptococcus pneumoniae serotype 19F
Osmir Cabrera-Blanco*, Mónica Pisonero-Triana, Mercedes Rodríguez-Bejerano, Rocmira Pérez-Nicado, Elizabeth González-Aznar, Laura M. Rodríguez-Noda, Jessy Pedroso-Fernández, Dagmar García-Rivera
Instituto Finlay de Vacunas. Ave. 27 No. 19805, La Lisa, La Habana, Cuba.
email: ocabrera@finlay.edu.cu
* Investigador Titular; Dr. Ciencias Químicas.
RESUMEN
Las autoridades regulatorias recomiendan el uso de técnicas de Resonancia Magnética Nuclear o técnicas serológicas para la determinación de la identidad de los antígenos presentes en las vacunas conjugadas. Con la aparición de las vacunas conjugadas multivalentes, se ha hecho necesario recurrir a técnicas inmunoquímicas con la utilización de anticuerpos monoclonales para aumentar la sensibilidad en la determinación de la identidad de los antígenos en dichas vacunas conjugadas. El objetivo del presente trabajo fue establecer las condiciones óptimas de trabajo que permitieran utilizar la técnica del Dot Blot para determinar la identidad de los antígenos en vacunas conjugadas de Streptococcus pneumoniae serotipo 19F. Para ello se estudiaron los tiempos de incubación, la influencia del reactivo en la solución de bloqueo; también las concentraciones óptimas del anticuerpo monoclonal y de los ingredientes farmacéuticos activos, así como los volúmenes de aplicación óptimos para estos y vacunas. Se utilizó un anticuerpo monoclonal contra el polisacárido capsular del serotipo 19F de neumococo. Las muestras empleadas en este trabajo fueron lotes de ingredientes farmacéuticos activos de conjugados de polisacárido capsular 19F y lotes de un candidato vacunal cubano conjugado heptavalente contra neumococos. Los resultados mostraron que para la determinación de la identidad antigénica fueron suficientes 10 µL de muestras de los principios activos a una concentración de 125 µg/mL e igual volumen para las vacunas heptavalentes. Quedó demostrado que una concentración de 1 µg/mL para el anticuerpo monoclonal y tiempos de incubación de 30 min a 37 °C fueron suficientes para la determinación. Estos resultados permiten concluir que quedaron establecidas las condiciones óptimas de trabajo para determinar la identidad antigénica por Dot Blot del polisacárido capsular de S. pneumoniae serotipo 19F presente en las vacunas conjugadas.
Palabras clave: Dot Blot, anticuerpos monoclonales, Streptococcus pneumoniae.
ABSTRACT
Regulatory authorities recommend the use of NMR (Nuclear Magnetic Resonance) techniques or serological techniques to determine the identity of antigens on the conjugate vaccines. Due to the emergence of multivalent conjugate vaccines it has become necessary to use immunochemical techniques with the use of monoclonal antibodies (MAbs) in order to increase the sensitivity in determining the identity of such antigen in the conjugate vaccines. The aim of this study was to establish the optimal working conditions that would allow using Dot Blot technique to determine the identity of antigens in conjugate vaccines against Streptococcus pneumoniae serotype 19F. The incubation times, the possibility of using different reagents for blocking step were studied for this purpose; also the optimal concentrations of MAbs and active pharmaceutical ingredients (APIs), as well as the volumes of optimal application for APIs and vaccines. A monoclonal antibody against the capsular polysaccharide of S. pneumoniae serotype 19F (PsC 19F) was used. The samples used in this work, were samples of lots of APIs of monovalent conjugated PsC 19F and lots of Cuban heptavalent conjugate vaccine candidate against pneumococcus. The results showed that for the determination of the antigenic identity were optimal volumes of 10 µL of monovalent conjugate samples at 125 µg/mL and equal volume for heptavalent vaccines. For MAb was demonstrated that 1 µg/mL concentration of MAb against the PSC 19F and incubation times of 30 min at 37 °C were sufficient to successfully perform the determinations. In conclusion we can say that were established optimal working conditions to determine the antigenic identity, by Dot Blot, for the capsular polysaccharide of S. pneumoniae serotype 19F present in the APIs of monovalent conjugated and in the heptavalent conjugate vaccines.
Keywords: Dot Blot, monoclonal antibody, S. pneumoniae.
INTRODUCCIÓN
La infección por Streptococcus pneumoniae puede presentarse con muchas manifestaciones clínicas incluyendo meningitis, septicemia, bacteriemia, neumonía, otitis media aguda y sinusitis. Estas infecciones han causado gran morbilidad y mortalidad en todo el mundo, especialmente en los niños. La infección neumocócica cada año ha causado aproximadamente 14,5 millones de casos de enfermedad neumocócica invasiva (ENI) y 0,7-1 millones de muertes en niños menores de cinco años de edad, sobre todo en países en desarrollo y subdesarrollados (1).
Al menos 93 diferentes serotipos de S. pneumoniae han sido identificados basados en la reactividad cruzada de anticuerpos contra los polisacáridos capsulares. Aunque solamente un limitado grupo de serotipos son frecuentemente aislados de pacientes con neumonía, el desarrollo de una vacuna universal basada en los polisacáridos contra todas las infecciones con S. pneumoniae se ve obstaculizada por la especificidad de los anticuerpos y las variaciones de los serotipos prevalentes entre las diferentes poblaciones de áreas geográficas y demográficas (2). Una vacuna neumocócica polisacarídica 23-valente, que contenía a los polisacáridos capsulares (PsC) de los 23 serotipos más predominantes que representaban el 88 % de los casos de ENI, fue desarrollado en 1983 (3). Esta induce una respuesta inmune timo independiente y mostró una eficacia de 56-81 % en varios ensayos clínicos (4). Posteriormente se desarrolló una vacuna conjugada heptavalente para proporcionar protección contra la infección de siete serotipos (4, 6B, 9V, 14, 18C, 19F y 23F) que eran responsables de aproximadamente el 80 % de los casos de ENI en los niños pequeños en los Estados Unidos (5).
Uno de los requerimientos de los organismos regulatorios para la liberación de los lotes de vacunas para ser utilizadas en humanos, es la determinación de la identidad antigénica de los componentes vacunales, la cual puede determinarse por métodos serológicos con el uso de anticuerpos específicos a los PsC en cuestión o por técnicas de Resonancia Magnética Nuclear (RMN) (6).
Con el surgimiento de las vacunas conjugadas combinadas ha surgido también un reto para los laboratorios que se ocupan del control de calidad de dichas vacunas, ya que las mismas cuentan en su composición con varios polisacáridos, que en muchas ocasiones presentan estructuras químicas similares, lo que imposibilita tanto determinar la identidad antigénica por las técnicas de RMN, como cuantificarlos por las tradicionales técnicas colorimétricas empleadas; además de que las bajas concentraciones de los antígenos vacunales en la formulación final están por debajo de los límites de detección de estas técnicas.
Las técnicas inmunoquímicas son cada día más utilizadas en el control de calidad de las vacunas y más aún en las vacunas conjugadas, siendo las más utilizadas los ELISA y los Western Blot, debido a su sensibilidad que permite detectar bajas concentraciones de los antígenos en las formulaciones vacunales.
El Instituto Finlay de Vacunas, centro dedicado a la investigación, desarrollo y producción de estos fármacos, se encuentra trabajando en la obtención de una vacuna conjugada contra neumococos. Este candidato vacunal contiene siete ingredientes farmacéuticos activos (IFAs) de PsC de S. pneumoniae de los serotipos 1, 5, 6B, 14, 18C, 19F y 23F, enlazados covalentemente al toxoide tetánico (TT) como proteína portadora y adsorbidos en fosfato de aluminio como adyuvante (7,8).
El objetivo del presente trabajo fue establecer las condiciones analíticas que permitieran utilizar la técnica del Dot Blot y un anticuerpo monoclonal (AcM) para determinar la identidad del PsC de S. pneumoniae serotipo 19F (PsC 19F) en IFAs y en vacunas conjugadas multivalentes.
MATERIALES Y MÉTODOS
Muestras
a) Anticuerpos monoclonales: El AcM murino anti polisacárido capsular de S. pneumoniae serotipo 19F utilizado fue el 177/10/27/11 (Centro de Ingeniería Genética y Biotecnología (CIGB), Habana, Cuba).
b) Muestras: Para establecer las condiciones de trabajo en el desarrollo del Dot Blot para la identidad del PsC 19F, se utilizaron muestras de los lotes 19F-1202, 19F-1301 y 19F-1501 de IFAs del PsC conjugado a TT y muestras de los lotes Neu-1001, Neu-1101, Neu-1302 y Neu-1303 del candidato vacunal conjugado heptavalente; así como muestras de lotes de IFA de otros serotipos de S. pneumoniae presentes o no en el candidato vacunal heptavalente (1, 5, 6B, 14, 18C, 23F, 7F, 9V y 19A). Las proteínas TT, toxoide diftérico (TD) y la albúmina de huevo (OVA) también fueron incluidos en el estudio. Todas las muestras empleadas fueron obtenidas en el Instituto Finlay de Vacunas en condiciones de Buenas Prácticas de Manufactura, excepto la OVA (SIGMA, USA).
Dot Blot
Para la realización del Dot Blot, se utilizó un equipo Minifold II S&S (Alemania) acoplado a bomba de vacío y se empleó membrana de nitrocelulosa (MNC) de 0,45 µm (Bio-Rad, EUA). Se realizaron varios Dot Blot con los siguientes objetivos: determinar el tiempo de incubación; determinar la influencia del reactivo en la solución de bloqueo; determinar las concentraciones óptimas de AcM y de IFAs; determinar los volúmenes de aplicación óptimos para las IFAs y vacunas y para probar las condiciones establecidas en la identidad del PsC 19F en varios lotes de IFAs y vacunas. Para todos los estudios realizados se utilizó la membrana previamente remojada en Solución Salina Tamponada con Fosfatos 0,15 M, pH 7,2 (SSTF) (9).
Determinación del tiempo de incubación
Para la realización de este estudio fueron aplicados en la MNC bajo presión de vacío, 100 µL de una IFA de un conjugado monovalente del PsC 19F con TT (lote 19F-1301) a una concentración de 250 µg/mL. Posteriormente se extrajo la membrana del equipo y se procedió al bloqueo de los sitios activos remanentes con SSTF y leche descremada (LD) al 3 % durante 30 min a 37 °C. Después de tres lavados de 5 min cada uno con SSTF/Tween 20 al 0,05 %, se recortó la MNC en 2 tiras (una tira para cada tiempo de incubación) y fueron incubadas con el AcM anti PsC 19F a una concentración de 10 µg/mL en LD al 1 % en SSTF, durante 1 h a temperatura ambiente o 30 min a 37 ºC. Seguidamente las membranas fueron lavadas en la solución de lavado de la misma forma. Posterior a los lavados las MNC fueron incubadas con anti IgG de ratón conjugado a peroxidasa (Sigma, USA), a una dilución de 1:5000 en SSTF-LD 1 %, 1 h a temperatura ambiente o 30 min a 37 ºC. Posteriormente se realizaron 5 lavados de 3 min y se procedió al revelado, para lo cual se cubrió cada tira con SSTF/3,3-tetrahidrocloro diaminobenzidina (DAB) al 0.04 % y peróxido de hidrógeno (H2O2) al 0,5 %, durante 10 min. La reacción se detuvo realizando varios cambios con agua destilada.
Determinar la influencia del reactivo en la solución de bloqueo
Para la realización de este estudio fueron aplicadas 100 µL de las muestras en las mismas condiciones que para el estudio anterior y también fue utilizada la misma muestra (IFA 19F-1301). Posteriormente se extrajo la membrana del equipo y se cortó en tres tiras (una tira por cada solución de bloqueo) para realizar el proceso de bloqueo de los sitios activos remanentes, para lo cual se utilizó LD, Gelatina y Albúmina Sérica Bovina (BSA). Cada reactivo fue disuelto por separado al 3 % en SSTF, el proceso de incubación se llevó a cabo durante 30 min a 37 ºC. Después de tres lavados de 5 min cada uno con SSTF/Tween 20 al 0,05 %, fueron incubadas las tres MNC durante 30 min a 37 °C con el AcM anti polisacárido capsular de S. pneumoniae serotipo 19F a 2 µg/mL diluido en LD, o gelatina o BSA (según corresponda) al 1 % en SSTF durante 30 min a 37 ºC. Pasado el tiempo de incubación las membranas fueron lavadas de igual manera y seguidamente fueron incubadas por 30 min a 37 ºC con anti IgG de ratón conjugado a peroxidasa (Sigma, USA) a una dilución de 1:5000, diluido en LD, gelatina o BSA (según corresponda) al 1 % en SSTF. Posteriormente se realizaron 5 lavados de 3 min y se procedió al revelado, para lo cual se cubrió cada tira con SSTF/DAB al 0,04 % y H2O2 al 0,5 %, durante 10 min. La reacción se detuvo realizando varios cambios con agua destilada.
Determinar las concentraciones óptimas del anticuerpo monoclonal y de las muestras de monovalentes conjugados
Como muestra antigénica se utilizó el mismo lote de IFA empleada en los acápites anteriores (19F-1301). Se aplicó 100 µL en la MNC al vacío y por triplicado, haciendo diluciones dobles seriadas a partir de una concentración de 250 µg/mL hasta 1 µg/mL. El paso del bloqueo se realizó con LD al 3 % en SSTF, mientras que la incubación y lavados se realizaron igual a lo descrito en el acápite anterior. Posteriormente se cortó la membrana en tres tiras (una tira para cada concentración del AcM). Se utilizaron tres concentraciones diferentes (10, 2 y 1 µg/mL en LD al 1 % en SSTF) del AcM contra el polisacárido capsular del neumococo 19F. El resto de la técnica se realizó según lo descrito en el acápite anterior.
Determinar los volúmenes de aplicación óptimos para las IFAs y vacunas
Para este estudio fueron inmovilizados en una tira de MNC 10, 20, 50 y 100 µL de la IFA 19F-1301, ajustada previamente a una concentración de 125 µg/mL y fueron tomados iguales volúmenes para el candidato vacunal conjugado heptavalente (lote Neu 1302), los cuales fueron tomados directamente del bulbo (4 µg/mL) sin dilución previa; estas muestras de vacuna fueron inmovilizados en otra tira de MNC. La concentración del AcM empleada en este ensayo fue 1 µg/mL. El resto de la técnica siguió el procedimiento ya descrito.
Prueba de identidad del polisacárido capsular de S. pneumoniae serotipo 19F en lotes de IFAs y vacunas
Una vez que contamos con todos los parámetros de la técnica ajustados, escogimos tres lotes de IFAs del conjugado monovalente de neumococo 19F (lotes: 19F-1202, 19F-1301 y 19F-1501) de los cuales fueron aplicados 50 µL bajo vacío y previamente ajustados a una concentración de 125 µg/mL en una MNC. También fueron aplicadas en la MNC una muestra de 50 µL de lotes de IFAs de conjugados monovalentes de otros serotipos de neumococo (1, 5, 6B, 14, 18C, 23F, 7F, 9V y 19A), todas previamente ajustadas a una concentración de 125 µg/mL, así como muestras de las proteínas TT, TD y OVA a una concentración de 0,5 mg/mL. En otra tira de MNC fueron inmovilizados 20 µL de cuatro lotes del candidato vacunal conjugado heptavalente contra S. pneumoniae (lotes: Neu-1001, Neu-1101, Neu-1302 y Neu-1303) sin dilución previa. El resto de la técnica se realizó según los resultados obtenidos en los acápites anteriores.
Captura de las imágenes
Las imágenes de los Dot Blot fueron capturadas utilizando un densitómetro GS-800 (Bio-Rad, EUA) con software de captura y cuantificación (Quantity One).
RESULTADOS Y DISCUSIÓN
Determinación del tiempo de incubación
El primer parámetro que se estudió en este trabajo fue el tiempo de incubación empleado en los pasos de incubación con los anticuerpos, tanto el AcM anti PsC 19F como el anti IgG de ratón conjugado a peroxidasa ya que eran los pasos del proceso que duraban 1 hora cada uno. En la Figura 1 se muestran los resultados del estudio. Como puede observarse, para los dos tiempos estudiados se obtiene una mancha bien definida como una señal de que el PsC 19F está siendo reconocido por el AcM anti PsC 19F. La mayor intensidad de la mancha aparece cuando empleamos 1 h, mientras que al disminuir el tiempo de incubación se puede observar una ligera disminución de la intensidad de la coloración de las manchas, aunque suficiente para poder detectar al antígeno en la muestra analizada. Dentro de los parámetros que pueden afectar la intensidad de la coloración de la mancha podemos encontrar los tiempos de exposición entre los antígenos y los anticuerpos y el tiempo de revelado (10). En este trabajo se demostró que con 30 min de incubación a 37 °C, se obtienen manchas de reconocimiento antígeno-anticuerpo que evidencian la presencia del PsC 19F en las IFAs y en las vacunas conjugadas multivalentes.
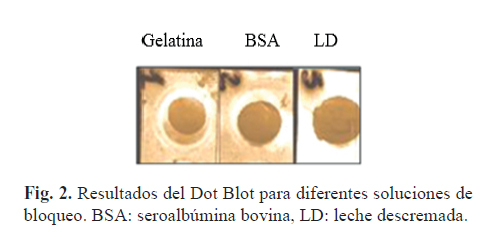
Determinar la influencia del reactivo en la solución de bloqueo
Los resultados obtenidos de la influencia de la gelatina, la BSA y la LD en el Dot Blot, se muestran en la Figura 2. Podemos observar que para las tres soluciones de bloqueo se obtuvieron manchas de coloración intensa que evidencian el reconocimiento antigénico en la muestra. También se puede observar que para las soluciones de gelatina y BSA a pesar de ser evidente la mancha de reconocimiento del PsC 19F por parte del AcM, se obtiene un fondo oscuro en la MNC alrededor de la mancha, lo cual no se observa con la LD, esto puede deberse a que el bloqueo de los sitios inespecíficos en la MNC con gelatina y BSA fue menos eficiente que el bloqueo logrado con la LD.
En las técnicas inmunoquímicas como ELISA o Dot Blot, es muy común emplear reactivos como la gelatina (11), la BSA (12,13) o LD (9) con la finalidad de bloquear los sitios activos remanentes después de fijado el antígeno en el soporte empleado para la técnica. Está descrito que la eficiencia de bloqueo para cada uno de estos reactivos va a depender de varios factores, por lo que hay que tener en cuenta la elección del mismo a la hora de desarrollar un método inmunoquímico (11). Según los resultados obtenidos podemos plantear que a pesar de ser más eficiente el bloqueo de los sitios inespecíficos con LD, pueden emplearse también la BSA o la gelatina como solución de bloqueo, para la determinación de la identidad antigénica del PsC 19F usando las mismas muestras y condiciones aplicadas en este trabajo.
Determinar las concentraciones óptimas del anticuerpo monoclonal y de las muestras de monovalentes conjugados
Los resultados obtenidos en la determinación de las concentraciones óptimas del anticuerpo monoclonal y de las muestras de monovalentes conjugados se muestran en la Figura 3. Se puede observar la presencia de manchas de reconocimiento antigénico para las diluciones de las muestras desde 250 µg/mL y hasta 4 µg/mL, apreciándose una disminución de la intensidad de la mancha a medida que disminuye la concentración de la muestra, hasta que a las concentraciones de 2 y 1 µg/mL no se observa la mancha de reconocimiento del AcM por el PsC presente en la muestra.
Con relación a la variación de la concentración del AcM, las manchas oscuras se comienzan a observar a partir de los 4 µg/mL de la IFA, aumentando la intensidad de la señal con el incremento de la concentración del AcM empleado, llegando a ser la concentración de 10 μg/mL de AcM y 250 μg/mL de la IFA, donde se observó la mancha con mayor intensidad de color. Teniendo en cuenta los resultados anteriores, decidimos recomendar las concentraciones de 125 μg/mL de la IFA y 1 μg/mL de este AcM como las condiciones de concentraciones óptimas de reconocimiento.
Determinar los volúmenes de aplicación óptimos para las IFAs y vacunas
Los resultados obtenidos en este experimento se muestran en la Figura 4. Las manchas oscuras evidencian el reconocimiento antigénico para todos los volúmenes estudiados tanto para la IFA como para el candidato vacunal, sin observarse diferencias entre los mismos. Otro aspecto importante a tener en cuenta en un Dot Blot, es el volumen de muestra aplicada en el paso de inmovilización, este aspecto es de particular importancia cuando estamos trabajando con muestras de formulaciones vacunales que se encuentran en bajas concentraciones y sobre todo cuando el antígeno de interés está en presencia de otros antígenos con estructuras semejantes, como es el caso de las vacunas conjugadas multivalentes contra neumococos. El resultado obtenido en este estudio nos sugiere que podemos utilizar hasta un volumen de 10 µL de estos tipos de muestras (IFAs y vacunas).
Prueba de identidad del polisacárido capsular de S. pneumoniae serotipo 19F en lotes de IFAs y vacunas
Los resultados obtenidos como prueba de identidad por Dot Blot con las condiciones de trabajo establecidas en este estudio se muestran en la Figura 5. Para todas las muestras donde estaba presente el PsC 19F se obtuvo una mancha oscura como reconocimiento del mismo por parte del AcM y como era de esperar, no apareció la mancha en los pozos donde fueron aplicadas muestras de lotes de las IFAs de los conjugados monovalentes de otros serotipos de S. pneumoniae, ni en los pozos donde fueron aplicadas las muestras de las proteínas. Este resultado es una evidencia de la especificidad de este AcM, que incluso es capaz de discernir entre el 19F y el 19A a pesar de su similitud estructural (Tabla 1). Con el surgimiento de las vacunas conjugadas combinadas ha surgido también un reto para los laboratorios que se ocupan del control de calidad de dichas vacunas, ya que las mismas cuentan en su composición con varios polisacáridos, que en muchas ocasiones presentan estructuras químicas similares, lo que imposibilita cuantificarlos por las técnicas colorimétricas tradicionales empleadas; además de que las bajas concentraciones de los antígenos vacunales en la formulación final, están por debajo de los límites de detección de estas técnicas colorimétricas. Por la misma razón se hace difícil el empleo de técnicas de RMN para determinar la identidad antigénica de los componentes vacunales. Una posible solución para estos problemas es la utilización de técnicas de ELISA que empleen AcM específicos contra los antígenos a evaluar.
REFERENCIAS
1. OBrien KL, Wolfson LJ, Watt JP, Henkle E, Oria-Knoll M, McCall N, et al. Burden of disease caused by Streptococcus pneumoniae in children younger than 5 years: Global estimates. Lancet 2009;374:893-902.
2. Tai SS. Streptococcus pneumoniae Serotype Distribution and Pneumococcal Conjugate Vaccine Serotype Coverage among Pediatric Patients in East and Southeast Asia, 2000–2014: A Pooled Data Analysis. Vaccines 2016;4(1):4. doi:10.3390/vaccines4010004
3. Centers for Disease Control and Prevention. Pneumococcal polysaccharide vaccine. MMWR 1989;38:64-76.
4. Centers for Disease Control and Prevention. Prevention of pneumococcal disease. MMWR 1997;46:1-24.
5. Centers for Disease Control and Prevention. Preventing pneumococcal disease among infants and Young Children. MMWR 2000;49:1-55.
6. WHO. Expert Committee on Biological Standardization. Recommendations to assure the quality, safety and efficacy of pneumococcal conjugate vaccines. Replacement of: TRS 927, Annex 2. Geneva: World Health Organization; 2009.
7. Dotres C, Puga R, Ricardo Y, Broño CR, Paredes B, Echemendía V, et al. Safety and preliminary immunogenicity of Cuban pneumococcal conjugate vaccine candidate in healthy children: A randomized phase I clinical trial. Vaccine 2014;32:5266-70.
8. González N, Paredes B, Pérez S, Mirabal M, Rivero I, González CA, et al. Safety and Immunogenicity of Cuban Antipneumococcal Conjugate Vaccine PCV7-TT in Healthy Adults. MEDICC Review 2015;17(4):32-7.
9. González E, Otero O, Cabrera O, Ramírez F, Fajardo A, Mandiarote A, et al. Evaluación de los Anticuerpos Monoclonales anti-polisacárido capsular de Neisseria meningitidis serogrupos A, C, Y, W y X para su uso en los ensayos de identidad. VacciMonitor 2015;24(2):64-70.
10. Ochoa RF. Técnicas inmunoenzimáticas en el desarrollo clínico de vacunas. La Habana: Finlay Ediciones; 2013.
11. Gibbs J. Effective Blocking Procedures. ELISA Technical Bulletin-No. 3. Kennebunk, Maine, USA: Corning Incorporated. Life Sciences; 2001. Disponible en: http://www.gongyingshi.com/item/doc/20141221/elisa3.pdf.
12. Cabrera O, Cuello M, Thörn K, Lindqvist M, Lastre M, González E, et al. La gD2 coadministrada con el AFCo1 por vía intranasal induce inmunidad protectora contra el virus de herpes simple tipo 2 en ratones. VacciMonitor 2012;21(3):19-25
13. Jelonek MT, Chang SJ, Chiu CY, Park MK, Nahm MH, Ward JI. Comparison of Naturally Acquired and Vaccine-Induced Antibodies to Haemophilus influenzae Type b Capsular Polysaccharide. Infect Immun 1993;61:5345-50.
Recibido: Noviembre de 2016 Aceptado: Diciembre de 2016