Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Vaccimonitor
versión On-line ISSN 1025-0298
Vaccimonitor vol.26 no.3 Ciudad de la Habana set.-dic. 2017
ARTÍCULO ORIGINAL
Evaluación de un antígeno de Brucella abortus para aglutinación en placa como prueba tamiz en el diagnóstico de la brucelosis bovina
Evaluation of a Brucella abortus antigen for plaque agglutination as screening test in the diagnosis of bovine brucellosis
David Rajme-Manzur*, Marian Hernández-Reyes, Meilyn Cruz-Soca, Leslie Padron-Fajardo
Grupo Empresarial LABIOFAM. Empresa Productora de Vacunas Virales y Bacterianas (EPVVB). Ave. Independencia, Km. 16½ CP. 17200. Boyeros, La Habana, Cuba.
email: drajme@nauta.cu
* Doctor en Medicina Veterinaria y Zootecnia. Especialista en Producciones Biofarmacéuticas.
RESUMEN
Este trabajo tuvo como objetivo obtener y validar un antígeno buferado de Brucella abortus para la prueba de aglutinación en placa como prueba diagnóstica de base de la brucelosis bovina. Se formularon tres lotes de antígeno a partir de la multiplicación de la cepa 99 de Brucella abortus. Se realizaron los controles de calidad correspondientes (determinación de pH, volumen celular, esterilidad, capacidad buferante) y las pruebas serológicas para la evaluación del desempeño. Se emplearon 1070 muestras de suero bovino (350 positivas y 720 negativas) previamente controladas con las pruebas de diagnóstico establecidas. Se determinó la sensibilidad y especificidad diagnóstica y relativa, los valores predictivos positivos y negativos, la eficacia y la concordancia. En los tres lotes todas las características evaluadas resultaron estar dentro de los parámetros establecidos para este tipo de producto. La especificidad y sensibilidad diagnósticas fueron de 99,5% y 100% respectivamente. El valor predictivo positivo fue de 99,1%, el valor predictivo negativo fue de 100% y la eficacia de un 99,7%. El antígeno mostró una sensibilidad y especificidad relativas de un 100% y la concordancia resultó ser clasificada como muy buena. La evaluación del desempeño arrojó resultados satisfactorios, demostrando que el método de producción empleado es factible para la obtención de un producto con adecuada eficacia.
Palabras clave: Brucella abortus, aglutinación en placa, brucelosis.
ABSTRACT
The objective of this work was to obtain and validate a buffered Brucella abortus antigen for plaque agglutination test as the basic diagnostic test for bovine brucellosis. Three batches of antigen were formulated from the multiplication of strain 99 of Brucella abortus. Quality controls (determination of pH, cell volume, sterility, buffering capacity) and serological tests for performance evaluation were performed. 1070 bovine serum samples (350 positive and 720 negative) previously tested with the established diagnostic tests were used. Diagnostic and relative sensitivity and specificity, positive predictive values and negative predictive values, efficacy and concordance were determined. In all lots the evaluated characteristics proved to be within the parameters established for this type of product. Diagnostic specificity and sensitivity were 99.5% and 100%, respectively. The positive predictive values was 99.1%, the negative predictive values was 100% and the efficacy was 99.7%. The antigen showed a relative sensitivity and specificity of 100% and the concordance was classified as very good. The performance evaluation showed satisfactory results, demonstrating that the production method used is feasible to obtain a product with adequate efficiency.
Keywords: Brucella abortus, plaque agglutination test, brucellosis.
INTRODUCCIÓN
La brucelosis es una enfermedad infectocontagiosa de origen bacteriano y carácter zoonótico, producida por microorganismos del género Brucella (1). Este agente biológico es una bacteria Gram negativa con un lipopolisacárido (LPS) fuertemente inmunodominante, lo que junto a la capacidad de sobrevivir en el interior de células fagocíticas constituyen sus principales factores de virulencia (2). La infección en bovinos es generalmente causada por Brucella abortus, Brucella melitensis y Brucella ovis que afectan principalmente a pequeños rumiantes.
Las especies B. abortus y B. melitensis se transmiten generalmente entre animales por contacto con la placenta, líquidos fetales y las descargas vaginales de un animal infectado. Los animales eliminan brucelas después de un aborto o de un parto a término. Aunque los rumiantes generalmente no presentan síntomas después de su primer aborto, pueden convertirse en portadores crónicos y continuar eliminando gérmenes en la leche y en las descargas uterinas durante las preñeces posteriores (3, 4). La enfermedad se caracteriza por la presentación de abortos, retención placentaria, orquitis, epididimitis e infertilidad, lo cual se traduce en graves daños económicos debido a las pérdidas de terneros y disminución en la producción de leche.
El diagnóstico clínico no es de gran utilidad ya que no hay signos patognomónicos, en general, el aborto se produce en varios animales y son necesarias las pruebas de laboratorio para confirmar la presencia del agente etiológico (5). Las pruebas serológicas dan una evidencia indirecta de la infección brucélica, ya que cuando son efectuadas en forma uniforme y se interpretan con criterio epidemiológico, constituyen el instrumento más práctico para el diagnóstico. Existen numerosas pruebas para el diagnóstico serológico de brucelosis. Estratégicamente se utilizan de inicio pruebas de alta sensibilidad (tamiz) y luego las confirmatorias de menor sensibilidad, pero más específicas (6). Ninguna prueba serológica aislada es adecuada en cualquiera de las situaciones epidemiológicas, presentando limitaciones en el diagnóstico de animales individuales. Se deben considerar todos los factores que influyen en la relevancia del método de prueba y de sus resultados para una aplicación o interpretación diagnóstica específica (7, 8). Se ha planteado que para el control de la brucelosis en un país o región, son adecuadas para el pesquisaje las pruebas con antígeno tamponado de Brucella, tanto la prueba con Rosa de Bengala (RB) como la prueba de aglutinación buferada en placa (ABP), atribuyéndosele a esta última una mayor especificidad (9).
Las reacciones positivas deben volverse a comprobar utilizando una estrategia confirmatoria adecuada. En Cuba se emplea la RB y la seroaglutinación lenta en tubos (SAT) como tamiz, y como confirmatorias la prueba de 2-Mercaptoetanol (2-ME) y la reacción de fijación del complemento (RFC). El ensayo de RFC presenta la mejor correlación con los aislamientos en animales, natural o experimentalmente infectados, lo que llevó a su adopción como método de referencia para la validación de otros ensayos serológicos. Este trabajo tuvo como objetivo obtener y validar un antígeno buferado de Brucella abortus para la prueba de aglutinación en placa (ABP) como prueba diagnóstica de base de la brucelosis bovina.
MATERIALES Y MÉTODOS
Se utilizó la cepa 99 de B. abortus (Weybridge) (S99), la cual se conserva liofilizada en el cepario de la Empresa productora de Vacunas Virales y Bacterianas (EPVVB) de LABIOFAM, La Habana, Cuba y cumple con los requerimientos establecidos internacionalmente para este microorganismo. Para la producción del antígeno, la cepa se multiplicó en tubos de agar inclinado con medio de infusión de patata que se incubaron a 37°C durante 48 h.
La pureza del crecimiento se comprobó mediante la siembra en placas de Agar Patata (AP) y Agar Dextrosa Saboraud (ADS), y en tubos de Caldo Soya Triptona (CST), Caldo Tioglicolato (CT) y Caldo Andrade (CA) con campana de Durham, evaluándose las características micromorfológicas de las colonias en el medio sólido y el grado de turbidez en medio líquido. El ensayo se consideró satisfactorio, cuando se observaron colonias redondas, de 1-2 mm de diámetro, con bordes lisos, translúcidas y de color miel pálido en medio AP y producción de turbidez ligera y homogénea en CST, así como la no producción de ácido ni gas en CA. También se realizaron pruebas de disociación microbiana mediante el método de inmersión en Cristal violeta (9).
La prueba se consideró satisfactoria cuando se obtuvieron más de un 90% de colonias bacterianas en fase lisa. Posteriormente el microorganismo fue cultivado en el medio líquido recomendado por la OIE (9) hasta llegar a escala de fermentador (400 L de volumen de cultivo) con un pH inicial de 6,6. Se utilizó un reactor tipo tanque agitado con sistema discontinuo (batch) y agitador tipo paleta. Durante el crecimiento se empleó aireación (1vvm) y agitación (100 rpm) constantes. El proceso se controló a partir de la medición del pH (pHmetro HANNA) y la absorbancia (Espectrofotómetro Génesis), así como la observación microscópica del cultivo (microscopio óptico OLYMPUS) mediante tinción de Gram. Para confirmar su pureza se realizaron controles del proceso tanto en medio sólido como líquido (antes mencionados). También se determinó la viabilidad por la técnica de placa vertida (10).
Los valores de densidad óptica (DO) obtenidos se emplearon para confeccionar la curva de crecimiento del microorganismo en estas condiciones y la fermentación se dio por concluida cuando dichos valores no tuvieron variación significativa en el intervalo de una hora. Los microorganismos se inactivaron por calentamiento a 80°C durante 90 min y se utilizó fenol como preservo al 0,5% (v/v). Después de comprobar la total inactivación del cultivo, la biomasa bacteriana se recobró mediante centrifugación refrigerada de flujo continuo (centrifuga de flujo continuo, SHARPLES) a 17000 rpm y se resuspendió en tres partes de búfer de fosfatos fenolado al 0,5% (v/v). El volumen de células presentes en la suspensión inactivada se determinó centrifugando por triplicado volúmenes de 1 mL en tubos Wintrobe a 3000 rpm durante 75 min (centrífuga refrigerada de mesa, SIGMA).
Para la elaboración de los lotes de ABP se añadieron 6 mL de colorante por litro de suspensión celular, y luego de agitar y filtrar la mezcla por algodón absorbente estéril, se centrifugó con 10000 rpm a 4°C y las células teñidas precipitadas se resuspendieron en diluyente tamponado (9) a una concentración final de 14 g de células (en peso húmedo) por cada 100 mL de diluyente. De la suspensión madre coloreada se obtuvieron tres lotes de ABP que se envasaron en bulbos de vidrio incoloro de 10 mL con calidad hidrolítica tipo II y boca de 20 mm y fueron sellados con tapón de bromobutilo gris de 20 mm y sello de aluminio anonizado de 20 mm. Luego de envasado el antígeno, se realizaron los controles de calidad correspondientes (determinación de pH, volumen celular, esterilidad, capacidad buferante), considerándose como conformes los encontrados dentro los límites que se muestran en la Tabla 1.
Las pruebas serológicas se llevaron a cabo con una batería de sueros de bovinos procedentes de varias regiones de Cuba (Camagüey, Pinar del Río, Artemisa) previamente testados con las pruebas de diagnóstico establecidas (RB, SAT y RFC), todas de producción nacional (LABIOFAM). Dichos sueros se clasificaron de la manera que se muestra en la Tabla 2. Se emplearon un total de 1070 muestras de suero (350 positivas y 720 negativas) las cuales se procesaron con el ABP experimental y el ABP de referencia (SENASA, Argentina) simultáneamente. Para la ejecución del ensayo con ABP y la lectura e interpretación de los resultados, se tomó como referencia lo establecido por otros autores (9, 11) y se procedió de la siguiente manera: Se empleó una placa de vidrio cuadriculada (limpia y seca) sobre el aglutinoscopio. Con micropipeta automática apoyada sobre la placa de vidrio, se depositaron 80 µL de cada muestra de suero, utilizando una punta para cada suero y 30 µL de antígeno próximo a la gota del suero, con la precaución de no tocar el suero para no contaminar con la punta el frasco de antígeno.
El suero y el antígeno se mezclaron bien con mezclador de acrílico, abarcando una superficie circular aproximada de 3 cm de diámetro. Se imprimieron 3 movimientos en forma rotativa a la placa de vidrio hasta homogeneizar la mezcla, se colocó la placa sobre el aglutinoscopio y se tapó, permaneciendo la luz apagada. Se efectuó una nueva rotación, pasados 4 min y se dejó en reposo otros cuatro. A los 8 min, rotando de nuevo la placa y con la luz encendida, se procedió a la lectura.
Lectura e interpretación de resultados
Las reacciones se clasificaron en:
Positivas: Formación de grumos, aun siendo finos.
Negativas: Cuando la mezcla suero-antígeno era de turbidez homogénea y sin grumos.
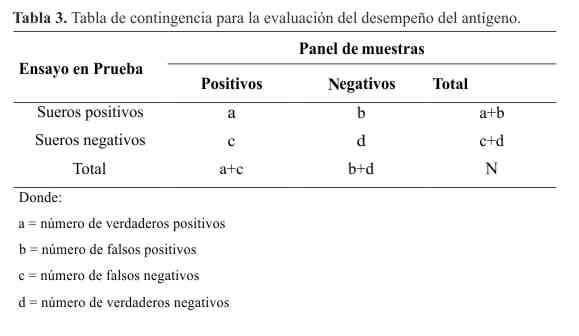
El límite de detección se determinó preparando diluciones seriadas en base 2 (desde 1:2 hasta 1:1024) de una muestra positiva de referencia (Suero Patrón Nacional) que contenía 1000 Unidades Internacionales de Fijación de Complemento (UIFC), analizando cuatro replicados de cada dilución. El proceso de evaluación del desempeño se basó en la determinación de una serie de parámetros a partir de tablas de contingencia 2x2 (11, 12) (Tabla 3).
Con respecto a la RFC se evaluaron los siguientes parámetros:
Sensibilidad diagnóstica (S) S=a/(a + c) x 100
Especificidad diagnóstica (E) E=d/(b + d) x 100
Valores predictivos positivos (VPP) y negativos (VPN) VPP = a/(a + b) x 100 VPN = d/(c + d) x 100
Eficacia = {(a + d) / (a + b + c + d)} x 100
Con respecto al ABP de referencia se evaluaron los siguientes parámetros:
Sensibilidad relativa (S) S=a/(a + c) x 100
Especificidad relativa (E) E=d/(b + d) x 100
Concordancia: mediante el cálculo del índice kappa (k) k = po – pe / 1 – pe
Donde: po = a + d / n y pe = (P + N) / n
Concordancia de los positivos P) = [{(a + b) / n} x {(a + c) / n}] x n
Concordancia de los negativos N) = (c + d) - {(a + c) – P }
La concordancia de los resultados se estimó según la siguiente clasificación (11, 12).
| Concordancia | Kappa |
| Deficiente | <0,20 |
| Deficiente | 0,21-0,4 |
| Moderada | 0,41-0,6 |
| Buena | 0,61-0,8 |
| Muy buena | 0,81-1,00 |
RESULTADOS Y DISCUSIÓN
Los controles microbiológicos realizados durante el escalado del proceso, desde la apertura de ámpula en medio sólido hasta el cultivo en fermentador, no mostraron evidencia de contaminación microbiana. Se obtuvo un cultivo puro sin disociación en formas rugosas. A partir de la centrifugación del cultivo inactivado se logró el recobrado de la biomasa bacteriana con un peso húmedo de 645 g con la cual, luego de diluida en búfer de fosfatos, se obtuvo una suspensión estable de color blanco lechoso y consistencia densa (41% de concentración celular determinada por el método de Wintrobe), sin evidencia alguna de autoaglutinación.
La prueba de inactividad realizada no mostró crecimiento alguno después de 7 días de incubación a 37°C. Los resultados de los controles físico-químicos y microbiológicos de los tres lotes experimentales de ABP elaborados se muestran en la Tabla 4. En los tres lotes experimentales así como en el ABP comercial, todas las características evaluadas resultaron estar dentro de los parámetros establecidos para este tipo de producto.
Como se ha establecido (9) la suspensión bacteriana de ABP debe tener un volumen de 10-12% de células teñidas de coloración azul verdosa. El pH del antígeno tamponado en placa debe ser de 3,70 ± 0,03 y el pH de una mezcla suero-antígeno a una razón 8:3 debe ser de 4,02 ± 0,04. El principio de esta prueba se basa en la inhibición–inactivación de algunas aglutininas inespecíficas a pH bajo, fundamentalmente IgM. Es una prueba cualitativa muy sensible que detecta IgG1 y su positividad persiste por mucho tiempo.
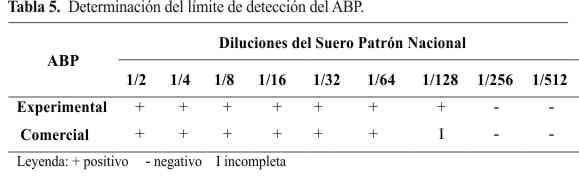
En la Tabla 5 se muestra el desempeño analítico del ABP en estudio, observándose que el límite de detección es de 1:128 (dilución más alta donde se observa una reacción claramente positiva I). En las Tablas 6 y 7 se reflejan los resultados de la ejecución del ensayo serológico del ABP experimental con respecto a la prueba de RFC. En este ensayo se obtuvieron tres resultados falsos positivos con respecto a la prueba de RFC. Sin embargo, el desempeño diagnóstico del antígeno fue muy bueno (Tabla 7).
Tal y como plantean varios autores (9, 13) esta prueba es muy sensible, especialmente para la detección de anticuerpos inducidos por otros agentes que comparten antígenos comunes y las muestras positivas deben volverse a verificar con pruebas confirmativas. Se ha reportado para esta prueba una sensibilidad del 99,5% y una especificidad del 95% (14). Otros autores (15, 16) reportaron valores de sensibilidad y especificidad del 99,9% y 97% respectivamente.
La prueba con ABP (al igual que la RB) puede dar reacción positiva antes que las pruebas estándar de seroaglutinación hayan alcanzado los títulos correspondientes a clasificación de reaccionante positivo, lo que se debe probablemente a niveles adecuados de IgG1 que reaccionan con el antígeno tamponado antes que la totalidad de anticuerpos (IgM e IgG2) logren títulos o alcancen ser referenciales como diagnóstico en otras pruebas convencionales (15). El diagnóstico definitivo de cualquier enfermedad es obtenido por aislamiento e identificación del agente, método viable cuando se trabaja con rebaños. Pero en el caso de brucelosis, las operaciones de certificación de rebaños libres se apoyan en el serodiagnóstico, teniéndose en cuenta en la elección de las pruebas a ser aplicadas, sus características intrínsecas, el costo y a la practicidad de la ejecución. Existen varios ensayos utilizando antígeno acidificado buferado, como ABP y RB, y la mayoría de los países los usan dentro de una batería de técnicas (16, 17).
El lipopolisacárido en fase lisa (LPS-S) de Brucella consta de una parte glicolipídica (lípido A), insertada en la membrana externa y otra polisacarídica expuesta hacia el exterior. Esta última se divide en dos secciones: el núcleo o core, más interno y la cadena O. Esta cadena es el antígeno inmunodominante de superficie, capaz de inducir una respuesta serológica en la mayoría de los animales en contacto con especies lisas de Brucella (B. abortus, B. melitensis y B. suis); además es la estructura antigénica más expuesta y blanco de anticuerpos protectores. Sin embargo, la cadena O posee epítopes compartidos con otras especies bacterianas como Yersinia enterocolítica O:9, Vibrio cholerae, Salmonella landau, Escherichia coli O:157 H7, Pasteurella multocida, responsables de reactividad cruzada en las pruebas serológicas que se basan en la detección de anticuerpos hacia este antígeno (18). De acuerdo con otros autores (19) no existe una única prueba capaz de identificar todos los animales infectados o certificar todos los animales libres de la enfermedad.
Las reacciones positivas deben volverse a comprobar utilizando una estrategia confirmativa adecuada. La sensibilidad y especificidad diagnósticas son los principales indicadores de rendimiento del proceso de validación. Las pruebas de anticuerpos se someten a los mismos procedimientos generales de estimación de estos parámetros que los exigidos para otros tipos de pruebas. El número de animales necesario para estimar la sensibilidad y especificidad diagnósticas aceptables está en función del nivel de confianza deseado en dichas estimaciones y del error admisible que se acepte. En el caso de una enfermedad como la brucelosis, es necesario reducir la probabilidad de que los animales infectados se clasifiquen erróneamente como no infectados, lo cual reduce el error admisible en el resultado de la prueba, lo cual, a su vez, aumenta el número de muestras necesarias para establecer un nivel alto de confianza en las estimaciones de la sensibilidad diagnóstica (20).
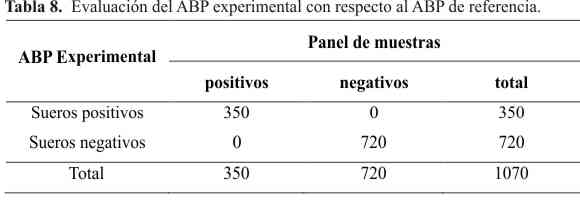
En la Tabla 8 se reflejan los resultados de la ejecución del ensayo serológico del ABP experimental con respecto al ABP de referencia. En este caso hubo total coincidencia entre ambas pruebas al obtenerse la misma cantidad de muestras positivas y negativas en el panel de sueros empleado. El método analítico candidato debe ejecutarse simultáneamente a una prueba de referencia, empleando el mismo grupo de muestras en ambos, para determinar si el método candidato muestra las mismas características cuantitativas y cualitativas que el método estándar (20). El cálculo de los parámetros que se utilizaron para la evaluación del desempeño del ABP experimental con respecto al ABP comercial arrojaron una sensibilidad y especificidad relativas de un 100% y una concordancia igual a 1. Los resultados no mostraron diferencias en cuanto al desempeño de ambos antígenos. El ABP experimental mostró una sensibilidad y especificidad adecuadas y la concordancia resultó ser clasificada como muy buena. El uso de esta prueba, por un lado asociada a otros ensayos confirmatorios como 2-ME y RFC y por otro incluyendo el empleo de recursos humanos y económicos, permitirá ejecutar las campañas de control y erradicación de la brucelosis en el país con adecuada eficiencia.
REFERENCIAS
1. Onate AA, Duncan JR. Animal Brucellosis. J. Bacteriol 2014;182:4849-55.
2. Seleem MN, Boyle SM, Sriranganathan N. Brucella: a pathogen without classic virulence genes. Veterinary Microbiology 2008;129:1-14.
3. Deqiu S, Donglou X, Jiming Y. Epidemiology and control of brucellosis. Veterinary Microbiology 2012;90:165-82.
4. López A, Contreras A. Brucella. Scand J Infect Dis 2004;36(12):636-8.
5. Samartino LE. Aspectos generales de la brucelosis bovina. INTA 2003;77(2):86-90.
6. Bricker BJ. Diagnostic strategies used for the identification of Brucella. Veterinary Microbiology 2002;134:433-34.
7. Abdoel T, Travassos I, Cardoso R, Smits HL. Simple and rapid field tests for brucellosis in livestock. Veterinary Microbiology 2013;130:312-9.
8. Samartino L, Schust M, Piazza E, Salustio E, Conde S. Diagnóstico de la brucelosis animal: implementación de nuevas tecnologías. Archivos Latinoamericanos de Producción Animal 2007;143(15):20-3.
9. Organización Mundial de Sanidad Animal (OIE). Manual de las pruebas de diagnóstico y de las vacunas para animales terrestres (mamíferos, aves y abejas). París: OIE; 2016.
10. Camacho A, Giles M, Ortegón A, Palao M, Serrano B. Técnicas de Análisis Microbiológico. México: Facultad de Biología, UNAM; 2014.
11. Nicola A, Sebastian E. Manual de Diagnóstico Serológico de la Brucelosis Bovina. Buenos Aires: Servicio Nacional de Sanidad y Calidad Agroalimentaria (SENASA); 2013.
12. Ochoa R, Martínez JC, Estrada E, García A, Ferriol X, Blanco R, et al. Validación de inmunoensayos cualitativos usados para evaluar la inmunogenicidad de vacunas. Vaccimonitor 2000;9(1):1-4.
13. World Organization for Animal Health (OIE). Standard for Management and Technical Requirements for Laboratories Conducting Tests for Infectious Diseases. E Quality Standard and Guidelines for Veterinary Laboratories: Infectious Diseases. Paris: OIE; 2008. p.1–31.
14. Nielsen K, Smith P, Yu W, Nicoletti P, Elzer P, Robles C, et al. Towards single screening tests for brucellosis. OIE Rev Sci Tech 2005;45:1027-38.
15. Silva P, Vigliocco AM, Ramondino R, Marticorena D, Bici E, Briones G, et al. Evaluation of primary binding assays for presumptive serodiagnosis of swine brucellosis in Argentina. Clin Diag Lab Immunol 2000;68:828-31.
16. Padilla F. Estrategias actuales en el diagnóstico de la brucelosis bovina. Inmunología veterinaria aplicada a salud Animal; Rev Med Vet 2015;53(3):68-9.
17. Nielsen K. Diagnosis of brucellosis by serology. Vet Microbiol 2002;90:447-59.
18. Corbel MJ. Recent advances of Brucella antigens and their serological cross-reactions. Vet Bull 2015;55:927-42.
19. Pouillot R, Garin-Bastuji B, Repiquet D, Terrier P, Gerbier G, Bénet JJ, et al. Risk factors for false-positive serological reactions for bovine brucellosis. Preventive Veterinary Medicine 2012;35:165-79.
20. World Organization for Animal Health (OIE). Manual of standards for diagnostic test and vaccines. Paris: OIE; 2014.
Recibido: Julio de 2017 Aceptado: Agosto de 2017