Introducción
Entre las entidades capaces de producir un proceso neuroinflamatorio se encuentran las meningoencefalitis, que son un grupo de enfermedades en las que básicamente lo que ocurre es una reacción inflamatoria de las meninges (meningitis), del parénquima cerebral (encefalitis) o de ambas estructuras simultáneamente.1,2
Entre las meningoencefalitis de etiología viral se encuentran implicados entre otras familias, los paramixovirus (virus de la parotiditis, sarampión y rubeola).2
En Cuba la vigilancia de estas infecciones se estableció desde 1961 mediante el reporte de las enfermedades de declaración obligatoria que incluía solamente las meningoencefalitis bacterianas y meningoencefalitis virales.3
La parotiditis es una enfermedad infecciosa aguda causada por un paramixovirus estrechamente relacionado con el virus de la parainfluenza. Si bien la enfermedad suele ser leve, no se debe subestimar la carga de morbilidad que representa. Hasta un 10% de los pacientes desarrollan meningitis aséptica. Una complicación menos frecuente, pero más grave, es la encefalitis, que puede ser una causa de muerte o discapacidad. La transmisión del virus se produce por diseminación aérea y por contacto directo con la saliva de una persona infectada. El único reservorio es el ser humano y tiene una distribución universal.2
El sarampión es una enfermedad infectocontagiosa caracterizada por fiebre, rinitis, tos y conjuntivitis, seguida por la aparición de una erupción maculopapular, cuya presencia produce una mortalidad alta, en una población que no estuvo expuesta al virus con anterioridad. El virus se disemina a través de aerosoles y sólo una pequeña cantidad se requiere para infectar a un individuo susceptible.2,4,5
La rubeola es una enfermedad que se caracteriza por fiebre moderada, erupción morbiliforme y linfadenopatías. La enfermedad se transmite por aerosoles de las personas infectadas a individuos susceptibles. El virus se multiplica a nivel de la mucosa del aparato respiratorio superior y luego se disemina por vía linfática a los ganglios regionales.2,6
Las vacunas combinadas trivalentes han sido utilizadas durante años en Estados Unidos y en la mayor parte de los países europeos. Varios países latinoamericanos como Argentina, Brasil, Chile, Colombia, Costa Rica, Cuba, El Salvador, México, Panamá y Uruguay han incluido la vacuna contra parotiditis, rubeola y sarampión (PRS) en sus programas nacionales de vacunación.7
En años recientes esta estrategia ha impulsado el desarrollo de vacunas PRS con nuevos elementos tecnológicos; en especial, cambios en las cepas empleadas contra parotiditis. Con el tiempo han aparecido algunas diferencias en el tipo de vacuna PRS en distintas regiones del mundo.8
La eficacia clínica protectora de la vacuna PRS está entre 70% y 95%. La tasa de seroconversión lograda con la vacuna es de 97-99% y la inmunidad que confiere es de larga duración.9 Estas cifras pueden variar en los diferentes contextos de producción y aplicación por múltiples factores.
En Cuba en el año 1986 se realizó una campaña nacional de vacunación con la triple viral en toda la población infantil de 1 a 14 años. Los niños y niñas fueron vacunados sin tener en cuenta su condición inmunitaria o si habían padecido alguna de estas enfermedades. Este proceso llevó 6 meses. Luego se implantó esta vacuna al cumplir 1 año de edad, lográndose coberturas superiores a 95%.10
Con la aplicación de la vacuna y todas las medidas de control aplicadas, se produjo una disminución de la incidencia; los últimos casos de sarampión fueron reportados en 1993 y los de rubeola y parotiditis en 1995.11
Un proceso neuroinflamatorio se caracteriza por la identificación de las clases mayores de inmunoglobulinas en el SNC como respuesta adaptativa.1 Para realizar esta evaluación se emplea el reibergrama, el cual permite discriminar la fracción de inmunoglobulinas sintetizada localmente de la que pasa por simple difusión de la sangre al LCR.12
El estudio neuroinmunológico permite identificar el nivel de anticuerpos de memoria de una población dada a partir de la respuesta policlonal y poliespecífica que se produce en el SNC en un proceso neuroinflamatorio.13-15
El objetivo del presente estudio es determinar la respuesta poliespecífica de anticuerpos de tipo IgG anti-parotiditis, -rubeola y -sarampión en pacientes pediátricos con meningoencefalitis víricas agudas a partir de sus respectivos índices de anticuerpos.
Materiales y Métodos
Diseño experimental
En 2018 se realizó un estudio retrospectivo en muestras de pacientes pediátricos con meningoencefalitis viral aguda que habían sido vacunados con la triple viral PRS donde se utilizó el índice de anticuerpos específicos anti-parotiditis, anti-rubeola y anti-sarampión para identificar el estado de respuesta inmunológica de la muestra estudiada ante estos virus. Las muestras procedieron de la serorraquioteca del Laboratorio Central de Líquido Cefalorraquídeo (LABCEL) de La Habana, Cuba.
Pacientes y muestras
Se trabajó con una muestra intencional de 23 pacientes pediátricos diagnosticados con meningoencefalitis viral aguda.
Se tomaron muestras simultáneas de suero, por venopuntura y de LCR, por punción lumbar en el debut de los síntomas neurológicos para análisis de rutina, previo consentimiento informado, en los centros de asistencia que tributan a LABCEL. Estas muestras de suero y LCR fueron enviadas a LABCEL para análisis neuroinmunológicos especiales, el remanente se almacenó y rotuló en alícuotas de 500 µL a -80 °C anónimamente, acorde al protocolo establecido en este centro, que se reservan conservadas para futuras investigaciones.
La toma de muestras se realizó bajo el principio ético de no causar daño innecesario, no repitiendo punciones lumbares ni venopunción con fines exclusivos para esta investigación.
Criterios de inclusión: muestras de LCR en existencia en LABCEL desde 2015 hasta 2018; integridad y completamiento de los datos; pacientes menores de 19 años con diagnóstico de meningoencefalitis viral aguda, con síntesis intratecal de IgG y vacunados con PRS.
Criterio de exclusión: Muestras en cantidades insuficientes para las técnicas de determinación, pacientes inmunocomprometidos y pacientes con tratamiento inmunosupresor o inmunomodulador.
Aspectos éticos
Esta investigación respeta los principios éticos de las investigaciones de acuerdo con la Declaración de Helsinki 2013 para estudios en sujetos humanos. Fue aprobada por el Comité de Ética de la Investigación de la Facultad de Ciencias Médicas Miguel Enríquez.
Operacionalización de las variables
Edad del paciente: Número de años que refleja la tarjeta de menor del paciente enfermo, de acuerdo con la fecha de nacimiento. Cuantitativa discreta.
Año de vacunación: El año en el cual fue vacunado el niño, con la vacuna PRS. Cuantitativa discreta.
Tiempo de la respuesta: Número en meses desde que fue vacunado (PRS) hasta que se le realizó la punción lumbar. Cuantitativa discreta.
Concentración de IgG y albúmina. Niveles en suero y LCR de ambas proteínas. Cuantitativa continua.
Q Alb: Es el cociente obtenido de la división entre la concentración de albúmina en LCR y en suero. Cuantitativa continua.
Q IgG: Es el cociente obtenido de la división entre la concentración de IgG en LCR y en suero. Cuantitativa continua.
Niveles de anticuerpos IgG anti-parotiditis en suero (U). Cuantitativa continua.
Niveles de anticuerpos IgG anti-parotiditis en LCR (U). Cuantitativa continua.
Niveles de anticuerpos IgG anti-rubeola en suero (U). Cuantitativa continua.
Niveles de anticuerpos IgG anti-rubeolas en LCR (U). Cuantitativa continua.
Niveles de anticuerpos IgG anti-sarampión en suero (U). Cuantitativa continua.
Niveles de anticuerpos IgG anti-sarampión en LCR (U). Cuantitativa continua.
Índice de anticuerpo (IA). Cálculo que se realizó para determinar de forma más sensible y cuantitativa la síntesis incrementada intratecal de un anticuerpo específico. Cuantitativa continua.
Métodos
Se determinaron los niveles de anticuerpos contra los virus de la parotiditis, la rubeola y el sarampión por ensayo inmunoenzimático tipo ELISA de la marca Enzygnost de la firma Siemens (Marburg).
Modificaciones al método original: Se siguieron todas las indicaciones del fabricante aunque se aumentaron el número de réplicas de cada muestra a cuatro y no se realizaron los cálculos para la transformación de unidades de densidad óptica en título porque se prefiere una magnitud continua y no una cuantificación por titulaciones seriadas como ocurre en la práctica microbiológica de rutina.
Índice de anticuerpos específicos
Para detectar de forma más sensible y cuantitativa la síntesis intratecal de los anticuerpos IgG anti-parotiditis, anti-rubeola y anti-sarampión se realiza el cálculo de índice de anticuerpo (IA) o índice de anticuerpo específico. Este índice es criterio fehaciente que permite afirmar sin lugar a dudas si los responsables del proceso inflamatorio del SNC son los anticuerpos específicos del agente etiológico sospechado o confirmado y además permite evaluar si estos niveles de anticuerpos específicos en el LCR son significativos para poder dilucidar su rol en el proceso neurológico investigado o ver el tenor de estos anticuerpos de memoria en una población dada.16
Los valores de anticuerpos anti-parotiditis, anti-rubeola y anti-sarampión se expresan en densidad óptica y se hicieron equivalentes a unidades (U). No se realiza la conversión a título u otra expresión porque se trabaja con las razones de Reiber LCR/suero que son adimensionales.1
Para poder detectar de forma más sensible y cuantitativa la síntesis incrementada de los anticuerpos IgG anti-parotiditis, anti-rubeola y anti-sarampión se realizó el cálculo del IA o índice de anticuerpo específico a partir de la razón de anticuerpo IgG específico LCR/suero y su relación a la razón IgG(Q IgG) = IgG LCR/suero). La evaluación del IA se realizó a través de la fórmula:1
IA = Q específico / Q IgG = (ULCR /U suero) / (IgG LCR /IgG suero)
Los anticuerpos anti-parotiditis, anti-rubeola y anti-sarampión en suero y LCR expresados en unidades (U) como ya se ha explicado se relacionaron con la Q IgG.
IA = Q específico/Q IgG = (ULCR /U suero) / (IgG LCR /IgG suero)
Si el IA es mayor o igual que 1,5 indica síntesis de anticuerpos específicos local. Esta fórmula es muy sensible cuando el método utilizado para cuantificar los anticuerpos específicos se realizan por ELISA, pero pudiera dar resultados falsos negativos ya que el denominador es muy grande, dado que la respuesta es poliespecífica y en el denominador se evalúa IgG total.15,16
Para solucionar esto, se empleó el Reibergrama o gráfica de las razones de Reiber. Así, la Q IgG resultó mayor que la Q lim IgG, donde Q lim es el valor superior límite entre la proporción de IgG sintetizada en el LCR y está dada por la fórmula siguiente, que se correspondió con la línea hiperbólica más gruesa del Reibergrama:1
Como la Q IgG fue mayor que la Q lim, el punto quedó por encima de la curva más gruesa y al calcular el IA se sustituyó la Q IgG por la Q lim evitando falsos negativos.
El IA se calculó de la siguiente manera, ahora tomando en cuenta la síntesis intratecal de IgG en los casos donde se produce un proceso neuroinflamatorio:
IA = Q específico/ Q IgG (Q IgG < Q lim IgG)
IA = Q específico/Q lim IgG (Q IgG > Q lim IgG)
Análisis Estadístico
Se realizó un test de Kolgomorov-Smirnov para conocer si las variables en estudio seguían una distribución normal. En los casos en que no se observó la normalidad se procedió a transformar los valores en logaritmos naturales en base 10 para obtener una distribución normal de los resultados.
Se realizó un test de correlación de Spearman de las unidades de anticuerpos anti-parotiditis, anti-rubeola y anti-sarampión por el método sugerido por el fabricante para poder comprobar la justeza de trabajar directamente con las unidades seleccionadas en este estudio. Además, se le realizó correlación a U anti-parotiditis, anti-rubeola y anti-sarampión en suero y LCR, IA IgG anti-parotiditis, anti-rubeola y anti-sarampión con las variables tiempo respuesta, año vacunación y edad para evaluar la respuesta inmune específica intratecal y su relación con estas variables de interés.
Se le realizó recta de regresión a U anti-parotiditis, anti-rubeola y anti-sarampión en suero y LCR, IA IgG anti-parotiditis, anti-rubeola y anti-sarampión con las variables: tiempo respuesta, año vacunación y edad. Se utilizó programa MedCalc versión 13.1, producido por MedCalc Software (Mariakerke, Bélgica).
Resultados
De la muestra estudiada, todos los pacientes con meningoencefalitis aguda presentaron proceso neuroinflamatorio comprobado con la identificación de síntesis intratecal de IgG en todos los casos (Tabla 1). Del total de pacientes estudiados 8 de ellos cursaron con disfunción de la barrera sangre/LCR dado por un aumento de la Q Albúmina en relación a la esperada para la edad.
Al realizar el cálculo del índice de anticuerpos se pudo demostrar que cada paciente presentó IA específico mayor o igual a 1,5 como respuesta a cada agente viral evaluado en este estudio (Tabla 1).
Tabla 1 Valores de Q Alb, Q IgG, FI, Q lim e IA por virus.
| ID | Q Alb (10-3) | Q IgG (10-3) | Ql im (10-3) | FI (%) | IA anti-parotiditis | IA anti-rubeola | IA anti-sarampión |
|---|---|---|---|---|---|---|---|
| 1 | 0,8 | 1,7 | 0,69 | 60,4 | 7,33 | 7,24 | 6,52 |
| 2 | 3,8 | 4,4 | 2,53 | 42,5 | 7,73 | 9,24 | 7,12 |
| 3 | 1,4 | 1,7 | 0,94 | 45,7 | 6,52 | 13,06 | 3,34 |
| 4 | 0,2 | 1,4 | 0,58 | 59,6 | 9,62 | 5,64 | 3,47 |
| 5 | 1,4 | 8,2 | 0,91 | 89,0 | 14,84 | 44,5 | 1,53 |
| 6 | 10,6 | 21,0 | 8,42 | 59,9 | 30,5 | 9,34 | 1,51 |
| 7 | 5,9 | 54,6 | 4,22 | 92,3 | 10,04 | 4,80 | 7,88 |
| 8 | 7,7 | 9,2 | 5,83 | 36,3 | 1,87 | 5,67 | 3,28 |
| 9 | 2,2 | 1,8 | 1,37 | 23,1 | 7,27 | 10,92 | 2,37 |
| 10 | 2,8 | 5,0 | 1,78 | 64,6 | 5,01 | 1,53 | 1,59 |
| 11 | 0,4 | 3,5 | 0,61 | 82,4 | 1,67 | 1,57 | 3,63 |
| 12 | 9,7 | 7,9 | 7,64 | 3,2 | 4,14 | 2,28 | 1,64 |
| 13 | 5,6 | 4,6 | 4,0 | 13,7 | 2,18 | 6,90 | 1,55 |
| 14 | 9,2 | 5,2 | 2,01 | 61,6 | 3,70 | 8,43 | 4,45 |
| 15 | 3,6 | 4,1 | 239 | 42,1 | 10,2 | 6,89 | 2,58 |
| 16 | 3,4 | 10,0 | 2,23 | 77,8 | 6,89 | 7,78 | 5,10 |
| 17 | 0,1 | 3,6 | 0,58 | 83,8 | 7,95 | 6,58 | 5,33 |
| 18 | 4,4 | 7,2 | 2,94 | 59,0 | 4,98 | 2,19 | 5,78 |
| 19 | 5,8 | 5,8 | 4,19 | 27,2 | 1,56 | 4,62 | 2,60 |
| 20 | 2,8 | 5,0 | 1,78 | 64,7 | 1,67 | 3,88 | 4,89 |
| 21 | 7,5 | 6,0 | 5,66 | 5,7 | 2,11 | 1,89 | 2,19 |
| 22 | 6,8 | 5,0 | 5,02 | 0,3 | 2,9 | 9,6 | 9,58 |
| 23 | 0,4 | 3,1 | 0,6 | 80,4 | 3,07 | 8,22 | 8,70 |
Q Alb: Q albúmina, FI: fracción intratecal de IgG y Q lim: Q límite.
Según la estadística descriptiva aplicada a las variables en estudio se constató que la media de los valores de anticuerpos específicos anti-rubeola, tanto en suero como en LCR fue menor que para los otros virus. Los valores medios de anticuerpos anti-parotiditis fueron mayores que en los tres agentes virales evaluados (Tabla 2).
La media del índice de anticuerpos anti-sarampión fue mayor que los otros anticuerpos lo cual contrasta con las cifras tan pequeñas para el caso de la rubeola y en menor medida para el virus de la parotiditis y la rubeola.
Tabla 2 Estadística descriptiva de las variables en estudio.
| Variables | Media Aritmética | Desviación Estándar | Normalidad* |
|---|---|---|---|
| Ac IgG anti parotiditis LCR(U) | 9,5217 | 20,84 | Rechaza la normalidad (p=0,002) |
| Ac IgG anti parotiditis suero(U) | 422,6957 | 792,9 | Rechaza la normalidad (p=0,018) |
| Ac IgG anti rubeola LCR (U) | 0,0266 | 0,069 | Rechaza la normalidad (p<0,001) |
| Ac IgG anti rubeola suero (U) | 0,4922 | 0,3811 | Acepta la normalidad (p=0,563) |
| AcIgG anti sarampión LCR (U) | 97,5652 | 89,65 | Acepta la normalidad (p=0,268) |
| Ac IgG anti sarampión suero (U) | 66,0870 | 71,81 | Acepta la normalidad (p=0,119) |
| Edad | 7,5217 | 3,95 | Acepta la normalidad (p=0,336) |
| IA IgG anti parotiditis | 42,7383 | 70,80 | Rechaza la normalidad (p=0,010) |
| IA IgG anti rubeola | 14,2030 | 16,87 | Acepta la normalidad (p=0,053) |
| IA IgG anti sarampión | 416,2174 | 249,15 | Acepta la normalidad (p=0,64) |
| Q Alb | 6,2217 | 10,93 | Rechaza la normalidad (p=0,019) |
| QIgG | 5,7565 | 4,286 | Acepta la normalidad (p=0,459) |
| Tiempo Respuesta | 84,9565 | 46,67 | Acepta la normalidad (p=0,218) |
Ac: anticuerpos * Test de Kolmogorov-Smirnov
Las variables cuyos valores rechazaban la normalidad se convirtieron en logaritmo de base 10 y se buscó la recta de mejor ajuste. En tal sentido, se pudo demostrar que el aumento de los anticuerpos específicos anti-sarampión en LCR depende del aumento de los anticuerpos específicos anti-sarampión en suero (Fig. 1).
Cabe señalar que un aumento del IA anti-parotiditis se corresponde con una disminución de la edad y tiempo de respuesta de forma significativa (Tabla 3).
Tabla 3 Correlación entre las variables de estudio.
| X | Y | r | p |
|---|---|---|---|
| Ac IgG anti-parotiditis U LCR | Ac anti-parotiditis suero U | 0,324 | 0,1335 |
| Ac Anti-rubeola U LCR | Ac Anti-rubeola suero U | 0,435 | 0,9824 |
| Ac anti-sarampión U LCR | Ac anti-sarampión suero U | 0,7616 | 0,0001* |
| IA anti-parotiditis | Edad | -0,4293 | 0,00409* |
| IA anti-rubeola | Edad | 0,4034 | 0,0563 |
| IA anti-sarampión | Edad | 0,2444 | 0,2611 |
| IA anti-parotiditis | Tiempo respuesta | -0,4227 | 0,0419* |
| IA anti-rubeola | Tiempo respuesta | 0,2720 | 0,2092 |
| IA anti-sarampión | Tiempo respuesta | 0,3006 | 0,1634 |
| Año vacunación | IA anti-parotiditis | 0,36286 | 0,5531 |
| Año vacunación | IA anti-rubeola | 0,2646 | 0,2224 |
| Año vacunación | IA anti-sarampión | 0,2760 | 0,2024 |
Ac: anticuerpos *Significativo

Fig. 1 Recta de regresión entre los niveles de IgG anti sarampión en suero y de IgG anti sarampión en LCR. U anticuerpos IgG anti sarampión en LCR = 0,038+0,8896 U Ac IgG anti sarampión suero. Razón F =21,66 p< 0,001.
Con relación al IA anti-parotiditis, se constató que según aumenta la edad de los pacientes, el IA específicos disminuye (Fig. 2).
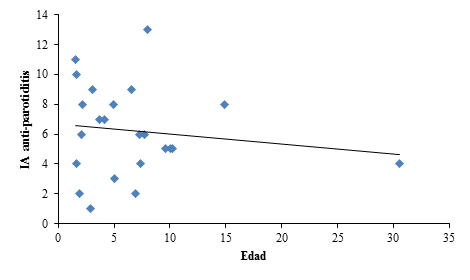
Fig. 2 Recta de regresión entre el IA IgG anti-parotiditis y la edad. IA anti-parotiditis=8,41-0,27 (Edad). Razón F = 0,38 p=0,540.
De igual manera que en la regresión anterior había una disminución con la edad del paciente, el IA anti parotiditis con la variable tiempo de respuesta tiene similar comportamiento (Fig. 3).
Discusión
La respuesta poliespecífica es una característica de la respuesta inmune en el sistema nervioso central y aunque puede ser observada también en la periferia, en el primero reviste importancia porque en el líquido cefalorraquídeo no existen todos los mecanismos reguladores que eliminan la activación de los clones por apoptosis y ayuda a preservar los niveles de anticuerpos contra todos los gérmenes que el organismo ha enfrentado a través de la inmunidad activa como pasiva.
El empleo del índice de anticuerpo especifico, permite conocer el nivel de anticuerpos intratecal en la población o en un individuo y su capacidad de respuesta neuroinmunológica para así identificar posibles huéspedes inmunodeficientes y también con enfermedades de naturaleza autoinmune vinculado al sistema nervioso y poder acometer medidas necesarias para mantener el control de estas enfermedades en el caso de las enfermedades crónicas o actuar en el nivel de organización de los sistema nacionales de salud cuando se evidencie una respuesta inapropiada de la población frente a antígenos vacunales como es el caso de esta evaluación.15,16
Se conoce que, una vez incorporada la vacuna viva atenuada PRS en los programas de inmunización, se produce una disminución en la incidencia de estas enfermedades; sin embargo, las mismas continúan siendo una importante causa de morbilidad y mortalidad en algunos países, produciéndose brotes por el acúmulo de susceptibles y la importación de los virus desde zonas endémicas.18
La vacunación cambió la dinámica epidemiológica de las enfermedades infecciosas, trayendo como resultado una limitada persistencia de la inmunidad, además, la evidencia clínica mostró no ser suficiente para la confirmación, por lo que los laboratorios, comenzaron a jugar un papel importante en la evaluación de la incidencia y severidad de estas enfermedades, así como en el monitoreo y el conocimiento del perfil de susceptibilidad de la población.2,8,9,18-20
Junto a los anticuerpos específicos contra el agente causal, la fracción dominante de inmunoglobulinas es típicamente a expensas de la IgG.12 Para evaluar las condiciones neuroinmunológicas de los pacientes fue necesario la cuantificación de IgG y albúmina en suero y LCR. Los valores absolutos tanto de IgG como de albúmina no tienen importancia clínica en Neuroinmunología por sí mismos, porque el interés fundamental estriba en la relación que se establece entre el LCR y el suero (Q LCR/suero).12
La muestra estudiada proviene de pacientes pediátricos con meningoencefalitis viral aguda diferente a los virus que componen la vacuna PRS. La gran mayoría cursaron la enfermedad con niveles normales de IgG. Por otro lado, los niveles de albúmina sérica resultaron estar entre el rango de referencia en la mayor parte de los casos.
En pacientes pediátricos, la dinámica de la respuesta inmune intratecal humoral, dependiente del agente biológico involucrado, se adelanta en muchas ocasiones al patrón con respecto al adulto.18,19
Este estudio evidencia síntesis intratecal de IgG en los 23 pacientes, lo cual es indicativo de un proceso inflamatorio en el SNC.1,12
En otras entidades productoras de meningoencefalitis virales agudas, como la causada por virus Echo 6 se produce síntesis predominante de IgG que recuerda lo que sucede evolutivamente en las meningoencefalitis víricas en adultos, producidas por herpes simple, o en la fase aguda de las meningoencefalitis por herpes zoster. En un brote de meningoencefalitis aguda por Coxsackie B5 en pacientes pediátricos, en la fase aguda se encontró durante la punción diagnóstica, una respuesta de IgG ligeramente predominante.12
La Q Alb es ampliamente aceptada como indicador de la barrera sangre/LCR, y es una medida de la velocidad de flujo del LCR. Un incremento de la albúmina en LCR siempre se debe a una disfunción de la barrera sangre- LCR pues la albumina tiene síntesis exclusiva en el hígado y toda la encontrada en LCR es resultado del paso de la sangre al LCR.1,12
Se ha conocido que existe un marcado predominio de disfunción de la barrera sangre-LCR, en las meningoencefalitis en sentido general.12,14 Sin embargo, en la muestra estudiada no constituyó un elemento de interés a señalar, ya que solo se observó en 5 pacientes.
En la literatura suele encontrarse la explicación de este fenómeno, al plantear que en los niños el sistema de barreras está inmaduro y por tanto, esto permite el paso menos restringido de células y moléculas. Sin embargo, la teoría de la difusión molecular/velocidad de flujo del LCR plantea que desde la etapa prenatal las barreras están plenamente definidas. Esta entrada de células procedentes del torrente sanguíneo al espacio subaracnoideo está determinada en lo fundamental por la inmadurez de las vellosidades aracnoideas durante el desarrollo embrionario y en los primeros meses de vida.14
Este comportamiento diferencial en cuanto a entrada celular entre el adulto y el niño se mantiene e incrementa en los procesos inflamatorios infecciosos, por lo que la entrada de un mayor número de linfocitos B activados en menor tiempo permite una síntesis intratecal de inmunoglobulinas más temprana que la observada en el adulto, acompañada de una velocidad de flujo del LCR menor en el niño, sobre todo en las edades más tempranas. Esto se evidencia porque poseen una Q Alb muy elevada y es en esos momentos de la vida, particularmente notable la incidencia de infecciones bacterianas y virales en el SNC.1,5,12
Una Q Alb elevada, de acuerdo con la teoría que apoya este trabajo, significa una velocidad de flujo del LCR menor y un aumento de moléculas (y células) que pasan de la sangre al LCR.1,12
En relación al IA, se constata que existió una respuesta poliespecífica a los tres virus estudiados, ya que todos los casos mostraron valores superiores a 1,5. Esto ni significa que los pacientes estudiados tengan una infección viral actual contra los virus que protege la PRS sino que pueden servir para evaluar la protección de la población estudiada frente a esos virus.1,12,14,16
En infecciones agudas, la presencia de síntesis intratecal de anticuerpos específicos contra herpes zoster, herpes simple o su combinación, puede ser relevante desde el punto de vista diagnóstico. Por ejemplo, en la parálisis facial causada por el virus de la varicela-zoster se ha hallado un incremento en el IA contra este virus, que puede observarse desde la primera punción lumbar diagnóstica.1,12,15 En todos estos casos, el IA es de una sensibilidad clínica mayor que la IgG oligoclonal.14,17
Los resultados arrojan una correlación significativa entre los valores de anticuerpos anti-sarampión en suero y en LCR. Esto puede interpretarse que los anticuerpos de clase IgG anti-sarampión difunden de la sangre al LCR y sus niveles en este último son a expensas de forma significativa producto de la fracción sérica que pasa a este segundo compartimento. Esta evidencia no pudo ser contrastada al no existir evidencias en la literatura consultada. Sin embargo, no ocurrió de igual forma con la rubeola y la parotiditis, que aunque no existió una correlación positiva entre los niveles de anticuerpos IgG en LCR y suero, si se evidencia un incremento lineal entre ellos.
El IA anti-parotiditis disminuye con la edad y de forma significativa con el tiempo de respuesta. Este decrecimiento significativo constituye un signo de alarma desde el punto de vista epidemiológico que pudiera interpretarse como que a medida que aumenta la edad del paciente, la fecha de su vacunación se va alejando del momento actual y por tanto los anticuerpos protectores de memoria van decreciendo. Esto apoya lo encontrado por otros investigadores18,20 donde incluso llegan a sugerir la necesidad de una segunda reactivación frente a este virus. Esto mismo se observa entre el tiempo que media en cuanto el paciente fue vacunado con el momento en que se le realiza la punción en pleno proceso neuroinflamatorio, lo que evidencia igualmente que el comportamiento para este virus difiere del comportamiento de los otros dos componentes de la vacuna triple viral.
Muchos autores han señalado que la capacidad inmunogénica del preparado vacunal para este virus resulta insuficiente y en otros casos piensan que la cadena de frío puede ser un elemento a tomar en cuenta en cuanto a la labilidad del inmunógeno específico de este preparado vacunal frente al virus de la parotiditis.20
En Cuba se emplearon diferentes vacunas con distintas cepas del virus de la parotiditis, dentro de ellas la Leningrad-Zagreb y la Urabe AM9, siendo esta última la que se utiliza actualmente. Se reportó que esta cepa, a pesar de su eficacia e inmunogenicidad, es capaz de causar meningitis aséptica en algunas personas vacunadas, pero se plantea, que la vacunación produce una disminución considerable de esta complicación y si llega a producirse, la recuperación no deja secuelas, mientras tanto, después de la infección natural, la meningitis se produce en el 10% de los niños. Por las razones anteriores se sustituyó la cepa en muchos países; no obstante, continúa formando parte de la vacuna que se emplea en América Latina, debido a que su costo es inferior a la que contiene la cepa Jeryl Lynn o la Rubini.13,18,20
Otra causa del surgimiento de los brotes de parotiditis a nivel mundial, es la existencia de 13 genotipos del virus, que representan entre si una neutralización cruzada incompleta y sólo están representados en un pequeño número en las vacunas actuales. Estos genotipos en muchas ocasiones se encuentran distantes filogenéticamente de los que producen los brotes.2,20
Se plantea que, diferentes causas dieron lugar a la epidemia de parotiditis en la población joven en diferentes países del mundo, dentro de ellas, la disminución en el nivel de los anticuerpos protectores o de memoria debido a que gran parte de estos individuos recibieron una sola dosis de la vacuna al año de edad, el estilo de vida de los jóvenes, los cuales realizan múltiples actividades sociales, la vía de transmisión respiratoria y la forma subclínica de la enfermedad, facilitando la diseminación e interfiriendo en su control. También se expresó que cualquier alteración en la cadena de frío pudo provocar cambios significativos en la potencia de la vacuna, con la consiguiente disminución en la respuesta inmune, así como la demora en su uso después de la reconstitución (más de 30 min) y la exposición a la luz, lo que pudiera ocasionar la inactivación del virus.
En Cuba se comenzó a observar a partir del año 2004, un incremento en el número de personas con parotiditis, similar a lo reportado en diferentes países.5,12 Se estima que, aplicar una segunda dosis, aún con una alta cobertura de vacunación, no es suficiente para crear una inmunidad en la población que evite la aparición de brotes, ya que la inmunidad inducida por algunas cepas vacunales, en el caso particular de la parotiditis, pueden no ser efectivas frente a las cepas circulantes, debido a cambios en los epítopes neutralizantes.2
Se planteó que el aumento de la incidencia de la parotiditis a nivel mundial, estaba relacionado con la cepa empleada en la vacuna, la cual presenta un 80% de efectividad, quedando después de aplicada una sola dosis, un 20% de individuos vulnerables de padecer la enfermedad y un 5% después de recibir dos dosis.2
En la literatura se plantea, que la vacunación contra la PRS confiere una inmunidad para toda la vida;2 sin embargo, muchos de los casos positivos han recibido una o dos dosis de la misma y otros pudieron ser infectados naturalmente con el virus.
Se constata la presencia de una respuesta poliespecífica en el sistema nervioso central a los tres virus de acuerdo al índice de anticuerpos, sugiriendo síntesis intratecal de estos anticuerpos.
Los resultados obtenidos en este estudio sugieren una susceptibilidad a padecer parotiditis en la población infantil estudiada dada por un acortamiento del tiempo de respuesta de los anticuerpos de tipo IgG específicos anti-parotiditis en relación a la edad de vacunación.
















