Introducción
Mycobacterium tuberculosis (Mtb) es el agente causal de la tuberculosis (TB) pulmonar, enfermedad que es considerada un problema de salud pública a nivel mundial. Según datos de la Organización Mundial de la Salud (OMS) en el año 2018, la TB estuvo entre las 10 primeras causas de mortalidad en el mundo, produciendo alrededor de 10 millones de personas enfermas y 1,5 millones de muertes.1 La TB se transmite a través del contacto directo persona a persona, principalmente por la vía aérea, y se produce cuando un individuo con la enfermedad en su forma activa expele aerosoles cargados con la micobacteria que son inhalados por otro individuo. De las personas que entran en contacto con Mtb, solo un 10 a 30% se infectan, y de ellos, 90% de los individuos inmunocompetentes entran en el periodo de latencia, que puede durar décadas, controlando la infección primaria y la profileración del patógeno a través de la formación de granulomas; entre un 5 a 10%, la infección evoluciona a su forma activa por fallas en el sistema inmunológico del hospedero.2,3,4
Existen evidencias experimentales que han propuesto que Mtb no posee los factores de virulencia tradicionales que se describen en otros patógenos bacterianos, por lo que la capacidad de Mtb de resistir al ambiente hostil que se genera en el interior del macrófago, persistir en los granulomas, evadir los mecanismos efectores de la respuesta inmune (RI), así como los posibles genes y factores de virulencia que intervienen, han sido motivo de muchas investigaciones que se basan en el conocimiento de la secuencia del genoma de Mtb y en el uso de mutaciones en los genes de Mtb para infectar macrófagos y modelos animales.5
La importancia de estudiar los genes que participan en la virulencia de Mtb, permite conocer los posibles mecanismos que utiliza la bacteria para evadir y sobrevivir a los mecanismos y elementos efectores de la RI, adaptarse y persistir en el hospedero por largos periodos de tiempo.6 Por otra parte, el conocimiento sobre los genes de virulencia estimulará el descubrimiento de nuevos blancos para el desarrollo de drogas antituberculosas, nuevas vacunas y métodos de diagnóstico de la TB, con el propósito de aportar nuevas estrategias para el control de la enfermedad.7 En consecuencia, el objetivo de la publicación es presentar una revisión de las investigaciones que han caracterizado los genes o factores de virulencia de Mtb que contribuyen a su supervivencia en los macrófagos y que participan en la evasión de la RI.
Estrategia de búsqueda
Se realizó una revisión de los principales artículos de investigación relacionados con la virulencia de Mtb y los determinantes de virulencia que contribuyen a la evasión de la RI. La búsqueda se llevó a cabo en PubMed (https://www.ncbi.nlm.nih.gov/pubmed/), y en SciELO (https://scielo.org/es/). Se utilizaron como palabras clave “Mycobacterium tuberculosis and virulence”, “Mycobacterium tuberculosis and immune response”, “Mycobacterium tuberculosis and escape immune response”, “Mycobacterium tuberculosis and macrophages”, “apoptosis”, “autophagy”, “adaptative immune response”, “necrosis”. La revisión incluyó las investigaciones más relevantes en los años 2000 al 2019. La base de datos de PubMed arrojó un total de 5377 artículos de virulencia entre el 2000 al 2019, y en los últimos 10 años (2009-2019) un total de 3421 publicaciones. En el caso de SciELO se localizaron un total de 24 publicaciones.
Finalmente, se seleccionaron aquellos artículos en los que se demostraron los genes de virulencia que intervienen directamente en los procesos que se producen en los macrófagos, RI innata y adaptativa. Además, se incluyeron algunas investigaciones publicadas antes del 2010 que se consideraron relevantes. En el presente trabajo se incluyeron 37 referencias del último decenio (2009-2019), 16 referencias del 2000 al 2008 y tres referencias previas al año 2000.
Conociendo el Genoma de Mtb
El descubrimiento de la secuencia del genoma de Mtb,8 ha sido una herramienta fundamental en las investigaciones relacionadas con la virulencia. El genoma de la cepa H37Rv de Mtb codifica aproximadamente 4000 genes, entre los que se incluyen aquellos que codifican enzimas relacionadas con el metabolismo de los ácidos grasos, la familia de proteínas PE y PPE, trece factores sigma pertenecientes a la clase σ70, genes que codifican proteínas reguladoras de los tipos represor/activador transcripcional, genes relacionados con los sistemas de dos componentes, los sistemas serina-treonina quinasas (STPK por sus siglas en inglés) y otros genes reguladores.8
Respuesta inmune contra Mtb
Cuando Mtb es inhalado se encuentra con una primera línea de defensa en el pulmón constituida por las células epiteliales de las vías respiratorias, y además participan otra serie de elementos celulares, entre ellos, las células fagocíticas como neutrófilos, monocitos, células dendríticas, los macrófagos, y las células NK (asesinas naturales o natural killer por sus siglas en inglés) (Fig. 1).4,5,9
Para que Mtb pueda ingresar al interior de los macrófagos, debe interactuar con una serie de receptores de superficie como el receptor de manosa (MR), los receptores tipo toll (TLR-2, TLR-4 y TLR-9), las colectinas, glicolípidos, lipoproteínas y carbohidratos.4,5,9
Los macrófagos tienen un papel protagónico en la defensa del hospedero contra Mtb, porque además de constituir la primera barrera de defensa contra la micobacteria, en su interior, luego de la fagocitosis, se activan diversos mecanismos y procesos para contener la infección: la fusión fagosoma-lisosoma, la acidificación del fagosoma, la producción de intermediarios de oxígeno reactivo (ROI), citoquinas, la acción de enzimas lisosomales, péptidos tóxicos, intermediarios de nitrógeno reactivo (RNI), sintasa de óxido nítrico inducible (iNOS), óxido nítrico, glutatión y S-nitrosoglutatión.10,11 Adicionalmente, en el interior de los macrófagos se producen otros procesos celulares como la autofagia, la apoptosis y los inflamosomas que contribuyen a la eliminación de la micobacteria (Fig. 1).4,5,9
Además, en la RI se activan las citoquinas proinflamatorias (IL-12, TNF-α, IFNγ, IL-1β, IL-6, IL-18), anti-inflamatorias (TGF-β, IL-10 e IL-4) y factores quimiotácticos (RANTES, MCP-1, MIP1α e IL-8).11,12 Por otra parte, se activa una RI adaptativa con la presentación de antígenos de Mtb, por intermedio de las moléculas del complejo mayor de histocompatibilidad (MHC), activando a linfocitos T CD4+ y CD8+ (Fig. 1).11,12).
Por último, se forman los granulomas, compuestos por linfocitos T, macrófagos y células gigantes, donde la micobacteria se encuentra en un ambiente con una baja tensión de oxígeno, restricción de nutrientes y ácidos grasos y disminución de pH, lo que inhibe la multiplicación bacteriana; sin embargo, Mtb se mantiene viable durante la infección latente.12,13
Estudios de virulencia de Mtb
Un gen es clasificado como un factor de virulencia cuando su ausencia atenúe la virulencia del microorganismo en un modelo in vivo, y su complementación le devuelva su virulencia.11 En consecuencia, los estudios de virulencia de Mtb se basan en inducir mutaciones, deleciones o modificaciones genéticas de un gen en una cepa de Mtb, y posteriormente, infectar macrófagos, monocitos, células dendríticas o modelos animales para evaluar el efecto y las consecuencias en el desarrollo y en la progresión de la enfermedad.5,14
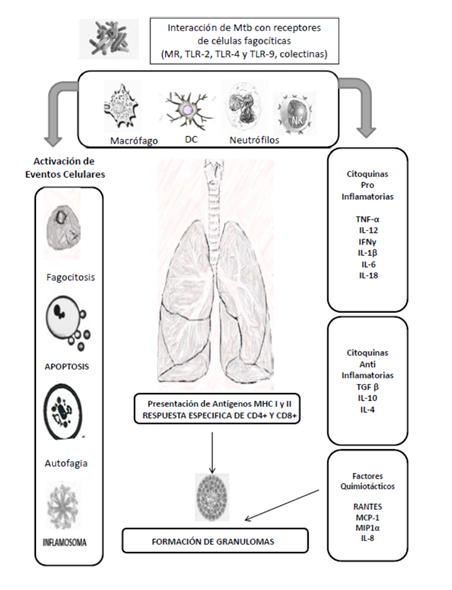
Fig. 1 Respuesta Inmune contra Mycobacterium tuberculosis en pulmón. MR: Receptor de Manosa. TLR: Receptores toll. DC: Células Dendríticas. NK: Células asesinas naturales. TNF: Factor de Necrosis Tumoral. IL: Interleuquina. IFN: Interferón.
Los métodos de modificación genética de Mtb empleados en estos estudios han sido la interrupción de genes, la complementación, RNAs anti-sentido, la fusión de genes reporteros, los métodos de hibridización y los microarrays.5,14
Los macrófagos utilizados en los estudios de virulencia provienen de ratones o humanos, de cultivos primarios o líneas celulares inmortalizadas, como la línea J774, las células MHS y las THP-1.5,14 Los modelos animales utilizados son los conejos, los cobayos, los primates no humanos y los ratones. Sin embargo, el ratón es el que más se emplea en los estudios experimentales, específicamente las cepas BALB/c, SCID (ratones con inmunodeficiencia combinada severa por sus siglas en inglés), CJ57/c, CBA/J. Asimismo, las cepas de Mtb que se utilizan con mayor frecuencia son CDC 1551, H37Rv, HN878 y NHN5.5,14
Virulencia y evasión de la respuesta inmune
Las investigaciones realizadas con el paso del tiempo han demostrado que Mtb posee una habilidad exclusiva para evadir la RI, que consiste en inhibir la fusión fagosoma-lisosoma, sobrevivir al estrés oxidativo, generar efecto antiapoptótico, evadir la autofagia, interferir en las rutas de señalización celular e influir en la activación de citoquinas pro y anti-inflamatorias, modular la RI adaptativa e inducir necrosis en macrófagos y polimorfonucleares.
1. Inhibición de la fusión y maduración fagosoma-lisosoma
Una de las primeras evidencias científicas que logró demostrar que Mtb es capaz de resistir la degradación lisosomal fue obtenida por Amstrong y Hart en 1971.15 Desde ese momento, existen muchas investigaciones que han descubierto que durante la inhibición de la fusión fagosoma-lisosoma intervienen diversos determinantes de virulencia (Fig. 2A).
Entre las estructuras de Mtb que alteran la fusión del fagosoma-lisosoma se encuentra lipoarabinomanano (LAM) recubierto de manosa, también conocido como ManLAM, que forma parte de la envoltura celular de Mtb.16 En ese sentido, Kang et al.,16 utilizaron líneas celulares de macrófagos humanos que expresaban MR, así como monocitos que carecían de MR, todas las células fueron infectadas con cepas de Mtb, y con el uso de microscopía electrónica y confocal, demostraron que ManLAM al interactuar con el MR en el macrófago inhibe la fusión fagosoma-lisosoma. Los resultados fueron confirmados, ya que lograron revertir la inhibición fagosoma-lisosoma al bloquear al receptor MR en el macrófago. Además de ManLAM, se ha demostrado la participación de otras moléculas unidas a LAM. Shukla et al.,17 propusieron que la lipoproteína LprG unida a LAM, aumenta la integridad de la pared celular de la micobacteria y controla la inhibición fagosoma-lisosoma.
El papel de la proteína quinasa G (PKnG), una serina-treonina-proteína-quinasa, secretada por Mtb en el fagosoma, fue descubierto por. Walburger et al.,18 quienes delecionaron el gen que codifica para la proteína en M. bovis (M. bovis ∆pknG) y compararon los efectos en la infección con macrófagos con una cepa silvestre. Los investigadores observaron que M. bovis ∆pknG perdió la capacidad de crecer en los macrófagos. Por otra parte, indujeron una mutación en PknGk181M en cepas de M. bovis y compararon con la cepa silvestre. La mutante fue transferida al lisosoma y no sobrevivió en el interior del macrófago, contrario al comportamiento de la cepa silvestre, en la que se evidenció su supervivencia en los macrófagos infectados, confirmando el papel de PknG en la inhibición de la fusión fagosoma-lisosoma.
Otro sistema involucrado es el SecA-2, cuya función es exportar proteínas requeridas para el crecimiento celular de la bacteria en el interior de los macrófagos.19 Sulivan et al.,19 demostraron que cepas de Mtb con el gen secA2 delecionado perdieron la capacidad de inhibir la maduración fagosoma-lisosoma cuando compararon con la cepa tipo silvestre H37Rv. Sin embargo, otros estudios de investigación sugieren que SecA-2 pareciera no actuar de manera aislada, sino en conjunto con otros elementos de Mtb. De hecho, Zulauf et al.,20) demostraron que el sistema SecA-2 interviene conjuntamente con PknG y SapM.
Relacionado con SapM, evidencias científicas previas habían confirmado que es indispensable para la interrupción de la maduración fagosoma-lisosoma y el crecimiento de Mtb en el tejido de cobayos.21 El grupo de Puri et al.,21 delecionaron el gen que codifica la proteína SapM de Mtb (Mtb ΔsapM) y observaron que la cepa perdió la capacidad de inhibir la fusión fagosoma-lisosoma, disminuyendo su crecimiento en macrófagos humanos THP1, y atenuando su crecimiento en pulmón y bazo de cobayos cuando compararon los efectos de la infección con una cepa salvaje.
Los resultados de los estudios de investigación aquí mostrados sugieren la participación de múltiples factores en la inhibición del fagosoma-lisosoma; además, pareciera existir una red de elementos efectores que deben trabajar interconectados.
2. Ruptura del fagosoma
Los beneficios principales de la ruptura del fagosoma para Mtb son su traslocación al citosol y el acceso a los nutrientes.22,23 El elemento responsable de la perforación o ruptura del fagosoma es un potente antígeno de células T, esencial para la virulencia de Mtb conocido como ESAT-6, que es secretado por el sistema de secreción ESX-1 (tipo IV) conjuntamente con CFP-10. El sistema de secreción ESX-1 se encuentra en la Región de Deleción 1 (RD1), presente exclusivamente en Mtb patógenos y ausente en las cepas de M. bovis BCG.24
Son muchos los estudios de investigación que han demostrado el papel de ESAT-6 en la virulencia de Mtb; sin embargo, uno de ellos, realizado por van der Wel et al.,25 utilizando criomicroscopía electrónica, demostró que Mtb y M. leprae se translocan desde el compartimiento fagolisosomal al citosol de células mieloides y es dependiente de ESAT-6 y CFP-10. Así mismo, el grupo de Simeone et al.,22 confirmó el papel de ESAT-6 en el proceso de translocación de Mtb del fagosoma al citosol. Estos autores estudiaron de manera exhaustiva el fenómeno, utilizando diversas estrategias experimentales basadas en estudios bioquímicos y de biología molecular. En ese sentido, uno de los estudios que demostró claramente el papel de ESAT-6 fue aquel en el que observaron que una cepa de Mtb tipo silvestre realizaba la translocación del fagosoma al citosol, mientras que no observaron la translocación en cepas de BCG. Sin embargo, la introducción de RD1 en BCG le confirió la capacidad de translocación al citosol,22 verificando el papel de RD1 y de ESAT-6 en el proceso. Por otra parte, observaron que la eliminación del C-terminal de ESAT-6, permitió confirmar que Mtb perdía la capacidad de translocación del fagosoma al citosol en macrófagos THP-1.22
3. Inhibición del estrés oxidativo generado en el macrófago
En el interior de los macrófagos, como parte de la RI, se generan una serie de radicales libres que están bajo el control de la oxidasa fagocítica e iNOS.9,26,27 La primera enzima reduce el oxígeno molecular a productos intermedios conocidos como ROI, mientras que la segunda, genera óxido nítrico, que combinado con peróxido o superóxido, produce RNI.9,26,27
Aunque se genera un ambiente hostil y altamente tóxico en el macrófago, Mtb sobrevive gracias a esa particular maquinaria que actúa como factores de virulencia contra el estrés oxidativo. De hecho, existen evidencias experimentales que han demostrado que elementos enzimáticos, factores transcripcionales y reguladores de la expresión de genes intervienen en la supervivencia de esta potente micobacteria (Fig. 2B).
La enzima KatG, codificada por el gen katG, posee actividad catalasa-peroxidasa, la deleción de katG en Mtb origina cepas atenuadas, mientras que la complementación del gen restituye su virulencia.26 Estos resultados fueron confirmados por Nieto et al.,28 quienes utilizaron cepas de Mtb con mutaciones en el gen katG, y constataron que, además del crecimiento atenuado, se produce reducción en los niveles de la actividad catalasa-peroxidasa en las cepas mutantes, afectando negativamente la supervivencia de Mtb al estrés oxidativo.
Existen otras enzimas como la Thiol peroxidasa (TpX) que catalizan la reducción de hiperperóxidos y peroxinítritos en Mtb. El grupo de Hu et al.,29 reportó que la cepa de Mtb con mutaciones en el gen tpx mostró ser susceptible al estrés oxidativo y RNI, con reducida actividad de peroxidasa, por lo tanto, de acuerdo a los resultados, TpX puede ser considerado otro elemento que protege a Mtb de la acción de ROI y RNI en el macrófago.
Los reguladores transcripcionales y los factores sigma, parecen jugar un papel importante en el control del estrés oxidativo que se genera en el macrófago durante la infección por Mtb. Uno de los mejores estudiados es PhoP/PhoR, un sistema de dos componentes (SDS) y regulador transcripcional que está asociado al metabolismo de fosfato de Mtb,30 además, participa en la virulencia de Mtb y posee la capacidad de regular la expresión de alrededor de 110 genes.31) De hecho, la caracterización genética del regulón PhoP y la comparación del transcriptoma y el proteoma de una cepa silvestre y una mutante de Mtb, permitió demostrar que PhoP regula positivamente aquellos genes requeridos para hipoxia, estrés oxidativo y disminuciones de pH entre otros.32
Otras investigaciones han propuesto que WhiB3, un regulador transcripcional de la familia de proteínas WhiB, actúa conjuntamente con el factor transcripcional sigma A, para ejercer el control transcripcional, detectar las señales redox, responder al estrés reductivo y mantener la homeostasis redox a través de la regulación del anabolismo de lípidos.33 Por su parte, Sharp et al.,34 demostraron que Sigma H participa en la expresión de un amplio número de genes relacionados con la respuesta al estrés, el equilibrio redox de la bacteria y la reparación del ADN.
Evidencias científicas han demostrado que la enzima PknG interviene en otros procesos diferentes a la inhibición de la fusión fagosoma-lisosoma. De acuerdo con las investigaciones de Cowley et al.,35 se observó que la mutación del gen pknG en una cepa de Mtb indujo atenuación durante la infección en ratones, lo que a criterio de los investigadores significa que PknG debe tener alguna función para subvertir el estrés a los ROI y RNI, y así proteger a Mtb contra el estrés oxidativo. Por el contrario, Mehak et al.,36 indicaron que la participación de PknG en el mantenimiento del equilibrio redox no ha sido dilucidado. Con base a las discrepancias presentadas entre ambos investigadores, serán necesarios otros estudios de investigación, con el propósito de demostrar, con mejores evidencias científicas, el papel de PknG en el control del estrés oxidativo en el macrófago.
4. Inhibición de la apoptosis
Los patógenos han desarrollado mecanismos para inhibir la apoptosis.27 En el caso de Mtb, se ha reportado que induce apoptosis cuando infecta las células del hospedero, pero también se ha observado que la severidad de la apoptosis está relacionada con su virulencia. En efecto, se ha demostrado que las cepas atenuadas de M. bovis BCG y la cepa H37Ra, inducen una apoptosis intensa en células THP-1, contrario a lo observado para cepas virulentas como H37Rv y M. bovis, que no indujeron una apoptosis severa en los macrófagos.37,38
Diversos estudios han demostrado la existencia de genes antiapoptóticos, muchos de ellos juegan un papel importante contra la actividad de ROI y RNI en el interior del macrófago, lo que permite inferir que posiblemente debe existir relación estrecha entre la inhibición de la apoptosis y el control del estrés oxidativo en el macrófago.
Entre los genes antiapoptóticos descritos se encuentran nuoG, katG, sodA/secA2, pknE y Rv3654c/Rv3655c,38,39 y se ha demostrado que su mutación o deleción indujeron una fuerte actividad apoptótica en macrófagos, mientras que durante la infección con cepas salvajes de Mtb se evidenció inhibición de la apoptosis (Fig. 2B).37,38,39
5. Inhibición de la autofagia
La autofagia es un proceso catabólico que se produce en las células eucariotas, donde se generan vacuolas de doble membrana en el citosol que se encargan de secuestrar moléculas, toxinas y restos de organelas que deben ser degradados para preservar a las células, y que puede activarse durante la infección por microorganismos patógenos.40
Las cepas virulentas de Mtb afectan la autofagia a nivel de la fusión del autofagosoma-lisosoma que depende de ESX-1 en las células dendríticas.41 De hecho, según las evidencias experimentales, se demostró que la capacidad de inhibir la autofagia se restableció por completo en cepas recombinantes BCG y Mtb H37Ra que expresaban el gen phoP y poseían el sistema de secreción ESX-1.41 La participación de ESX-1 a través de ESAT-6 y de PhoP en la inhibición de la autofagia fue confirmado por Chandra et al.,42 quienes observaron como la cepa virulenta H37Rv inhibió la autofagia a diferencia de los ocurrido con la cepa avirulenta H37Ra. Asimismo, demostraron que los factores de virulencia PhoP y ESAT-6 de Mtb son necesarios para la inhibición de los autofagosomas que contienen la micobacteria en macrófagos THP-1.
La molécula ManLAM es un elemento clave en la virulencia de Mtb y participa en el bloqueo de la autofagia. El análisis proteómico de las organelas de macrófagos tratados con ManLAM purificado de especies micobacterianas, sugiere que ManLAM modula el tráfico de proteínas que contribuyen al arresto de la maduración de los autofagosomas e inhibe la acumulación de vacuolas autofágicas en el macrófago, por supresión de los niveles de LC3 (indicador de autofagia) en las membranas fagosómicas de la línea celular RAW264.7.43
Otras proteínas responsables de bloquear la autofagia, también denominadas efectores anti-autofagia son PE_PGRS47 y el factor de supervivencia intracelular (Eis). Saini et al.,44) demostraron que cepas mutantes de Mtb, en las que fue delecionado el gen que codifica para PE_PGRS47 (Rv2741), presentaron una disminución en su capacidad de inhibir la autofagia. Por su parte, Shin et al.,45) observaron que macrófagos infectados con cepas H37Rv con deleción del gen eis, exhibieron un marcado incremento en la acumulación de vacuolas autofágicas y en la formación de autofagosomas. Por otra parte, se ha demostrado que proteínas como SecA2, SapM y la enzima PknG, importantes elementos en la virulencia de Mtb, también contribuyen a la inhibición del autofagosoma (Fig. 2B).20
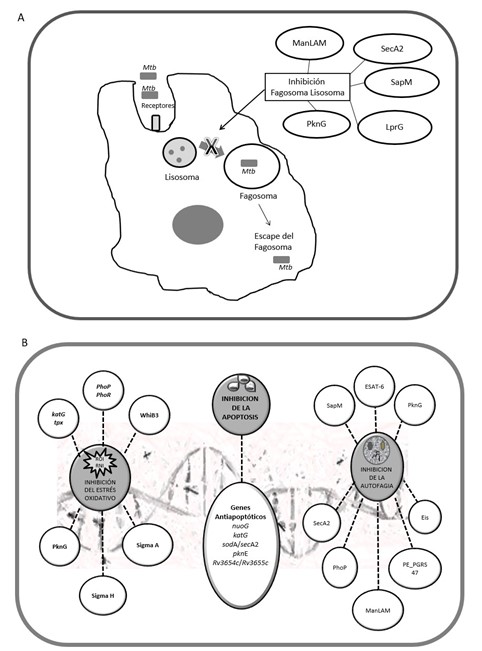
Fig. 2 A: Factores de Virulencia de M. tuberculosis que participan en la inhibición fagosoma-lisosoma. B: Factores de Virulencia de M. tuberculosis involucrados en la inhibición del estrés oxidativo, apoptosis y autofagia. ROI: Intermediarios de Oxígeno Reactivo. RNI: Intermediarios de Nitrógeno Reactivo.
6. Elementos de Mtb que Modulan la producción de Citoquinas y la Respuesta Inmune Adaptativa
La gran mayoría de las investigaciones han sido orientadas al estudio de los determinantes de virulencia durante la fase inicial de la RI, y pocas se han enfocado en investigar como Mtb actúa sobre la RI adaptativa. Sin embargo, las evidencias científicas existentes han demostrado que Mtb emplea una serie de estrategias y elementos, capaces de modificar rutas o factores que participan en la inmunidad innata y en la producción de citoquinas, con el único propósito de burlar la RI y garantizar sobrevivir y persistir en el hospedero.
Lipomanano (LM), LAM recubierto de fosfoinositol (PILAM) y ManLAM, participan en la modulación de la producción de citoquinas y en la RI adaptativa. De hecho, se ha demostrado que LM induce la producción de IL-12, mientras que para PILAM se ha evidenciado que induce la secreción de IL-8, IL-12, TNFα.46,47,48 Por el contrario, las investigaciones han confirmado que ManLAM no induce la secreción de IL-12 en el macrófago.46,47,48,49 La IL-12 juega un papel fundamental en la RI de tipo Th1, por lo que el hecho de no ser inducida por ManLAM indica una manera de supervivencia de Mtb, ya que modula a su favor la respuesta de células T. Por su parte, existen otras evidencias de que ManLAM inhibe la respuesta celular por supresión de la expresión de MHC-II e IFNγ.48,49 En efecto, el hecho de inhibir la producción de IFNγ afecta importantes procesos celulares durante la RI como la producción de MHC-I, MHC-II, ROI y RNI.50 Asimismo, la supresión de MHC-II impide la presentación de antígenos por las células dendríticas, y en consecuencia, se produce una RI adaptativa ineficiente (Tabla 1).
Además de las propiedades inmunomoduladoras de los elementos de la pared celular de Mtb, existen estudios científicos que han confirmado la participación de proteínas. En ese sentido, Saini et al.,44) atenuaron cepas de Mtb por interrupción del gen Rv2741 que codifica para la familia de proteínas PE_PGRS47, y observaron una disminución de la tasa de crecimiento in vivo e in vitro, ratificando su papel en la virulencia de Mtb, y además, confirmaron su capacidad de restringir la presentación de antígenos por MHC-II en ratones infectados. Por su parte, Portal-Celhay et al.,51) demostraron que EsxH, secretado por el sistema de secreción Esx3-tipo VII, inhibe la activación de linfocitos T CD4+ antígeno-específico, por macrófagos y células dendríticas, ya que bloquea la presentación antigénica por MHC II. Igualmente, Meng et al.,52 observaron que un miembro de la familia de PPE de Mtb, conocida como Pro-Pro-Glu 38 (PPE38), inhibe la transcripción de genes que codifican MHC-I y disminuye el número de células T CD8 + en el bazo, hígado y pulmones de ratones C57BL/6 (Tabla 1).
Tabla 1 Elementos de Mtb que Modulan la producción de Citoquinas y la Respuesta Inmune Adaptativa.
| Elementos de Mtb | IL-12 | IL-8 | TNFα | IFNγ | MHCI | MHCII | TCD4+ | TCD8+ |
|---|---|---|---|---|---|---|---|---|
| LM | IND | |||||||
| PILAM | IND | IND | IND | |||||
| ManLAM | INH | INH | INH | |||||
| PE_PGRS47 | BLOQ | |||||||
| EsxH | BLOQ | INH | ||||||
| PPE38 | INH | INH |
Mtb: M. tuberculosis. LM: Lipomanano, PILAM: Lipoarabinomanano-fosfoinositol, ManLAM: Lipoarabinomanano-manosa. IL. Interleuquina. TNFα: Factor de Necrosis Tumoral α. IFNγ : Interferón γ, MHC: Complejo Mayor de histocompatibilidad, T CD4+: Linfocitos T CD4+, TCD8+: Linfocitos T CD8+. IND: Inducción, INH: Inhibición, BLOQ: Bloqueo.
7. Inducción de la necrosis de macrófagos y polimorfonucleares
La necrosis de macrófagos y neutrófilos puede ser considerada una de las diversas estrategias que utiliza Mtb para evadir la RI, ya que permite su diseminación a otras células y a escapar de los procesos que se activan en el interior de las células fagocíticas. En efecto, Assis et al.,53 demostraron que los genes que codifican para la fosfolipasa (plA y plC) inducen la necrosis de macrófagos alveolares, mientras que Danelishvili et al.,54 evidenciaron que la deleción del gen Rv2626c del genoma de Mtb, reduce la necrosis significativamente en las células THP-1 y, caso contrario, la sobreexpresión de Rv2626c promueve la necrosis de la célula huésped cuando se contrasta con la cepa salvaje. Adicionalmente, Houben et al.,55) señalaron que la región RD1 de Mtb está involucrada en el proceso de necrosis. Otros estudios han publicado que ESAT-6 es capaz de activar la necrosis de células polimorfonucleares (PMN), en ese caso, Dalenga et al.,56 evidenciaron que un mutante que carece de ESAT-6/EsxA fue mucho menos eficiente para inducir necrosis de PMN en comparación con la cepa salvaje.
Conclusiones
La presente revisión se orientó principalmente a aquellos genes y determinantes de virulencia que actúan en el macrófago e intervienen en la modulación de la RI. Asimismo, las investigaciones presentadas hicieron posible comprobar que Mtb utiliza múltiples factores o genes de virulencia para sobrevivir y evadir la actividad de la RI. Por otra parte, existen factores de virulencia que están involucrados en diversas estrategias de evasión de la RI y que, además, actúan como inmunoreguladores, y que pudiesen ser consideradas moléculas claves como ManLAM, PknG, ESAT-6 y PhoP. Falta aún mucho por dilucidar, por lo que las investigaciones deberían incorporar nuevas estrategias basadas en la proteómica y el análisis de transcriptomas, así como también enfocarse en determinar si los genes de virulencia actúan de manera interconectada y coordinada.
Finalmente, los avances en la comprensión de la virulencia de Mtb permiten entender porque ha sido catalogado un patógeno intracelular exitoso, y además, contribuyen al desarrollo de nuevos tratamientos y vacunas que podrían prevenir o controlar en un futuro la diseminación de TB.














