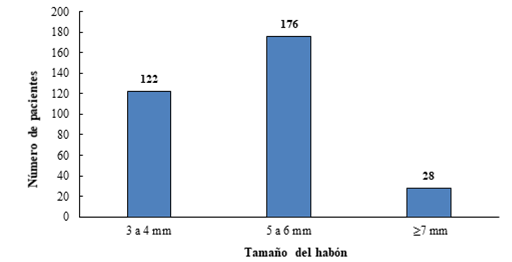Introducción
Los trastornos respiratorios del sueño (conocidos como RSD, por sus siglas en inglés: “respiratory sleep disorders”), principalmente la apnea obstructiva del sueño (OSA, por sus siglas en inglés: “obstructive sleep apnea”), han generado interés creciente en la comunidad médica internacional. Sin embargo, en la Atención Primaria de Salud (APS), es un tema escasamente abordado, a pesar del potencial que existe para diagnosticar y tratar a estos pacientes, desde una perspectiva amplia con participación de los especialistas conocedores del problema.
Paralelamente al bajo nivel de diagnóstico confirmado con dispositivos validados para el estudio de los trastornos del sueño, existe conocimiento, desde el punto de vista clínico, de la existencia de un número considerable de pacientes de todas las edades, con este padecimiento, que requieren atención médica en la APS y en otros niveles de salud. Se ha observado que OSA es muy prevalente en la población general y puede causar deterioro de la calidad de vida con hipertensión arterial, enfermedades cardiovasculares, cerebrovasculares y accidentes del tráfico con incremento de la mortalidad. En el caso particular de la rinitis alérgica (RA), puede concomitar con OSA, aunque también está infra-diagnosticada. Se ha reportado que el porcentaje de pacientes con OSA y diagnóstico de RA y rinitis no alérgica (RNA) es del 18% y 26% respectivamente.1 La inflamación de la mucosa causada por estas afecciones podría ser la causa del deterioro de la permeabilidad de las vías aéreas superiores que induce la inflamación de la mucosa nasal.
También se ha demostrado que mediadores inflamatorios, como la histamina, CysLT, IL-1β e IL-4 que se encuentran en niveles altos en la rinitis alérgica, empeoran la calidad del sueño en OSA.2
Varios autores han reiterado que la RA aumenta el riesgo de desarrollar OSA por aumento de la resistencia nasal de las vías respiratorias debido a una mayor resistencia nasal y por reducción del diámetro faríngeo de la respiración bucal que mueve la mandíbula hacia abajo.2,3,4 La RA y RNA están estrechamente asociadas a OSA, y cada condición puede ser perjudicial para la otra.
La rinitis no alérgica con neutrófilos fue el tipo más frecuente de rinitis celular diagnosticada en pacientes con OSA para un 20% de los casos.1
La prevalencia de RA en OSA/RSD es considerablemente alta, los niños con RSD sufren mayor incidencia de RA que los no RSD. Los adultos con OSA acompañados de RA no tienen influencia en los parámetros del sueño.4
Hemos encontrado en anteriores investigaciones realizadas en pacientes entre 8 y 70 años de edad con RA, que el índice de apnea e hipopneas (IAH) fue positivo en 54,6% de los casos evaluados.5
El propósito de la investigación es conocer el diagnóstico de OSA en pacientes con RA a través de la policardiografía respiratoria (CRP del inglés “cardiorespiratory polygraphy”) y valorar los resultados de aplicar inmunoterapia alérgeno específica (ITAE) en la RA para cambiar el curso de la enfermedad y consecuentemente mejorar la OSA.
Materiales y Métodos
Estudio observacional de tipo descriptivo en el universo de pacientes que asistieron al servicio de Alergología del policlínico “Previsora” en Camagüey desde diciembre 2018 a marzo del 2020. La muestra estuvo constituida por 326 pacientes con diagnóstico por historia clínica y punción cutánea (Prick test) de RA. Tenían además sospecha de OSA y fueron tratados con ITAE por un periodo superior a los 10 meses. La selección de la muestra se hizo, del registro de pacientes, en orden consecutivo, incluyendo aquellos que tenían 5 o más años de edad. Se tuvo en cuenta la edad por las características del dispositivo ApneaLink AirTM (Resmed Corp., RFA) que es inapropiado para hacer la CRP a niños pequeños. Se agruparon según edad: 5 a 14 años, 15 a 24 años, 25 a 59 años, 60 a 79 años y 80 años o más. Decidimos no subdividir el grupo de 25 a 59 años, teniendo en cuenta que la respuesta de alérgenos es similar en estas edades. Por otra parte, se tuvo en cuenta la menor sensibilización en el adulto mayor y en especial en los ancianos ≥80 años de edad.
Criterios de inclusión y exclusión
Fueron seleccionados los pacientes de 5 o más años de edad con RA y Prick test positivos a los ácaros Dermatophagoides pteronyssinus (Dp), Dermatophagoides siboney (Ds) y Blomia tropicalis (Bt), producidos en el “Centro Nacional de Biopreparados” (BIOCEN) de Cuba, que habían recibido ITAE por un periodo superior a 10 meses y tenían una prueba de CRP antes y otra después de la ITAE.
Se excluyeron a los que habían recibido ITAE antes de diciembre del 2018 y a los que no colaboraron en la realización del Prick test y la CRP o no tenían las dos CRP.
Información técnica
El Prick test se realizó con los extractos de ácaros Dp, Ds y Bt. Para realizar el Prick test se utilizó el producto liofilizado de 100.000 UB con su diluyente, elaborado en BIOCEN. Al mezclar ambos, se obtuvo un frasco de 20.000 UB/mL, con la que el fabricante recomienda hacer 80 Prick test. En el Servicio de Alergología del Policlínico “Previsora” de la ciudad de Camagüey, Cuba, se diluyeron al doble del volumen previsto por el fabricante para una actividad biológica final de 10.000 UB/mL. Las lancetas de precisión empleadas fueron: DIATER-Prick de Argentina, cuya punta mide 1,0 mm. Se aplicaron de forma vertical a través de una gota de cada extracto y de los controles negativos del diluente y positivos de histamina a 54,3 mmol/mL. A los 15 min se hizo la lectura, considerando positivos a los que presentaron un habón a los alérgenos de 3 mm o más, acompañados de un control negativo inferior a 3 mm y de histamina igual o superior a 3 mm.5
La CRP se realizó utilizando el marcaje automático de eventos del dispositivo ApneaLink AirTM (Resmed Corp., RFA) que está validado para estudiar los trastornos del sueño en el hogar. Para la preparación del registro individual, el dispositivo se acopla a una computadora. Se conectan al dispositivo ApneaLink AirTM los accesorios recomendados por ResMed: cánula nasal, cinturón, sensor de esfuerzo, pinza del cinturón del sensor de esfuerzo y sensor de oxímetro de pulso digital reutilizable, modelo 8000SX (Nonin Medical, Inc. EE:UU). El dispositivo con sus complementos fue aplicado a la hora de dormir. Se les explicó a cada paciente, padres o tutores cada detalle de la prueba, incluyendo el significado de los colores de las luces. Una vez comprobado el encendido del dispositivo, se orientó al paciente acostarse en posición lateral o de cúbito supino. Asimismo, se les advirtió cómo retirar el cinturón y demás accesorios a la mañana siguiente, para entregarlos al especialista y realizar la descarga y captura de los datos en la misma computadora donde se hizo el registro. A los efectos del estudio se tuvo en cuenta el resultado del IAH: normal <5/h y positivos ≥5/h.
Los resultados del Prick test y de la CRP se evaluaron de forma objetiva antes y después de la ITAE. Se hizo también una valoración subjetiva de la eficacia de la ITAE, según criterios de los pacientes y profesionales del servicio de Alergología del policlínico “Previsora”, siguiendo una escala de observación en respuestas a las preguntas siguientes:
¿Cómo valora el paciente su estado antes del inicio de la inmunoterapia?
¿Cómo valora el paciente su estado actual con respecto al inicio de la inmunoterapia?
¿Cómo es la valoración del profesional del estado actual del paciente con respecto al inicio de la inmunoterapia?
La escala de observación fue calificada desde -5 a 5. Considerándose peor (-5 a -1), igual (0) y mejor (1 a 5).
Estadística
Las variables fueron: edad, sexo, habón, IAH y valoración subjetiva de eficacia de la ITAE como: peor, igual, mejor. Los datos se presentaron según escalas nominales de clasificación de la enfermedad en género femenino y masculino y escalas ordinales de leve, moderada y severa.
Se consideran tres niveles de gravedad de OSA: I) leve >5 - <15, II) moderada >15 - <30 y III) severa >30.5 Las medidas de tendencia central media y moda se aplicaron en la variable habón del Prick test.
La prueba Ji-cuadrado se empleó para contrastar la hipótesis de homogeneidad o de independencia en una tabla de contingencia. Se consideró un valor p< 0,05.
Para el análisis de los datos se utilizó Epidat 3.1, desarrollado por el Servicio de Información de Xunta de Galicia en colaboración con la OPS-OMS.6
Resultados y Discusión
De los 326 pacientes estudiados, 152 fueron del sexo femenino y 174 masculino para un 46,6% y 53,4% respectivamente. Se detectó RA en todas las edades (Tabla 1). Resultados similares a la investigación realizada anteriormente en la ciudad de Camagüey,5 con las limitaciones propias de una población derivada a un servicio de Alergología; asimismo, diversos estudios realizados en otros países en población abierta.7,8,9
Tabla 1 Distribución por edades de los pacientes con rinitis alérgica.
| Edad en años | Número | Porcentaje |
|---|---|---|
| 5 a 14 | 69 | 21,16 |
| 15 a 24 | 53 | 16,25 |
| 25 a 59 | 82 | 25,15 |
| 60 a 79 | 95 | 29,14 |
| 80 o más | 27 | 8,28 |
| Totales | 326 | 100 |
En la Figura 1 se observa que el grupo de pacientes con tamaño de habón de 5 a 6 mm (media 5,5; moda 5), fueron los más representados de la muestra para un valor p=0,04. Coincidiendo con lo observado en otros estudios realizados en la misma área,5 y con investigaciones de autores foráneos,7,8,9 pero diferente a otro estudio que evaluó la RA y RNA, en el cual el tamaño del habón fue menor para ambas enfermedades.10
Hubo un descenso en los tres niveles de gravedad de la OSA según los valores de IAH después de la ITA (p=0,025) como se aprecia en la Figura 2. Resultados estos que no pudieron ser contrastados en estudios similares nacionales ni extranjeros al no encontrarse referencias al respecto. Sin embargo, en la misma área de salud se ha comprobado la existencia en RA de incremento de OSA.5 Ambas entidades podrían ser mejoradas con ITAE. Nuestros resultados son similares a otros estudios,7,8,9,10,11,12,13 en los que los pacientes con RA presentaron puntuaciones de calidad del sueño significativamente mayores, así como puntuaciones de alteraciones del sueño y de latencia. El uso frecuente e indeseado de medicamentos para dormir y una menor eficiencia del sueño, medida por el índice de calidad del sueño de Pittsburgh y la polisomnografía, pudieran beneficiarse con la ITAE, ya que las evidencias demuestran que existe una asociación significativa de RA con las características del sueño.7
Otros investigadores consideran que podrían usarse diferentes estrategias, como los esteroides inhalados y la presión positiva continua (PPC) en las vías respiratorias para la prevención de la rinitis y el OSA ya que comparten algunos factores de riesgo,12,13 mientras que otros factores tenían asociación inversa con los dos trastornos.14,15 Por lo tanto deben realizarse más investigaciones para esclarecer el papel de la ITAE en pacientes con RA y OSA.
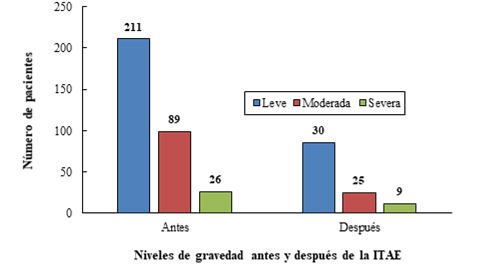
Fig. 2 Cantidad de pacientes antes y después de la inmunoterapia alérgeno específica (ITAE) según niveles de gravedad de la apnea obstructiva del sueño.
En la Figura 3 se aprecia la valoración subjetiva de la eficacia de la ITAE, según criterio de pacientes y especialistas. Ambos reportaron un número significativo de mejorados después de la ITAE (p=0,012). Sin embargo, no se encontraron referencias más allá de la que publicamos en un estudio anterior,5 donde se aprecia una valoración subjetiva favorable hacia la ITAE, tanto de pacientes como del personal del servicio de alergia, donde constituye una práctica común.
Algunas investigaciones en las que se exploró RA y OSA mediante cuestionario y escala analógica visual con respecto a los síntomas de RA, incluyendo su duración y gravedad, mostraron que los pacientes con una puntuación ≥3 se consideraron de alto riesgo de tener OSA.1,15,16,17,18,19,20) La prevalencia de alto riesgo de tener OSA en pacientes con RA fue dos veces mayor que en la población general. La detección temprana y el manejo adicional de estos pacientes pudiera mejorar los resultados del tratamiento y la calidad de vida.17 En RA hay resultados controvertidos que señalan el papel de la inflamación nasal en el ronquido primario y OSA con criterios subjetivos diferentes en cuanto al uso de ITAE, priorizando el uso de medicamentos para el tratamiento de RA;1,4 sin embargo, nuestra experiencia refuerza el criterio de que el único tratamiento que modifica el curso de la enfermedad alérgica es la ITAE, que sería la prioridad en RA/OSA.5
Por otro lado, se ha demostrado que los ronquidos durante ≥3 meses, el sexo masculino, la obesidad, la hipertrofia amigdalina y la hipertrofia adenoidea se asociaron con OSA.19 Ello sugiere diferentes intervenciones de tratamiento, aunque cuando se diagnostica OSA la PPC es la terapia principal;20 sin embargo, el cumplimiento de PPC es variable: las dolencias nasales, como la congestión nasal, se mencionan con frecuencia como una causa de incumplimiento de la PPC, que se asocia además con el inicio y la exacerbación de RA en pacientes con OSA, ya que la exposición a largo plazo a altas concentraciones de alérgenos de ácaros domésticos puede ser un factor de riesgo de incremento de la sensibilización.20 Razones estas que deben tenerse en cuenta para considerar como tratamiento en la RA/OSA la ITAE, lo cual se evidencia en esta investigación.