Introducción
La estrategia de vacunación masiva ha sido uno de los pilares para el control y enfrentamiento a la situación epidemiológica ocasionada por la pandemia de COVID-19. El Instituto Finlay de Vacunas (IFV), ante la situación de emergencia global, a partir de la experiencia en la investigación de vacunas profilácticas y la revisión de diseños de ensayos clínicos con vacunas específicas contra el coronavirus tipo 2 causante del síndrome respiratorio agudo severo (SARS-CoV-2, por sus siglas en inglés), desarrolló dos vacunas, SOBERANA®02 y SOBERANA®Plus, que contienen como principio activo proteína recombinante del dominio de unión al receptor (RBD: receptor-binding domain, por sus siglas en inglés).
Ambas vacunas forman parte de un esquema heterólogo de dos dosis de SOBERANA®02 (vacuna de subunidad proteica RBD monomérica, conjugada con toxoide tetánico), seguida de una dosis de SOBERANA®Plus (vacuna dimérica RBD), administradas cada 28 días. Este esquema se probó en estudios clínicos en adultos, con evidencias de seguridad, inmunogenicidad y eficacia preventiva del 92,4%.1,2,3 Posteriormente, se comprobó la seguridad y la inmunogenicidad de dicho esquema, en niños y adolescentes entre 3 y 18 años, con una predicción de la eficacia del 90%.4
Los resultados de estos estudios sustentaron el autorizo de uso en emergencia (AUE) de las vacunas mencionadas, otorgado por la autoridad reguladora de Cuba, para adultos y niños entre 2 y 18 años, el 20 de agosto del 2021.5,6 Cinco días después, se promovió una campaña masiva de vacunación pediátrica por el Ministerio de Salud Pública.
En ese momento, para las autoridades de salud en Cuba constituyó un desafío la capacidad de movilización rápida de centros de vacunación masiva fuera del escenario convencional; es decir, fuera de los centros de salud dedicados a la vacunación. Al mismo tiempo, se requería la vigilancia de posibles efectos secundarios a una nueva vacunación, más allá de la demostrada en los ensayos clínicos previos; y demostrar, en breve tiempo, el impacto en la infección sintomática, de la enfermedad grave y muerte por COVID-19.
El Centro de Inmunología Molecular (CIM), con el precedente de haber participado del estudio de intervención en población de riesgo para trabajadores de la salud pública y de BioCubaFarma,7 se sumó a la campaña de vacunación pediátrica y colaboró como sitio centinela de la farmacovigilancia pos AUE del IFV. Los objetivos del presente estudio son describir el cumplimiento del esquema de vacunación, su seguridad y la incidencia de casos positivos a SARS-CoV-2 posterior a la vacunación con el esquema heterólogo completo de las vacunas SOBERANA®02 y SOBERANA®Plus, en niños y adolescentes inmunizados en el CIM.
Materiales y Métodos
Se diseñó un estudio observacional prospectivo en niños y adolescentes con criterio de vacunación anti COVID-19, que acudieron al CIM como sitio de vacunación.
Del 15 de septiembre al 31 de diciembre del 2021, se incluyeron 529 niños y adolescentes entre 2 y 18 años de edad procedentes de 35 municipios y 12 provincias de Cuba. Se excluyeron los sujetos con antecedentes de COVID-19, definido por historia previa o actual de infección por SARS-CoV-2, confirmada por estudio de reacción en cadena de la polimerasa con reverso transcripción (RT-PCR, del inglés reverse transcription-polymerase chain reaction) en tiempo real, con antecedentes de haber recibido alguna vacuna del esquema de inmunización cubano o una infección aguda en menos de siete días, antecedentes de hipersensibilidad a algún componente de las formulaciones y con antecedentes de enfermedades crónicas descompensadas en el momento de la vacunación.
Esquema de vacunación
Se administraron dos primeras dosis de SOBERANA®02 y una tercera dosis de SOBERANA®Plus a intervalos de 28 días entre cada dosis (0-28-56), en un volumen de 0,5 mL por vía intramuscular, en ambos deltoides, alternando entre dosis administrada.
Se usaron los lotes de SOBERANA®02: 10008TS2 y 1014TS2 y de SOBERANA®Plus: 1006ST.
Para evaluar el cumplimiento del esquema de vacunación se notificaron las fechas de planificación de cada dosis y de cumplimiento de las mismas.
Evaluación de los criterios de selección y de la seguridad
Se realizó interrogatorio presencial, examen físico y toma de los signos vitales (temperatura corporal, medición de la frecuencia respiratoria, frecuencia cardíaca y tensión arterial) para verificar los criterios de selección y monitorizar la seguridad de las vacunas, antes de cada inmunización y una hora después. Además, se entregó un diario de posibles eventos adversos (EA) después de cada inmunización para ser llenado por los padres, tutores o los propios niños y adolescentes, que se revisó al concurrir al sitio de vacunación para recibir las dosis subsiguientes y se consultó por vía telefónica a los 30 días de la última inmunización recibida.
Para describir la seguridad a las vacunas se clasificaron los EA según el tipo e intensidad, conforme a los Criterios Comunes de Toxicidad de Eventos Adversos versión 5.0 (CTCAE, Common Terminology Criteria for Adverse Events, por sus siglas en inglés), que gradúa los EA como leve (grado 1): asintomáticos o síntomas leves, que demanda sólo observación clínica, no se indica tratamiento; moderado (grado 2): requiere tratamiento mínimo, local o no invasivo, evento que limita las actividades de la vida diaria (AVD) propias de la edad; severo/grave (grado 3): clínicamente significativo, pero no de amenaza inmediata, requiere hospitalización o prolongación de la hospitalización, es incapacitante, limita las AVD al cuidado personal; con consecuencias peligrosas para la vida (grado 4): demanda tratamiento urgente y muerte (grado 5): relacionada con el EA.8
También se evaluó la aparición de EA grave, catalogado como aquel que produce la muerte, amenaza la vida, produce una incapacidad permanente, invalidez significativa o da lugar a hospitalización o la prolongación de la misma, vinculado a las vacunas evaluadas.9
Para la relación de causalidad se usó el algoritmo de la OMS del 2019,10 ratificado por la OPS en el 2021, para estandarizar las definiciones de los EA con la introducción de las vacunas anti COVID-1911,12 que describe la relación de causalidad como:
A. EA consistente con la relación causal
A1. Reacción relacionada con el producto de la vacuna: evento supuestamente atribuible a la vacunación o inmunización (ESAVI), causado por una vacuna debido a las propiedades inherentes del producto vacunal.
A2. Reacción relacionada con un defecto de calidad de la vacuna.
A3. Reacción relacionada con un error de inmunización: causado por una manipulación inadecuada de la vacuna, prescripción o administración.
A4. Reacción relacionada con la ansiedad por la inmunización: ESAVI que surge de la ansiedad por la inmunización.
B. Indeterminada
B1. Relación temporal consistente, pero hay insuficiente evidencia de que la vacuna sea causante del evento.
B2. La revisión de los factores que pudieran propiciar el EA resulta contradictoria en coherencia sobre la asociación causal del evento por la vacuna.
C. Asociación causal inconsistente con la inmunización (evento coincidente), probablemente debido a condiciones subyacentes o emergentes o condiciones causadas por exposición a algo que no sea la vacuna.
D. No clasificable. Información no disponible para determinar la relación causal.
Además, se realizó vigilancia de eventos adversos de interés especial (EVADIE) para vacunas anti COVID-19.11
Incidencia de casos positivos a COVID -19, sintomáticos o asintomáticos
Se consultó la plataforma informática nacional Higia Andariego para el control de casos positivos y el sistema de monitoreo de RT-PCR, para identificar los casos confirmados de infección por SARS-CoV-2 hasta 3 meses después de haber recibido el esquema completo de vacunación, de conformidad con el Protocolo de Actuación Nacional para la COVID-19 (versión 1.6) de marzo 2021. Este protocolo describe como caso confirmado o positivo a COVID-19 al sujeto que resulte positivo al estudio virológico por RT-PCR para la COVID 19, con o sin sintomatología.13
Recolección de los datos y análisis estadístico
Se diseñó un cuaderno de recolección de datos digital en el software Xavia SIDEC14 como evidencia documental, que incluyó información sociodemográfica (edad, sexo, lugar de residencia), comorbilidades, examen físico, signos vitales, dosis de vacunas, EA e infección por COVID-19. Los datos se entraron en tiempo real y se procesaron mediante el paquete estadístico SPSS, versión 21.0 para Windows.15
Se realizaron estadísticas descriptivas en términos de frecuencias absolutas, porcientos y rangos.
Ética
Los médicos evaluadores proporcionaron de forma oral toda la información sobre la vacunación y potenciales riesgos y beneficios a los padres, responsables legales y participantes según su nivel de compresión. Se solicitó el consentimiento para la vacunación de forma oral a los padres y tutores, así como el asentimiento informado a los participantes mayores de 12 años.
El estudio se efectuó según las Buenas Prácticas del Programa Nacional de Inmunización de Cuba. El sitio de vacunación recibió certificación para la vacunación pediátrica por la Dirección Provincial de Salud Pública de La Habana.
Resultados
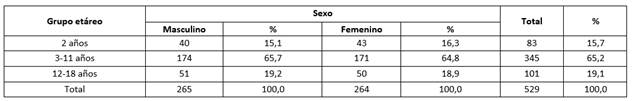
De los 529 participantes, el grupo etáreo de 3 a 11 años fue el más representativo y la relación entre sexo masculino y femenino fue similar para todos los grupos de edades (Tabla 1).
El 36,3% de los sujetos presentó alguna condición subyacente, como alergia respiratoria y el asma bronquial que ocupan la mayor prevalencia entre las comorbilidades identificadas. Otras enfermedades crónicas se presentaron en el 1% o menos (Tabla 2).
Tabla 2 Comorbilidades.
| Comorbilidades | N = 529 | % |
|---|---|---|
| Alergia respiratoria | 119 | 22,5 |
| Asma bronquial | 48 | 9,1 |
| Enfermedad neurológica (epilepsia, parálisis de Duchenne) | 6 | 1,1 |
| Cardiopatía congénita (tetralogía de Fallot, comunicación intrauricular) | 4 | 0,8 |
| Enfermedad renal crónica | 4 | 0,8 |
| Sicklemia | 3 | 0,6 |
| Hipertensión arterial | 3 | 0,6 |
| Diabetes mellitus tipo 1 | 2 | 0,4 |
| Cáncer (linfoma no Hodgkin) | 1 | 0,2 |
| Síndrome de Down | 1 | 0,2 |
| Diabetes insípida nefrogénica | 1 | 0,2 |
| Total | 192 | 36,3 |
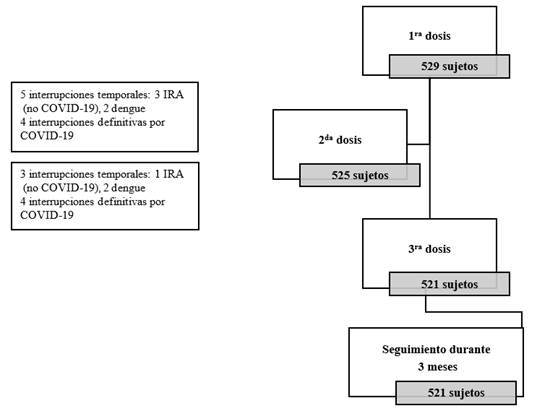
De los 529 participantes el 98,5% (515 sujetos) recibió las tres dosis planificadas y en el tiempo previsto, con excepción de ocho sujetos que tuvieron interrupciones temporales, que prolongaron la vacunación entre 7 y 14 días, debido a enfermedades infecciosas agudas no COVID-19. El 1,5% (ocho de 529 de los sujetos) interrumpió definitivamente el esquema de vacunación, en las primeras dos dosis, porque enfermaron de COVID-19 (Fig. 1).
Seguridad
De todos los sujetos vacunados el 8,1% (43 de 529 vacunados) manifestó al menos un EA y el 6,6% (35 sujetos) presentó algún ESAVI; todos recuperados sin secuelas. No se reportaron EA de intensidad severa, ni muy severa; así como eventos graves o EA de interés especial para vacunas anti COVID-19.
Los EA más comunes se clasificaron con relación consistente A1. Para la vacuna SOBERANA®02 fueron el dolor, el aumento de volumen y el enrojecimiento en el sitio de inyección, seguido del malestar general y la somnolencia. Para la vacunación con SOBERANA®Plus se distingue solo el dolor en el sitio de inyección (Tabla 3). Todos los eventos relacionados con ambas vacunas fueron de intensidad ligera o moderada, los cuales ocurrieron en las primeras 24 horas, con una duración entre 1 y 5 días y no fueron motivo de interrupción del esquema planificado. No se notificaron eventos adversos por defecto de calidad, ni por errores de la inmunización, ni por ansiedad.
Tabla 3 Eventos adversos con asociación causal consistente con la vacunación.
| Eventos adversos | 1ra dosis | 2da dosis | 3ra dosis |
|---|---|---|---|
| Dolor en el sitio de la inyección | 15 | - | 10 |
| Aumento de volumen | 3 | 1 | - |
| Eritema | 2 | 1 | - |
| Induración | 1 | 1 | - |
| Equimosis | 1 | - | - |
| Febrícula | 1 | 1 | - |
| Malestar general | 2 | - | - |
| Erupción palmar | 1 | - | - |
| Prurito | 1 | - | - |
| Somnolencia | 1 | 1 | - |
| Síndrome seudogripal | 1 | 1 | - |
| Total | 29 | 6 | 10 |
- : no se notifican.
Otros eventos se clasificaron como eventos indeterminados o con relación causal inconsistente con la vacunación, como eventos coincidentes. Estos eventos se presentaron con una relación temporal entre 7 y 14 días posterior a la vacunación (Tabla 4).
Tabla 4 Eventos adversos indeterminados o con relación causal inconsistente con la vacunación.
| Eventos adversos | 1ra dosis | 2da dosis | 3ra dosis |
|---|---|---|---|
| Asma bronquial | - | 1 | - |
| Fiebre (≥ 38° C) | - | 1 | - |
| Decaimiento, malestar general | 2 | - | - |
| Urticaria | 1 | - | - |
| Amigdalitis | 1 | - | - |
| Conjuntivitis catarral | 2 | - | - |
| Dengue | 2 | 3 | - |
| Faringoamigdalitis | 1 | 1 | 3 |
| Infección urinaria | 1 | - | - |
| Dolor de cabeza | 1 | - | - |
| Somnolencia | - | 1 | - |
| Enrojecimiento ocular | 1 | - | - |
| Secreción nasal | 1 | - | - |
| Total | 13 | 7 | 3 |
- : no se notifican.
Discusión
Con el AUE de las vacunas SOBERANA®02 y SOBERANA®Plus para niños y adolescentes y la inminente ejecución de una campaña masiva de vacunación segura y eficiente, el CIM contribuyó a su ejecución como sitio de farmacovigilancia activa. El presente trabajo describe el resultado del cumplimiento de la vacunación, del perfil de seguridad de las vacunas y la incidencia de casos positivos en el seguimiento de los participantes que recibieron esquema completo de inmunización.
La serie estudiada comprendió niños y adolescentes de varios municipios de La Habana, donde se localiza el sitio de vacunación, y también, de otras provincias. Esta dispersión geográfica pudiera explicarse por las restricciones de la movilidad en plena pandemia, que estaban implementadas en el país en el momento de la vacunación, por lo que los niños y adolescentes se encontraban fuera de su residencia oficial por razones disímiles; lo que no fue limitación para recibir la vacunación y cumplir con el esquema pautado.
Los participantes del estudio representan a todos los grupos etarios a los que se dirigió la vacunación pediátrica en Cuba, los cuales coinciden con las características demográficas y las comorbilidades de mayor prevalencia representadas para las edades pediátricas (año 2021), según el Anuario Estadístico de Salud de Cuba.16 Otras comorbilidades referidas aquí, también se notifican en menores de 18 años en el Anuario,16 pero este tipo de individuos con enfermedades crónicas no participó del estudio con vacunas SOBERANA®02 y SOBERANA®Plus en niños y adolescentes, previo a la AUE.( ) Obtener datos de sujetos con estas enfermedades crónicas en el contexto de la vacunación masiva, permite ampliar el conocimiento sobre la seguridad y la efectividad de estas vacunas.
El esquema de vacunación heterólogo de SOBERANA®02 de dos dosis y una tercera dosis con SOBERANA®Plus de 56 días se cumplió en el tiempo planificado en la mayoría de los sujetos; lo que confirma la viabilidad del esquema y la disposición de los padres, tutores e hijos para la inmunización, suscitado en la confianza sobre la seguridad y eficacia de las vacunas, en específico, las vacunas cubanas desarrolladas para enfrentar y controlar la COVID-19.17
En consonancia con lo anterior, se puede deducir que el perfil de seguridad a las vacunas SOBERANA®02 y SOBERANA®Plus, descrito en este estudio, favoreció el cumplimiento del esquema de vacunación. Los EA relacionados con la vacunación fueron mínimos, con predominio de reacciones locales sobre las sistémicas y de intensidad ligera o moderada, referidos en los estudios previos a la AUE,1,2,3,4 incluso, en una población de sujetos más heterogénea, específicamente en rango de edades, comorbilidades y procedencia geográfica.
Se puede notar que la ocurrencia de los EA entre la primera dosis y las subsiguientes disminuye, lo que sugiere que una exposición de tres dosis al antígeno de RBD no parece exacerbar la toxicidad. Tampoco se encontró asociación entre la aparición de algún EA y las comorbilidades, lo que presupone que no se identifican señales de preocupación para la seguridad en individuos con condiciones subyacentes. No obstante, la demostración de EA graves o de interés especial para vacunas anti COVID-19 es rara y se necesitan miles de sujetos expuestos para identificarlas.18 El presente trabajo tiene un alcance limitado para razonar sobre esos EVADIE.
La mayoría de las reacciones adversas de la vacunas anti COVID-19 son leves o moderadas que incluyen reacciones en el sitio de inyección (dolor, enrojecimiento e inflamación), así como fiebre, dolor de cabeza, náuseas, diarrea, fatiga y dolor en las extremidades.18 El perfil de seguridad de las vacunas SOBERANA®02 y SOBERANA®Plus es similar a esta descripción; no obstante, para vacunas derivadas de ácido ribonucleico mensajero (ARNm) probadas en niños y adolescentes, se reportan EA clínicamente relevantes como miocarditis y pericarditis, con mayor frecuencia en jóvenes entre 16 y 24 años de edad, luego de una segunda dosis de vacuna, comparado con el resto de la población expuesta. (18 Las vacunas producidas con vectores de adenovirus se asocian con trombocitopenia, en una frecuencia mayor en adultos más jóvenes en comparación con los adultos mayores, pero no hay información disponible sobre el riesgo en menores de 18 años.18
Si bien los expertos señalan que los beneficios de la vacunación contra la COVID-19 superan los riesgos, es muy importante monitorizar las potenciales reacciones adversas graves; sobre todo, en los niños.18
Los datos de efectividad de la introducción de las vacunas contra la COVID-19 en población pediátrica son limitados, solo se reportan algunos ejemplos por la OMS, en su declaración provisional sobre las vacunas que han recibido AUE por este organismo internacional, actualizados en el año 2022.19
Uno de los países que se notifica es Israel, que estimó una efectividad con la vacuna de Comirnaty (Pfizer/BioNTech) contra la COVID-19 sintomática del 18% después de la primera dosis y del 48% después de la segunda, con una tendencia hacia una mayor efectividad en el grupo de edad más joven, entre 5 y 6 años, comparada con el grupo de mayor edad entre 10 y 11 años.19
Una cohorte poblacional en Chile de 490.694 niños de 3 a 5 años de edad, con la administración de CoronaVac (Sinovac), reporta una efectividad del 38% contra sintomáticos, del 65% contra hospitalizaciones por COVID-19 y del 69% contra ingresos en unidades de cuidados intensivos después de un esquema de dos dosis cada 28 días.19
En los Estados Unidos, las tasas de hospitalización por COVID-19 en niños de 5 a 11 años durante el período predominante de ómicron fue 2,1 veces mayor entre los niños no vacunados (19,1 por 100.000 habitantes) que entre los niños vacunados; además, el 30% de los niños hospitalizados no tenían condiciones médicas subyacentes y el 19% se admitieron en unidades de cuidados intensivos. Según la red de vigilancia de hospitalizaciones asociadas con COVID-19, los niños con diabetes y obesidad tuvieron más probabilidades de experimentar una COVID-19 grave.19
Los niños y adolescentes de este estudio que completaron el esquema de vacunación no enfermaron de COVID-19 durante 3 meses de seguimiento, lo que apunta sobre la efectividad del esquema de SOBERANA®02 y SOBERANA®Plus. Un estudio poblacional sobre la vacunación pediátrica masiva en Cuba publicado por Romani y colaboradores, confirma la efectividad del esquema combinado de vacuna SOBERANA®02 y SOBERANA®Plus en niños de 2 a 11 años de edad, en términos de disminución significativa de casos positivos sintomáticos y graves a COVID-19. Este resultado se mantuvo desde la ola de SARS-COV-2 con predominio de la variante delta, momento en que ocurrió la vacunación masiva y la sucesiva ola de la variante ómicron en Cuba.20
Conclusiones
Se logró un elevado cumplimiento del esquema heterólogo de vacunación de SOBERANA®02 y SOBERANA®Plus, con un perfil de seguridad favorable y los sujetos con esquema completo de inmunización no enfermaron de COVID-19 en un seguimiento durante 3 meses, lo que contribuyó a la reincorporación de los niños y adolescentes a la escuela.