Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med v.2 n.2 Ciudad de la Habana Mayo-ago. 1997
Extracto de Aloe barbadensis inyectable en la atenuación de la mielosupresión por ciclofosfamida en ratones
Lic. José De la Paz Naranjo,1 Dra. María C. Sotolongo Baro,2 Dr. Alfredo Céspedes Valcárcel,3 Téc. María Curí Hernández,4 Téc. María E. Perdomo Paiba4 y Téc. Roberto Miranda Flores4RESUMEN
Se evaluó el efecto del A. barbadensis en dosis de 0,03; 0,10 y 0,18 mg/kg, en la atenuación de la mielosupresión por quimioterapia en ratones tratados con 200 mg/kg de ciclofosfamida 24 h antes del comienzo del tratamiento. A los 9 días de la primera dosis de Aloe barbadensis, un significativo incremento ocurrió en el recuento total de leucocitos comparado con el grupo control, luego, éste fue disminuyendo hasta alcanzar el día 14 cifras similares. No fue significativo el efecto producido por el tratamiento en la hemoglobina y hematócrito. El contraste fue significativo en el recuento de plaquetas a los 14 días. Se encontraron diferencias, además, en el recuento de reticulocitos y en la celularidad de la médula ósea. Los resultados indican que el A. barbadensis administrado en animales tratados con una dosis subletal de ciclofosfamida, causa un marcado incremento de las células sanguíneas derivadas de la médula ósea.Descriptores DeCS: MEDULA OSEA/efecto de droga; CICLOFOSFAMIDA/farmacología; CICLOFOSFAMIDA/administración & dosificación; FACTORES DE CRECIMIENTO DE CELULA HEMATOPOYETICA; ALOE; EXTRACTOS VEGETALES.
El período de vida relativamente corto de las células sanguíneas maduras requiere su continuo reemplazo, un proceso denominado hematopoyesis, además, la producción de nuevas células debe responder tanto a necesidades basales y situaciones de emergencia. La regulación de este proceso es compleja, e incluye interacción célula-célula dentro del microambiente de la médula ósea y también de factores de crecimiento hematopoyéticos y linfopoyéticos. Estos factores de crecimiento producidos por células de la médula y tejido periférico actúan en concentraciones muy bajas y casi siempre sobre más de una línea celular.1-4
En la actualidad, su utilización ha dado acceso a un nuevo campo de investigación, pues éstos permiten aumentar la frecuencia y "escalado" de dosis de agentes quimioterapéuticos, que son conocidos para conseguir mayor actividad antineoplásica y un efecto tóxico menor. Estos últimos acortan el nivel leucopénico droga-inducido, reducen así el peligro de infecciones bacterianas y fúngicas a que están sometidos sus pacientes.5-8
El A. barbadensis inyectable cubano ha sido estudiado por varios investigadores y se le atribuye entre otras, acciones cicatrizantes, antiinflamatoria, inhibidor del crecimiento tumoral, protector de las heridas contra las infecciones y recientemente acción sobre la consolidación de fracturas. Es nuestro propósito evaluar su efecto farmacológico en la atenuación de la mielosupresión por quimioterapia.9,10
MÉTODOS
Como animal de experimentación fue utilizado el ratón Balb/c, hembra con 18 g de peso, procedente del CENPALAB. Los ratones fueron mantenidos en una habitación con temperatura, iluminación, humedad y alimentación según las normas establecidas para el mantenimiento y utilización de los animales de laboratorio.11Los ratones fueron inyectados por vía intraperitoneal con una dosis subletal de 200 mg/kg de ciclofosfamida (genoxal. Laboratorios Funk, s.a. Barcelona) en solución salina fisiológica libre de pirógeno. Trascurridas 24 h los ratones fueron divididos en 4 grupos de 20 animales cada uno (n = 20), de forma aleatoria.12
Grupo 1 (control). Se le administró solución salina fisiológica en un volumen de 0,1 mL por vía intramuscular.
Grupos 2, 3 y 4 (A. barbadensis). Dosis 0,03; 0,10 y 0,18 mg/kg, respectivamente en igual volumen y vía de administración.
Comenzando este mismo día 1 el tratamiento con A. barbadensis o solución salina fisiológica según el grupo de estudio, una vez al día y durante 7 días.
PARÁMETROS HEMATOLÓGICOS Y ANÁLISIS HISTOLÓGICO
Cuatro animales por grupos fueron sacrificados por dislocación cervical los días 2; 4; 7; 9 y 14, posterior a la administración de ciclofosfamida y comienzo del tratamiento, previa extracción de sangre por el plexo orbitario para la determinación de: hemoglobina, hematócrito, recuento total de leucocitos, recuento de plaquetas, reticulocitos, absoluto de neutrófilos, monocitos, linfocitos y eosinófilos, según los métodos convensionales.Inmediatamente después del sacrificio se realizó la disección del fémur derecho y el bazo para el análisis histológico. Las piezas se fijaron en formol neutro al 10 % y el fémur, después de un período de fijación, fue decalcificado en ácido nítrico al 5 %.
La coloración realizada fue la hematoxilina-eosina para ambas piezas, las que fueron observadas en un microscopio Cals-Zeis con aumento 40 x.
Para el diagnóstico histológico se tuvieron en cuenta los parámetros siguientes:
Médula ósea
1. Celularidad- acelular
- hipocelular
- normocelular
- hipercelular.
3. Otros elementos
- megacariocitos
- grasa
- edema
- hemorragia.
Bazo
1. Esplenomegalia- ligera
- moderada
- severa.
- ligera
- moderada
- severa.
- pequeños
- medianos
- gigantes.
ANÁLISIS DE LOS DATOS
Los datos obtenidos fueron introducidos en un ordenador y ranqueados. Para comprobar la hipótesis de las diferencias entre los grupos se realizó un test no paramétrico de Kruskal-Wallis y para determinar entre qué grupos eran las diferencias, fue aplicada una compración múltiple no paramétrica de rangos. El nivel de significación se estableció en a < = 0,05.RESULTADOS
La administración del extracto de A. barbadensis en dosis de 0,03; 0,10 y 0,18 mg/kg de peso, una vez al día y durante 7 días, no produjo cambios significativos en el recuento total de leucocitos los días 2-4. Aun más, el extracto en estos ratones no alteró la leucopenia inducida por quimioterapia, la cual ocurrió en los 4 grupos de estudio el día 4.Sin embargo, el "efecto rebote" en el recuento de leucocitos de estos especímenes ocurrió entre los días 6 y 9; siendo considerablemente más pronunciado y de dosis dependiente en los animales que recibieron el Aloe barbadensis, con un máximo de estimulación el día 9, luego de volver a cifras similares a los 14 días, con ligera eosinofilia en los grupos que recibieron las dosis de 0,10 y 0,18 (grupos 3 y 4) de Aloe barbadensis (figuras 1 y 2).
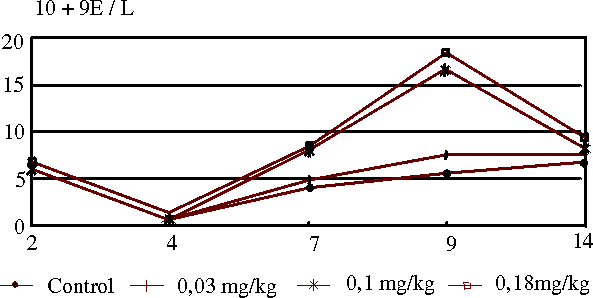
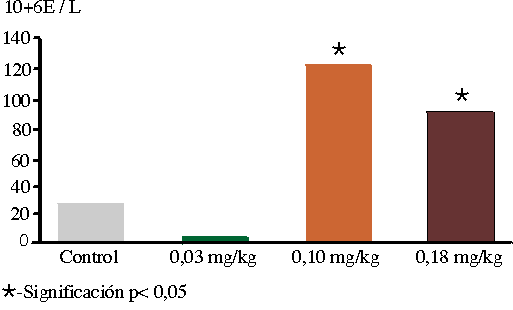
En contraste con lo anterior, la hemoglobina y el hematócrito no sufrieron diferencias significativas entre los 4 grupos durante el experimento.
En cuanto al recuento de reticulocitos no existieron diferencias entre los grupos el día 2, pero sí a partir del día 4, las que se mantuvieron durante el experimento con valores 4 veces mayores cuando se compararon los 3 grupos, tratamiento (A. barbadensis) con el control el día 9 (figura 3).

Los recuentos de plaquetas periféricas también sufrieron cambios al realizar las comparaciones entre grupos, pero éstos sólo fueron significativos el día 14 donde se observó un incremento positivo en favor de Aloe barbadensis (figura 4).

En relación con el análisis histológico de la médula ósea y la influencia del Aloe barbadensis en ésta, la tabla muestra no sólo la rápida recuperación de la celularidad en los grupos tratados con Aloe barbadensis, sino además el comportamiento de ésta el día 2 en el grupo 4 máxima dosis (0,18 mg/kg) donde nunca fue acelular como en el resto de los grupos.
| | |||||
| Grupo | | | | | |
| 1 | Acelular con sangre sinosoidal | Sangre sinosoidal y algunas células mieloides | Hipocelular a normocelular | | |
| 2 | Acelular con sangre sinosoidal | | | | |
| 3 | Sangre sinosoidal y algunas célula mieloides | | | | |
| 4 | Hipocelular con sangre sinosoidal | | | | |
El bazo como órgano hematopoyético importante, que produce fundamentalmente linfocitos y monocitos, también fue estudiado por nosotros. Los resultados revelan una esplenomegalia entre los días 7 y al 14, con un máximo el día 9.
La histología reporta también congestión moderada en todos los casos, no así sucedió con la presencia de nódulos linfáticos gigantes, importantes puntos de actividad linfoproliferativa, donde el grupo 4 máxima dosis de A. barbadensis mostró signos de estimulación al ser comparado con el resto de los grupos.
DISCUSIÓN
En la revisión de la literatura científica realizada encontramos el trabajo de O'rriely y Gamelli13 sobre el uso de un factor recombinante hematopoyético, administrado a ratones que habían recibido una dosis alta de 5-fluoruracilo. En este trabajo ellos reportan también incrementos significativos en el número total de leucocitos, pero con un máximo de estimulación 2 días antes que nosotros: no así sucedió en los estudios de Melcaff,14 donde sólo encontró un incremento de los neutrofilios sin cambios en el total de leucocitos. También se reportan trabajos donde la administración de estos factores provocan eosinofilia ligera,1 lo que coincide con nuestros resultados.El hecho de no existir diferencias en las variables hemoglobina y hematócrito entre los grupos durante el experimento es perfectamente explicable, si tenemos en cuenta que nuestro ensayo sólo duró 14 días; el tiempo de vida media de los hematíes es de 120 días y la ciclofosfamida sólo lesiona preferentemente el comportamiento de células progenitoras y precursores hematopoyéticos, respetando en teoría las células sanguíneas maduras.15 Resultados similares a los de Gamba-Vitalo en un estudio donde fue utilizada la ciclofosfamida como mielosupresor y un factor de crecimiento hematopoyético.12
En relación con los recuentos de reticulocitos los resultados nos hace pensar en un efecto favorable del A. barbadensis en la eritropoyesis, teniendo en cuenta que el aumento de éstos en la periferia se considera en clínica como una respuesta reforzada de la médula sobre la producción de hematíes.16
En general se observa que el A. barbadensis es capaz de influir sobre la proliferación de leucocitos, eritrocitos y plaquetas. Parece ser que este producto actúa sobre células progenitoras en estadios tempranos directa o indirectamente, y contribuye al crecimiento de colonias formadoras de todas estas estirpes celulares; aunque este estudio no permite determinar exactamente el mecanismo de acción del A. barbadensis sobre la hematopoyesis. Es necesario por lo tanto continuar las investigaciones en este sentido.
CONCLUSIONES
El A. barbadensis en dosis de 0,03; 0,10 y 0,18 mg/kg, administrado una vez al día durante 7 días, a ratones tratados con ciclofosfamida provoca un incremento en las células sanguíneas derivadas de la médula ósea.REFERENCIAS BIBLIOGRÁFICAS
- Hillman RS. Agentes hematopoyéticos: factores de crecimiento, minerales y vitaminas. En: Las bases farmacológicas de la terapéutica. 8 ed. Méjico, DF: Editorial Médica Panamericana, 1991:1239-44.
- Moralida Jiménez JM. Anemia aplástica. Aplastia medular. En: Hematología. Madrid: Editorial Luzan, 1990:105-11.
- Shu-Jun L. Cellular interaction in hemapoiesis. Blood Cells 1987;13(1/2):101-4.
- Mohandas N. Cell-Cell interaction and erythropoiesis. Blood Cells 1991;17(1):59-64.
- Galan MC, Gran J, Muñoz M, Castel T, Daniels M, Estape J. Quimioterapia sub ablativa en tumores sólidos. Neoplasia 1995;12(1):11-5.
- Villalobos Martínez E. Informe sobre indicaciones actuales de los factores estimulantes de colonias (G-CSF y GM-CSF). Med Clin (Barc) 1994;102:747-50.
- Marsh JC, Socie G, Schrezenmeier H. Factores de crecimiento hematopoyéticos en la anemia aplástica: un llamamiento a la prudencia. Lancet 1994;25(6):380-1.
- Banet I, Peñarroja C. Estudio de la toxicidad y de la regeneración hematopoyética producido por la quimioterapia adyuvante en pacientes con neoplasia de mamas. Sangre blood 1988;33(3):171-7.
- Cuba. Ministerio de las Fuerzas Armadas Revolucionarias. Compendio de investigaciones sobre el Aloe Barbadensis miller (sábila) cultivada en Cuba (1). La Habana: MINFAR, 1971.
- Estévez A, Plastonova G, Tkachenko G. Cinética de la proliferación celular del adenocarcinoma 755 bajo acción del extracto de Aloe barbadensis. Rev Cubana Farm 1974;8(1):27--36.
- Villar J. Recomendaciones de la declaración de Helsinki sobre investigaciones clínicas y guías principales en el cuidado y uso de los animales. Med Clin (Barc) 1988;91:702--3.
- Gamba-Vittalo C. Effects of recombinat murine granulocyte--macrophage colony-stimulating factor en cyclophosphamide treated mice. Blood Cells 1991;17:198-205.
- O'Reilly M, Gamelli RL. Recombinante granulocyte-macrophage colony stimulating factor improves hematopoietic recoveri after 5-fluoruracil. J Surg Res 1988;45:104-11.
- Metcalf D, Begly CG, Williamson DJ, Nice EC, De Lamarter J et al. Hematopoietic responses in mice injected with purified recombinant GM-CSF. Exp Hematol 1987;15:1-9.
- Henry S. Biología de la neoplasia. En: Fisiopatología. Buenos Aires: Editorial Médica Panamericana, 1986:252.
Lic. José de la Paz Naranjo. Instituto de Medicina Militar "Dr. Luis Díaz Soto". Avenida Monumental y Carretera de Asilo, Habana del Este, cp. 11700, Ciudad de La Habana, Cuba.
1 Licenciado en Bioquímica. Aspirante a Investigador.
2 Especialista de I Grado en Anatomía Patológica. Aspirante a Investigador.
3 Especialista de I Grado en Farmacología. Instructor.
4 Técnica(o) en Investigaciones.














