Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med v.5 n.1 Ciudad de la Habana ene.-abr. 2000
Método analítico para la cuantificación de taninos en el extracto acuoso de romerillo
Lic. Humberto Lastra Valdés,1 Lic. Eduardo Rodríguez Leyes,2 Lic. Heidy Ponce de León Rego2 y Téc. María Lidia González Sanabia3RESUMEN
Se desarrolló un método analítico para la cuantificación de taninos en el extracto acuoso de romerillo (EAR) y se utilizó la espectrofotometría ultravioleta-visible donde las muestras son leídas a 700 nm y su absorbancia referida a ácido tánico. La curva de calibración para el rango de concentraciones comprendidas entre 4 y 16 ppm fue lineal tanto para la sustancia química de referencia, ácido tánico, como para el EAR con coeficientes de correlación superiores a 0,9900 en ambos casos; además las pruebas estadísticas del intercepto y la pendiente resultaron ser no significativas. La precisión dada como repetibilidad fue satisfactoria con un coeficiente de variación (CV) igual a 2,30 % para 12 réplicas de ensayo, mientras la reproducibilidad cumplió con los criterios establecidos internacionalmente ya que el coeficiente de variación fue de 2,94 %. El recobrado resultó ser superior al 99 % en los rangos de concentración estudiados y cumple además las pruebas "G" de Cochran y "T" de Student. El método resultó ser selectivo, lineal, preciso y exacto.Descriptores DeCS: PLANTAS MEDICINALES; MEDICINA TRADICIONAL; TANINOS; ESPECTROFOTOMETRIA ULTRAVIOLETA.
SUMMARY
Authors developed an analytical method to quantification of tannins in aqueous extract from Bidens pilosa L. (romerillo) using visible-ultraviolet spectrophotometry, where samples are readed at 700 nm, and its absorbance is referred to tanic acid. Calibration curve for rank of concentrations, included between 4 and 16 ppm, was linear both for reference chemicals (tanic acid) and for aqueous extract from Bidens pilosa L. (romerillo), with correlation coeficients above 0,9900 in two cases; furthermore, statistical tests of interception and slope weren´t significant. Precision given as repeatibility was satisfactory with a variation coefficient (VC) equal to 2,30 % for 12 assays, whereas repetibility fulfills the internationally stablished criteria since variation coeficient was of 2,94 %. Recovery was superior to 99 % in studied concentration ranks and fulfils the "G" Cochran´s and "T" Student´s tests. Method was selective, linear, precise, and accurate.Subject headings: PLANTS, MEDICINAL; MEDICINE, TRADITIONAL; TANNINS; SPECTROPHOTOMETRY, ULTRAVIOLET.
En las últimas décadas los fitofármacos han ido ganando terreno dentro del arsenal terapéutico mundial, fundamentalmente por su escasa toxicidad, bajos costos y por utilizar tecnologías de bajos niveles de inversión e insumos. Todo esto se refleja en el reconocimiento de la importancia de los programas nacionales de medicina tradicional realizado por la OMS en 1991,1 lo cual a su vez ha incidido poderosamente en la expansión, desarrollo y consolidación de la producción de dichos medicamentos. Baste saber que el 80 % de la población mundial utiliza plantas para el tratamiento de las enfermedades y en los países industrializados el 35 % de los medicamentos prescritos contienen principios activos de origen natural (Hostettman K. Curso Iberoamericano sobre Estrategias de Aislamiento en Productos Naturales. Universidad de Panamá, Panamá. Agosto de 1994). Todo lo anterior da una medida de la importancia de los fitofármacos para los países del tercer mundo; por su parte en Cuba se le ha dado una importancia estratégica a los mismos y se ha ido desarrollando todo un sistema que abarca desde la agrotecnia de la especie vegetal hasta la confección del producto terminado y su registro.
Dentro de los diversos fitofármacos en desarrollo se encuentra la solución viscosa de romerillo blanco, con propiedades antiulcerosas comprobadas2 y propuesta para el tratamiento de las úlceras gastroduodenales. La parte activa de dicho producto es el extracto acuoso de romerillo (EAR). El presente trabajo tiene como objetivo el desarrollo de un método analítico espectrofotométrico para la cuantificación de los taninos en el mismo, que sustituya al método volumétrico actualmente en uso, el cual no es preciso, tiene una alta dependencia del analista y es muy laborioso.
Este método se basa en la reacción de los compuestos fenólicos con el reactivo de Folin (tungsto-fosfomolíbdico; carbonato de sodio al 20 %), el cual produce un complejo de color azul, cuya extinción es medida a 700 nm, determinando el contenido total de fenoles. Posteriormente se utiliza una solución de gelatina al 25 % para garantizar el secuestro de los taninos, obteniéndose de la diferencia de ambas determinaciones el porcentaje de taninos reportados como ácido tánico.
MÉTODOS
Material vegetalEl material vegetal utilizado, Bidens pilosa L. (romerillo), fue colectado en la Estación Experimental de Plantas Medicinales "Juan T. Roig", de Güira de Melena, provincia La Habana. Se empleó para el estudio las partes aéreas de la misma en la etapa de floración-fructificación, secadas en estufa de aire recirculado a temperaturas por debajo de 58 °C y trituradas en molino de martillo, correspondiente al lote de Nov. de 1997. La calidad de la droga fue certificada según la norma ramal de Salud Pública 355.3
Obtención y evaluación del extracto acuoso de romerillo
La obtención del EAR, así como su evaluación física y química fue realizada según la norma ramal de Salud Pública 357.4
Sustancia de referencia. Como sustancia de referencia se utilizó ácido tánico puro para análisis de la firma Merck.
Para la medición de la absorbancia se empleó un espectrofotómetro UV-VIS SPECTRONIC GENESYS 2PC.
Método espectrofotométrico para la cuantificación de taninos en el extracto acuoso de romerillo
El método en cuestión consta de 2 etapas: la etapa (A) donde se cuantifican los polifenoles totales en el extracto acuoso, y la etapa (B) donde se cuantifican los polifenoles residuales después del secuestro de los taninos con gelatina.
Muestra de ensayo (A): se midieron exactamente 4 mL del extracto y fueron transferidos a un matraz aforado de 250 mL, diluyendo con agua destilada hasta enrase. De la solución anterior se tomaron porciones de 5 mL y se llevaron a matraces de 25 mL, adicionando posteriormente 4 mL de agua destilada.
Muestra de ensayo (B): Se midieron exactamente 20 mL del extracto y fueron transferidos a un matraz aforado de 250 mL con tapa, adicionándole posteriormente 80 mL de agua destilada, 50 mL de solución de gelatina al 25 %, 100 mL de solución saturada de cloruro de sodio acidificada y 10 g de caolín; todos los reactivos fueron de calidad para análisis. Se tapó y agitó durante 30 min, dejándose reposar para posteriormente filtrar. Del filtrado se toman 10 mL y se transfieren a un matraz aforado de 50 mL completando con agua destilada. Luego se tomaron 5 mL y se llevaron a un volumétrico de 25 mL, adicionando posteriormente 4 mL de agua destilada.
Sustancia de referencia
Se pesó con precisión 25 mg de ácido tánico, se transfirieron a una matraz aforado de 100 mL y se completó el volumen con agua destilada. Posteriormente se midieron exactamente 20 mL y se pasaron a un matraz aforado de 100 mL enrasando con agua destilada. De la solución anterior se transfirieron 4 mL a un matraz aforado de 25 mL y se le añadieron 2 mL de agua destilada.Blanco (A): Se añaden 5 mL de agua destilada a un matraz aforado de 25 mL.
Blanco (B): Se adicionaron 100 mL de agua destilada, 50 mL de solución de gelatina al 25 %, 100 mL de solución saturada de cloruro de sodio acidificada y 10 g de caolín en un erlenmeyer de 250 mL con tapa. Se tapó y agitó durante 30 min, se dejó reposar para posteriormente filtrar. Del filtrado se tomaron 10 mL y se transfirieron a un matraz aforado de 50 mL, enrasando con agua destilada, del que se tomaron 5 mL y se llevaron a un volumétrico de 25 mL.
Solución tungsto-fosfomolíbdico. Se disolvieron 10 g de tungstato de sodio dihidratado, 0,2 g de ácido fosfomolíbdico hidratado y 5,0 mL de ácido fosfórico al 85 % en 75 mL de agua destilada. La solución se reflujó por 2 h y se completó con agua destilada a 100 mL.
Desarrollo de color: A cada matraz aforado de 25 mL, con las respectivas muestras, patrones y blancos, se le añadieron 2 mL de solución tungsto-fosfomolíbdico, se agitó y se dejó reposar durante 5 min. Luego se añadió 1 mL de solución de carbonato de sodio al 20 %, se agitó, enrasó con agua destilada y homogenizó. Leer la absorbancia de dichas soluciones a 700 nm después de transcurridos 2 min.
Validación del método propuesto
Para la validación del método propuesto se siguieron normativas reconocidas de validación.5,6
Especificidad
La especificidad del método está basada en la especificidad de la gelatina por los taninos,7,8 por lo cual los taninos son determinados por la diferencia de absorbancia entre el EAR y el EAR libre de taninos.Con el objetivo de corroborar la eficacia del secuestro de los taninos por la gelatina, se hizo un estudio por cromatografía en capa delgada (CCD). En dicho estudio tanto el extracto acuoso de romerillo (A), como el extracto acuoso tratado con gelatina fueron evaluados con reactivos específicos de compuestos fenólicos y con el reactivo de Folin, el cual es empleado en el desarrollo de color del método que se muestra.
En el estudio por CCD, se puntearon 10 microlitros del extracto acuoso y del extracto tratado con gelatina, así como de la sustancia de referencia, ácido tánico, y el filtrado del mismo secuestrado con gelatina, en placas de sílica gel GF 254 y corriéndolas en la fase móvil butanol-ácido acético-agua 4:1:5 (BAW). Se desarrolló una segunda CCD para el extracto acuoso de romerillo secuestrado con gelatina empleando las mismas placas y ácido acético al 15 % como fase móvil.
Para visualizar las manchas se emplearon las longitudes de onda de 254 y 366 nm.
Para detectar polifenoles se utilizaron reveladores, entre ellos:
II - S.R. cloruro de hierro III al 5 % en ácido clorhídrico 0,5 mol/L
III - S.R. folin.
IV - S.R. nitrato de plata en acetona.
Linealidad
Para comprobar la linealidad del método analítico se probó la linealidad de la sustancia de referencia (ácido tánico) en un rango de concentraciones de 4 a 16 ppm, calculándose la recta de regresión, el coeficiente de correlación, el coeficiente de variación de los factores respuestas, y los tests de linealidad y proporcionalidad. Los resultados fueron procesados por el programa Microcal Origin versión 4.0.La linealidad para las etapas A y B del método fueron analizadas en el mismo rango de la sustancia de referencia, realizándole las mismas evaluaciones.
Precisión
La respetabilidad se comprobó con 12 réplicas de ensayo, evaluándose el coeficiente de variación.Para el análisis de la reproducibilidad se realizaron 6 réplicas por analistas, en 2 d de análisis, realizándose 12 determinaciones en total, a las cuales se les determinó el coeficiente de variación y las pruebas estadísticas de Fisher y Student.
Exactitud
Para el estudio de la exactitud se empleó el método de adición de patrón a diferentes niveles (6,8 y 10 ppm). Aplicándose las pruebas "t" de Student y la "G" de Cochran para determinar si existen diferencias significativas entre la recuperación media y el 100 % y si el factor concentración tiene alguna influencia en los resultados.Resultados
Especificidad
El resultado del cromatograma realizado al extracto acuoso de romerillo en silicagel GF 254, empleando como fase móvil el sistema BAW 4:1:5 y revelando con los agentes reveladores señalados puede observarse en la figura 1, donde se observa que los Rf obtenidos con los diferentes reveladores coinciden, exceptuando la mancha de Rf = 0,22 que solo aparece con el reactivo de Folin y con solución de nitrato de plata en acetona.
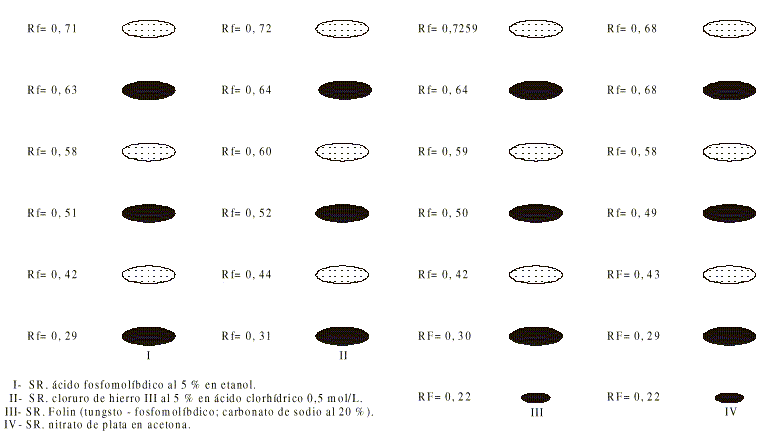
FIG. 1. Cromatograma obtenido para el extracto acuoso de romerillo en el sistema BAW 4:1:5.
En el caso de ambos secuestros (ácido tánico y extracto acuoso), no se obtuvo coloración con los reactivos empleados.
El cromatograma realizado al patrón de ácido tánico con los distintos reveladores en el sistema BAW 4:1:5 se muestra en la figura 2.
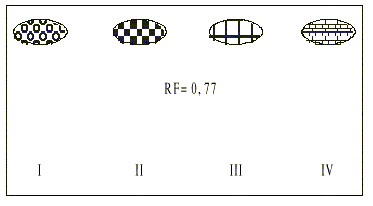
FIG. 2. Cromatograma obtenido para el ácido tánico empleando el sistema BAW 4:1:5.
El extracto acuoso de romerillo secuestrado se sometió al sistema HAc al 15 %, para detectar posibles manchas que no corrían en el sistema BAW 4:1:5, obteniéndose una mancha de Rf = 0,6 al revelar con el reactivo de Folin. Con el resto de los reveladores no se observó ninguna coloración (figura 3). El espectro UV entre 200 y 400 nm de dicha mancha raspada y extraída con agua y NaOH 1M, no mostró bandas características de grupos fenólicos, los cuales aparecen entre 211 y 270 nm.

FIG. 3. Cromatograma obtenido para el extracto acuoso secuestrado con gelatina en el sistema HAc al 15 %.
Linealidad
La curva de calibración del ácido tánico en el rango de concentraciones estudiadas responde a la ecuación y = 0,03388x + 0,00817 y a un coeficiente de correlación igual a 0,99887. Al realizar la significación estadística de la varianza de la pendiente se rechazó la hipótesis Ho: (b=0) y el cero quedó incluido en el intervalo de confianza del término independiente. Los factores respuestas fueron similares entre sí y cercanos al valor de la pendiente y su coeficiente de variación fue de 2,00 % (tabla 1).| x (ppm) | | | |
| 4 | | | |
| 8 | | | |
| 10 | | | |
| 12 | | | |
| 16 | | |
La curva de calibración para la etapa A del método en el rango de concentraciones estudiadas responde a la ecuación y = 0,1085x + 0,0294 y a un coeficiente de correlación 0,99978. Al realizar la significación estadística de la varianza de la pendiente se rechazó la hipótesis Ho: (b = 0) y el cero quedó incluido en el intervalo de confianza del término independiente. Los factores de respuesta fueron similares entre sí y cercanos al valor de la pendiente y su coeficiente de variación fue 2,90 % (tabla 2).
| x (mL) | y (Abs) | f (y/x) | |
| 2 | 0,244 | 0,122 | c.v.f.= 2,9 % |
| 3 | 0,354 | 0,118 | |
| 4 | 0,469 | 0,117 | criterio c.v.f. £ 5 % |
| 5 | 0,573 | 0,115 | |
| 6 | 0,677 | 0,113 |
La curva de calibración para la etapa B en el rango de concentraciones estudiadas responde a la ecuación y= 0,0414 x + 0,0123 y a un coeficiente de correlación igual a 0,9900. Al realizar la significación estadística de la varianza de la pendiente se rechazó la hipótesis Ho: (b = 0) y el cero quedó incluido en el intervalo de confianza del término independiente. Los factores respuestas fueron similares entre sí y cercanos al valor de la pendiente y su coeficiente de variación fue de 3,12 (tabla 3).
| x (mL) | | | |
| 2 | | | |
| 3 | | | |
| 4 | | | |
| 5 | | | |
| 6 | | |
Precisión
El coeficiente de variación de las 12 réplicas de ensayo para el estudio de repetibilidad fue de 2,30 % (tabla 4) y 2,94 % (tabla 5) en el caso de la reproducibilidad; realizándose en este último los tests de Fisher y Student de los cuales se obtuvieron los valores 2,66 y 0,14 respectivamente.
| % de réplica | % de taninos | |
| 1 | 0,2634 | |
| 2 | 0,2769 | n = 12 |
| 3 | 0,2760 | |
| 4 | 0,2760 | x = 0,2708 |
| 5 | 0,2769 | |
| 6 | 0,2643 | Sd = 0,006232 |
| 7 | 0,2635 | |
| 8 | 0,2770 | c.v.= 2,30 % |
| 9 | 0,2761 | |
| 10 | 0,2707 | criterio c.v. £ 3 % |
| 11 | 0,2644 | |
| 12 | 0,2644 |
| Día | | ||
| | | | |
| | | ||
| 1 | | | |
| | | ||
| | | | |
| 2 | | | |
| | | | |
| x | | | |
0,1458 < 1,82
t calculada < t tabulada (GL = 10; p = 0,05), no existen diferencias estadísticamente significativas.
Prueba de Fisher
2,66 < 5,05
Exactitud
De los resultados de recuperación en por ciento se obtuvo una "t" de Student igual a 0,26 (tabla 6). Al aplicar la prueba de Cochran el valor de la "G" experimental resultó 0,44 (tabla 6).
| Concentración ppm | de repercusión | |
| 6 | | |
| 8 | | |
| 10 | | |
| Recuperación media (n = 9) | | |
0,26 < 1,86
texp < ttab (p = 0,05, GL= 8) no existen diferencias estadísticamente significativas.
Prueba de Cochran
0,44 < 0,87
Gexp < Gtab (p = 0,05, k = 3, n = 3) no existen diferencias estadísticamente significativas.
DISCUSIÓN
Los resultados de los cromatogramas realizados al extracto de romerillo y al extracto tratado con gelatina demuestran que todos los compuestos detectados en el extracto sin tratar tienen características fenólicas y que pertenecen al grupo de los taninos, ya que no aparecen en el extracto tratado con gelatina, en el cual aparece solo una mancha que no tiene carácter fenólico como se demostró mediante el espectro UV de la mancha aislada del extracto tratado con gelatina, pero que sí reacciona con el reactivo de Folin ocasionando la absorción a 700 nm que se observa en el extracto acuoso (B).Todo lo anteriormente expuesto demuestra que en el extracto acuoso de romerillo tratado con gelatina (B), no existen compuestos fenólicos, y que por tanto todos estos compuestos son del tipo tanino ya que fueron absorbidos por el tratamiento con gelatina, lo cual confirma lo planteado en la literatura en cuanto a la especificidad de la gelatina por los taninos.
Las curvas de calibración en el rango de concentraciones estudiadas tanto del patrón como las del extracto en las etapas A y B, demostraron ser lineales por tener coeficientes de correlación superiores a 0,990, cumplir con las pruebas de significancia estadística de la varianza de la pendiente y el límite de confianza del intercepto; además se obtuvo un coeficiente de variación de los factores respuesta inferior al 5 %, que es el límite establecido para el caso en los métodos espectrofotométricos.
Los coeficientes de variación de los estudios de repetibilidad y reproducibilidad cumplen con los criterios de la USP XXIII y de la Monografía AEFI. Los tests de Fisher y Student en el estudio de reproducibilidad no presentaron diferencias significativas con respecto a los valores tabulados (5,05 y 1,82 respectivamente) comprobándose así la precisión del método.
Los valores obtenidos como resultados de los tests de Student y de Cochran realizados a los por cientos de recuperación fueron inferiores a los tabulados (1,86 y 0,87 respectivamente), quedando demostrada así la exactitud del método propuesto.
De todo lo anteriormente expuesto se afirma que se ha desarrollado un método espectrofotométrico que permite la cuantificación de los taninos presentes en el extracto acuoso de romerillo, resultando el mismo selectivo, preciso, exacto, y de mayor sencillez que el empleado hasta el momento para dichos fines.
REFERENCIAS BIBLIOGRÁFICAS
- WHO. Pautas para la evaluación de medicamentos herbarios. Ginebra, 1991:1-2.
- Álvarez A, Robaina Y, Sánchez E, Cuevas M. Efecto antiulceroso de una solución viscosa oral a partir de un extracto de Bidens pilosa L. (romerillo) en ratas. Rev Cubana Plant Med 1996;1(1):25-9.
- Cuba. Ministerio de Salud Pública. Hierba de Romerillo. Especificaciones. NRSP-355. 1993:1-4.
- . Extracto acuoso de romerillo. Especificaciones. NRSP-357. 1994:1-6.
- United States Pharmacopoeia XXIII and National Formulary XVIII. Rockville: United States Convention, 1995:198.
- Castro M, Gascon S, Pujol M, Sans J, Vicent L. Validación de métodos analíticos. Edición Hewlett Packard, 1989:19-42.
- Horwitz Wed. Official Methods of Analysis of the Association of official Analytical Chemists. 11 ed. Washington, DC:AOAC, 1970:241-2.
- Makkor H. Protein precipitation methods for quantitation of tannins. J Agric Food Chem 1989;37(4):197-202.
Recibido: 24 de noviembre de 1999. Aprobado: 11 de diciembre de 1999.
Lic. Humberto Lastra Valdés. Centro de Investigaciones y Desarrollo de Medicamentos (CIDEM). Avenida 26, número 1605, entre Boyeros y Puentes Grandes, Ciudad de La Habana. Cuba. CP10600.
1 Licenciado en Química. Investigador Auxiliar.
2 Licenciado en Ciencias Farmacéuticas.
3 Técnico Medio en Química Analítica.














