Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med v.5 n.2 Ciudad de la Habana Mayo-ago. 2000
Centro de Investigación y Desarrollo de Medicamentos (CIDEM). Departamento de Investigaciones Biológicas
Toxicidad aguda oral de 3 formas farmacéuticas a partir de Cassia grandis L.
Lic. Alicia Lagarto Parra1 y Téc. María Isbel Guerra Sardiñas2RESUMEN
Cassia grandis L. popularmente conocida como Cañandonga, es un árbol al cual se le atribuyen propiedades antianémicas. Para el uso medicinal de esta especie se elaboraron 3 formas farmacéuticas las cuales se nombraron Ferroscassia droga seca, polvo para infusión e instaferross. En el presente estudio se evaluó la toxicidad aguda oral de estas 3 formulaciones con el objetivo de avalar su posterior uso en humanos. Dicha evaluación se llevó a cabo en un ensayo de prueba límite a una dosis de 2 000 mg/kg de peso corporal en ratas Wistar de ambos sexos por vía oral. El estudio agudo realizado demostró que las 3 formulaciones ensayadas pueden clasificarse como no tóxicas ya que no se evidenció toxicidad alguna a la dosis administrada.Descriptores DeCS: PLANTAS MEDICINALES; RATAS DE CEPAS CONSANGUINEAS; MEDICINA TRADICIONAL; TESTS DE TOXICIDAD.
SUMMARY
Cassia grandis L. (folk name: Cañandonga), is a tree with attributable antianemic properties. For medicinal use of this plant, we processed three pharmaceutical forms, which were named as dry drug Ferroscassia, infusion powders, and instaferross. In present study, oral acute toxicity of these three formulations was assessed to guarantee subsequent use in humans. Such assessment was done in a trial of limit test at a dose of 2 000 mg/kg of body weight (bw) in Wistar rats of both sexes. Acute study, carried out, showed that the three formulations tested, may be classified as non-toxic since it wasn´t demonstrate toxicity using doses above mentioned.Subject headings: PLANTS, MEDICINAL, RATS, INBRED STRAINS; MEDICINE TRADITIONAL; TOXICITY TESTS.
Cassia grandis L. Es un árbol de hasta 30 metros de alto con extensas ramas nativo de Centro América, Caribe y norte de Sudamérica, encontrándose en terrenos abiertos, bordes de caminos y pastizales.1,2
Las hojas contienen antraquinonas (aloe-emodina, ácido crisofánico, fisción, reína),3 barakol, flavonoides (kampferol), leucoantocianinas y saponinas. En el fruto se ha encontrado ácido cinámico y azúcares. Las semillas contienen flavonoides y polisacáridos.4
Usos medicinales atribuidos
La decocción de hojas, fruto y corteza se usa por vía oral para tratar la anemia,5 hemorragia nasal, enfermedades del hígado, infección urinaria, histeria, resfrío y tos.1,2 Por vía tópica se aplica un ungüento de hojas para tratar afecciones dermatomucosas (herpes, llagas, tiña, vitiligo).6 De la raíz se extrae un líquido antiséptico utilizado en la cura de heridas,7 la corteza es utilizada como cicatrizante.4
A las hojas y fruto se le atribuye propiedad antianémica, antimicótica, antiséptica, astringente, depurativa, diurética, estimulante, expectorante, febrífuga, galactogoga, laxante, mineralizante, pectoral, purgante, sedante1,5-7 y tónica. A la raíz se le atribuye propiedad febrífuga, purgante y tónica.4
Farmacología experimental
Estudios antimicrobianos demuestran que la tintura de hojas es activa contra P. Aeruginosa, S. Pyogenes y S. Aureus, con una concentración mínima inhibitoria (CIM) de 50 mg/mL. Es inactiva contra C. Albicans.4
La decocción de hojas es activa contra E. Floccosum, M. Gypseum, T. Mentagrophytes y T. Rubrum, con una CIM de 300-500 mg/mL; presenta actividad fungicida y fungistática.8
Se ha demostrado que la infusión de las hojas no tiene actividad diurética en ratas.4
Toxicología
En la literatura no se encuentra referencias sobre la toxicidad de esta planta, aunque se plantea que la pulpa del fruto posee propiedades abortivas.4
Principalmente debido al uso como antianémico se elaboraron 3 formulaciones a partir de esta planta con vistas al uso clínico, para lo cual fue necesario evaluar su toxicidad aguda, siendo objetivo del presente estudio la determinación de la toxicidad aguda oral mediante el ensayo límite de la Ferroscassia droga seca, Polvo para infusión y el Instaferross.
MÉTODOS
Sustancia de pruebaFerroscassia droga seca, lote 980101.
Ferroscassia polvo para infusión, lote FC981101.
Ambos preparados a partir del fruto de la planta.
Instaferross, lote: FC981101.
Contiene la droga seca preparada a partir del fruto de la planta, azúcar y saborizante.
Lugar de procedencia: Delegación Provincial CITMA. Bayamo.
Animales
Para la determinación de la toxicidad aguda se utilizaron ratas Wistar de ambos sexos procedentes de la colonia del Laboratorio Control Biológico con una masa corporal comprendida entre 150 y 200 g, los cuales fueron mantenidos en un cuarto a temperatura controlada de 20 ± 2 °C con un ciclo de luz/oscuridad de 12-12 h. La alimentación consistió en ratonina peletizada y agua a voluntad.
Ensayo de toxicidad aguda
Debido a la pobre toxicidad reportada en la literatura acerca de esta planta se procedió a realizar la prueba límite,9 por lo que a los grupos que recibieron tratamiento se les administró la muestra a una dosis de 2000 mg/kg.
Se confeccionaron grupos de 5 animales cada uno de ambos sexos para cada tratamiento y un grupo control que no recibió tratamiento. Los animales fueron identificados individualmente para la dosificación exacta de acuerdo a su peso corporal mediante un sistema de marcaje con ácido pícrico.
En el caso de la Ferroscassia droga seca y Polvo para la infusión se preparó una infusión al 25 %, el Instaferross se suspendió al 25 % en carboximetilcelulosa 0,5 % para su posterior administración, la cual se llevó a cabo por vía oral mediante cánula intragástrica, retirándole la comida a los animales 16 h antes de la administración.
Los animales fueron observados constantemente durante las primeras 24 h, y se continuó la misma diariamente durante un período de 14 d, registrando cualquier síntoma tóxico. Al finalizar este período se procedió al sacrificio por asfixia bajo atmósfera de éter para realizarles la autopsia, efectuándose un examen macroscópico de órganos, tejidos y la extracción de: corazón, riñón, bazo, pulmón, hígado, ovarios y testículos para la determinación de su peso relativo.
El peso corporal se controló al inicio, a los 7 d y al final del experimento.
Análisis estadístico
Los resultados se expresaron como la media ± desviación standard. Los valores de peso corporal y peso relativo de órganos se analizaron estadísticamente mediante un análisis de varianza de una vía de clasificación.
RESULTADOS
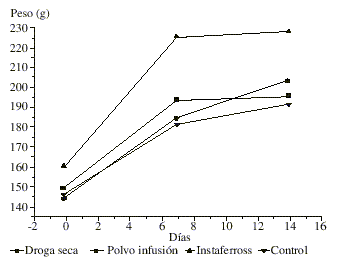
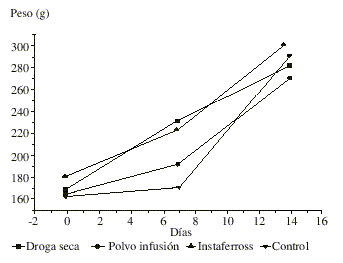
No se observaron síntomas tóxicos a la dosis administrada, tampoco se presentó mortalidad en el período de observación, ni decremento en el peso corporal en ninguno de los grupos experimentales durante el estudio, para ambos sexos ( figs. 1 y 2).En la autopsia realizada no se encontraron evidencias de alteraciones patológicas en los órganos analizados para hembras y machos. En la tabla se muestran los valores del peso relativo de los órganos los cuales no mostraron diferencias significativas con respecto al grupo control al ser vistos por un análisis de varianza de una vía.
Fig. 2. Comportamiento del peso corporal durante el estudio. Machos.
| Grupos | Corazón | Riñones | Hígado | Bazo | Pulmón | Testículos | Ovarios |
| Ferroscassia droga seca, hembras | 0,400 ± 0,037 | 0,836 ± 0,081 | 4,228 ± 0,407 | 0,236 ± 0,022 | 0,816 ± 0,088 | 0,066 ± 5,48E-03 | |
| para Ferroscassia polvo infusión, hembras | 0,412 ± 0,032 | 0,844 ± 0,036 | 3,974 ± 0,285 | 0,248 ± 0,019 | 0,854± 0,133 | 0,070 ± 0,012 | |
| Instaferross, hembras | 0,390 ± 0,012 | 0,782 ± 0,022 | 4,358 ± 0,184 | 0,235 ± 0,017 | 0,678 ± 0,077 | 0,055 ± 5,77E-03 | |
| Control, hembras | 0,414 ± 0,026 | 0,844 ± 0,063 | 3,762 ± 0,184 | 0,274 ± 0,031 | 0,820 ± 0,131 | 0,056 ± 5,48E-03 | |
| Ferroscassia droga seca, machos | 0,330 ± 0,020 | 0,806 ± 0,038 | 4,178 ± 0,494 | 0,222 ± 0,030 | 0,698 ± 0,136 | 1,220 ± 0,190 | |
| Ferroscassia polvo para infusión, machos | 0,348 ± 0,030 | 0,766 ± 0,042 | 3,062 ± 0,202 | 0,232 ± 0,037 | 2,802 ± 4,926 | 1,002 ± 0,134 | |
| Instaferross, machos | 0,320 ± 0,014 | 0,715 ± 0,065 | 4,315 ± 0,376 | 0,208 ± 0,081 | 0,608 ± 0,116 | 1,003 ± 0,158 | |
| Control machos | 0,352 ± 0,025 | 0,786 ± 0,046 | 3,708 ± 0,288 | 0,212 ± 0,038 | 0,654 ± 0,108 | 1,115 ± 0,217 |
DISCUSIÓN
Las 3 formulaciones a partir de Cassia grandis L. Ensayadas en este estudio no mostraron toxicidad alguna después de la administración aguda de una dosis límite (2 000 mg/kg), lo cual está evidenciado por la carencia de mortalidad y síntomas tóxicos, además de no existir alteración alguna en el resto de los parámetros evaluados, como son el comportamiento del peso corporal y el análisis macroscópico de órganos y tejidos.De igual modo, este ensayo no mostró ninguna diferencia entre sexos, siendo los resultados obtenidos similares para hembras y machos.
De acuerdo a las clases de toxicidad de la Comunidad Europea las 3 formas farmacéuticas a partir de Cassia grandis L. no son tóxicas ya que presentan una DL50 mayor que 2 000 mg/kg entrando en el rango de no clasificado.10
La Ferroscassia droga seca, Polvo para infusión, e Instaferros resultaron no tóxicas en el ensayo de toxicidad aguda oral en ratas, por presentar una DL50 mayor de 2 000 mg/kg.
REFERENCIAS BIBLIOGRÁFICAS
- Standley PC, Steyermark JA. Flora of Guatemala. Fieldiana 1946;24(5):116.
- House P, Lagos-Witte S. Manual de 50 plantas medicinales de Honduras. Tegucigalpa: CONSH/CIIR/UNAH. 1989:48.
- Glasby JS. Dictionary of plants containing secondary metabolites. London: Taylor and Francis, 1991:67.
- Cáceres A. Plantas de uso medicinal en Guatemala. San Carlos de Guatemala: Editorial Universitaria, 1996:115-6.
- Morton JF. Some folk-medicine plants of Central American Markets. Quart J Crude Drug Res 1977;15:165-92.
- Nelson CH. Plantas comunes de Honduras. Tegucigalpa: Editorial Universitaria, 1986:264.
- Guzmán DJ. Especies útiles de la flora salvadoreña. San Salvador: Ministerio de Educación, 1975:43.
- Cáceres A, López B, Girón M, Logemann H. Plants used in Guatemala for the treatment of dermatophytic infections. I. Screening for antimycotic activity of 44 plants extracts. J Ethnopharmacol 1991;31:263-76.
- OECD. Guidline for Testing of Chemicals. 401 Acute Oral Toxicity: 1987.
- Commission of the European Communities. Annex to Commission Directive 92/69/EEC of 31 July 1992 adapting to technical progress for the seventeenth time Council Directive 67/548/EEC on the approximation af laws, regulations and administrative provisions relating to the classification, packaging and labelling of dangerous substances. B. 1 Acute toxicity (oral). Off J Eur Comm 1992;35:110-2.
Recibido: 6 de julio del 2000. Aprobado: 12 de septiembre del 2000.
Lic. Alicia Lagarto Parra. Centro de Investigación y Desarrollo de Medicamentos. Departamento de Investigaciones Biológicas. Calle 17 No. 6208 entre 62 y 64. Playa. Ciudad de La Habana, Cuba.
2 Técnico medio en química.