Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med v.2001 n.1 Ciudad de la Habana ene.-abr. 2001
Instituto Superior de Medicina Militar Dr. Luis Díaz Soto
Efecto antiviral del extracto acuoso de Aloe barbadensis contra el virus de la hepatitis B
Dra. Edelis Castellanos Puerto,1 My Mireida Rodríguez Acosta,2 Lic. Tatiana Vázquez González3 y Lic. Adriana Sin Mayor4
RESUMEN
Se realizó un experimento in vitro e in vivo utilizando el virus salvaje de la hepatitis B y ratones balb/c transgénicos para evaluar la acción antiviral del Aloe barbadensis Miller (sábila). Se trabajó con concentraciones de Aloe b. M de 0,1; 0,2 y 0,3 mg/mL que se enfrentaron a una concentración fija del estándar de antígeno del virus de la hepatitis B de 83,75 Ng/mL durante 24, 48, 72 h; 7, 14 y 21 d. Las cuantificaciones del antígeno se realizaron por un ensayo inmunoenzimático (ELISA) tipo sandwich. Se comprobó que la mejor actividad antiviral se obtuvo a los 21 d, se utilizó una concentración de 0,3 mg/mL por lo que se aplicó al grupo de ratones transgénicos y se obtuvo una disminución de la expresión antigénica del virus comparado con el grupo de transgénicos que se trató con agua bidestilada.
DeCS: EXTRACTOS VEGETALES/uso terapéutico; MEDICINA HERBARIA; PLANTAS MEDICINALES; ANTIGENOS DE SUPERFICIE DE LA HEPATITIS B; VIRUS DE LA HEPATITIS B; HEPATITIS B/quimioterapia; AGENTES ANTIVIRALES/uso terapéutico; ALOE/ uso terapéutico; RATONES TRANSGENICOS; TEST DE ELISA.
SUMMARY
An in vitro and in vivo experiment was made by using hepatitis B wild virus and transgenic balb/c mice in order to assess the antiviral action of Aloe barbadensis Miller (sábila). We used concentrations of Aloe b. M of 0,1; 0,2; and 0,3 mg/mL against a fixed concentration of the hepatitis B virus antigen standard of 83,75 Ng/mL during 24, 48, 72 hours; 7, 14 and 21 days. Antigen quantifications were carried out by sandwich-type enzime-linked immunosorbent assay (ELISA). As the best antiviral activity was achieved at 21 days, using a 0,3 mg/mL concentration, it was given to the transgenic mice group. A decrease of the virus antigenic expression was obtained compared with the group of transgenic mice that was treated with bi-distilled water.
Subject headings: PLANT EXTRACTS/therapeutic use: MEDICINE, HERBAL; PLANTS, MEDICINAL; HEPATITIS B SURFACE ANTIGENS; HEPATITIS B VIRUS; HEPATITIS B/drug therapy; ENZIME-LINKED IMMUNOSORBENT ASSAY; ANTIVIRAL AGENTS/therapeutic use; ALOE/therapeutic use; MICE, TRANSGENIC.
El Aloe barbadensis Miller, nombre científico de la conocida sábila ha ganado el interés de los investigadores de varias ramas de la ciencia por sus múltiples efectos ya conocidos desde tiempos antiguos; sobre la piel como cicatrizante, para el tratamiento de las infecciones gastrointestinales y urinarias, para las quemaduras, entre otras.1-5 Muchas de las acciones terapéuticas importantes del Aloe b. M se han estudiado con bastante seriedad en diversas partes del mundo, por lo que en la actualidad su uso se ha extendido al campo de la inmunología moderna por la acción inmunomoduladora que presenta. Por sus antecedentes en la práctica clínica, específicamente con la variedad cubana de Aloe b. M se han hecho evaluaciones de la actividad linfoblastogénica, de la fagocitosis, y de la actividad antiviral mediante pruebas de educción de placas de neutralización y la evaluación de la actividad virucida in vitro e in vivo.5
Teniendo en cuenta lo antes planteado y por la experiencia desde el punto de vista clínico de los beneficios del Aloe b M, de su acción sobre herpes simples virales, condilomas, queratitis y aftas bucales se decidió estudiar su actividad contra los virus específicamente contra el virus de la Hepatitis B, ya que en estos momentos la enfermedad que causa, constituye un problema de salud debido a sus secuelas en los peores casos.6 También motivó esta investigación la necesidad de buscar una alternativa de tipo natural, como es el Aloe para aumentar el arsenal terapéutico y facilitar el trabajo de esta especialidad.
Con estos fines se planteó como objetivo principal determinar si el extracto acuoso de Aloe b M, disminuye la antigenicidad del antígeno de superficie del virus de la hepatitis B (Ag HBs) teniendo en cuenta los resultados de los experimentos in vitro e in vivo.
MÉTODOS
El antígeno de superficie del virus de la hepatitis B se obtuvo de un paciente con hepatitis B crónica que mantiene niveles estables del mismo, 67 mcg/mL y no tiene niveles de anticuerpos contra él.
Para ajustar la dilución de trabajo se realizó un ensayo inmunoenzimático (Elisa Sandwich) cuantitativo estandarizado en el Instituto Superior de Ciencias Básicas y Pre-clínicas (ISCBP) Victoria de Girón7 y se escogió a dilución de 1:800.
Para el experimento in vitro se utilizó además del antígeno descrito, ámpulas de extracto acuoso de Aloe de 3 mg/mL. El Aloe a las concentraciones de 0,3; 0,2; 0,1 mg/mL se incubó a temperatura ambiente con una concentración fija estándar (83,75 Ng/mL) durante 24, 48, 72 h; 7, 14 y 21 d. Al término de todos esos tiempos esta mezcla fue cuantificada en repetidas ocasiones por Elisa empleando una curva con el estándar obtenido de la muestra del paciente, el mismo se utilizó como control positivo y se realizó una curva con 8 puntos de dilución doble seriada a partir de 1:800, como control negativo se utilizó suero humano normal.
Para el experimento in vivo se trabajó con 2 grupos de 10 ratones transgénicos de la línea balb/c obtenidos en el ISCBP Victoria de Girón. El grupo I recibió tratamiento con el extracto acuoso de Aloe durante 21 d 0,3 mg/mL diarios y el grupo II con agua bidestilada, ambos por vía subcutánea. El suero obtenido se trabajó diluido 1:20 en PBS y se le cuantificó el antígeno de superficie de la hepatitis B.
Para el análisis de los resultados del experimento in vitro se trabajó con descriptores y tablas. Con los resultados del experimento in vivo se hizo un análisis de T apareadas con ambos grupos de trabajo. Se realizó una regresión lineal simple para comparar funcionamiento de ambos estándares.
RESULTADOS
Evaluación in vitro
La evaluación consecutiva de las diferentes concentraciones del extracto acuoso de Aloe b. M enfrentadas al estándar de antígeno a través del Elisa se representa en la (tabla 1) donde se aprecia también que la sensibilidad del método osciló entre 0,2 y 1,9 Ng/mL, valores que caen dentro del rango establecido para el mismo;7 en la (tabla 2) se representan los valores medios de los controles negativos utilizados en todas las determinaciones realizadas, ellos están dados por suero humano normal, Aloe puro, Aloe diluido 1:800 y PBS o tampón –fosfato con que se trabajó.
Tabla 1. Concentraciones de antígeno in vitro (en mg/mL)
| Aloe | 24 Horas | 48 Horas | 72 Horas | 7 Días | 14 Días | 21 Días |
| 0,3 mg/mL | 27,6 | 13,42 | 11,34 | 19,96 | 16,64 | 3,91 |
| 0,2 mg/mL | 28,61 | 15,33 | 9,26 | 25,39 | 12,63 | 4,84 |
| 0,1 mg/mL | 30,55 | 5,44 | 8,47 | 28,52 | 16,12 | 4,49 |
| Sensibilidad | 1,09 Ng/mL | 0,26 Ng/mL | 0,42 Ng/mL | 0,55 Ng/mL | 0,34 Ng/mL | 0,53 Ng/mL |
Tabla 2. Controles normales utilizados
| Tiempo | Suero HN | Aloe puro | Aloe 1:800 | PBS |
| 24 horas | 0,123 | 0,116 | 0,11 | 0,116 |
| 48 horas | 0,123 | 0,145 | 0,122 | 0,116 |
| 72 horas | 0,132 | 0,124 | 0,113 | 0,104 |
| 7 días | 0,127 | 0,132 | 0,095 | 0,103 |
| 14 días | 0,12 | 0,134 | 0,122 | 0,098 |
| 21 días | 0,109 | 0,145 | 0,104 | 0,106 |
| Promedio | 0,122 | 0,132 | 0,111 | 0,107 |
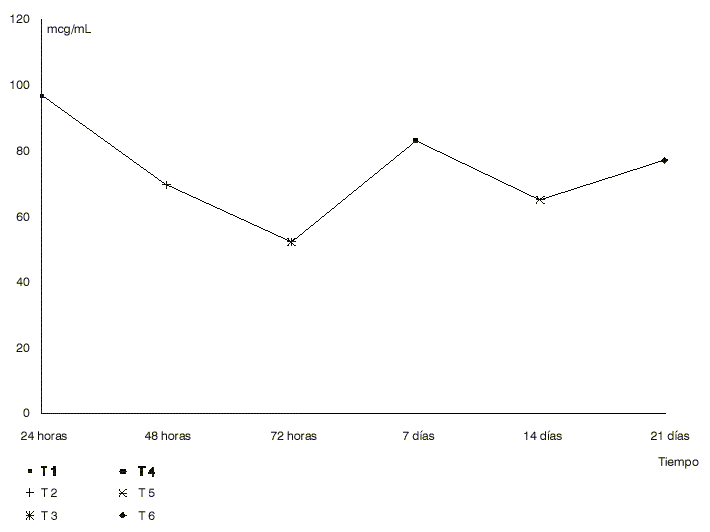
La (figura 1) muestra que, partiendo del punto más concentrado de la curva, la disminución máxima de la antigenicidad se obtuvo a los 21 d, se utilizó una concentración de Aloe de 0,3 mg/mL, a pesar de ello llamó la atención el pico que apareció a los 7 d con cada una de las concentraciones con que se trabajó. Es precisamente por eso que se evaluó el control positivo (estándar) en los diferentes tiempos de incubación por separado y no existió variación del mismo a temperatura ambiente (figura 2).
Fig. 1. Variación antigénica.
Fig. 2. Evaluación de los tiempos de incubación.
El estándar de antígeno utilizado se comparó con un estándar recombinante (figura 3) y se pudo observar que ambos funcionaron de igual forma e incluso con un rango de linealidad en cada uno, para corroborar esto se realizó un análisis de regresión lineal simple que demuestra que no hay diferencias significativas entre los estándares con un coeficiente de correlación (r) = 0,89, un intercepto = 1,42, pendiente = 0,57, por lo que el que se utilizó en este trabajo cumple con los requisitos establecidos para estos fines.
La (tabla 3) muestra la gran diferencia que existió entre el grupo tratado con extracto acuoso de Aloe b M, donde se aprecia una disminución del antígeno HBs, y el grupo control tratado con agua bidestilada en que los niveles de antígeno se mantuvieron aproximadamente iguales.
Tabla 3. Antigenemia por Ag HBs (en mcg/mL)
| Número | Transgénicos tratados | Transgénicos no tratados | ||
| Antes | Después | Antes | Después | |
| 1 | 31,94 | 0,63 | 2,96 | 2,83 |
| 2 | 43,13 | 13,25 | 5,82 | 6,41 |
| 3 | 60,39 | 1,19 | 4,82 | 5,55 |
| 4 | 38,61 | 25,11 | 4,05 | 3,8 |
| 5 | 24,36 | 0 | 4,57 | 4,32 |
| 6 | 49,8 | 0,039 | 2,3 | 1,43 |
| 7 | 27,1 | 1,06 | 15 | 13,25 |
| 8 | 23,34 | 35,68 | 2,5 | 1,43 |
| 9 | 20,32 | 5,42 | 11,1 | 10,81 |
| 10 | 10,32 | 2,14 | 10,25 | 8,32 |
Fig. 3. Evaluación del estándar utilizado.
DISCUSIÓN
En el intento por lograr los objetivos planteados se estableció un diseño experimental con pocos antecedentes en cuanto a la sustancia utilizada (Aloe) y con un modelo animal (transgénico) poco susceptible a tener variaciones ya que están modificados genéticamente;8 pero los resultados fueron favorables.
Como se conocen las características y acciones del Aloe, sería de mayor interés tratar de explicar los mecanismos a través de los que actúan sobre el sistema inmunológico para explicar su actividad antiviral.
Si aún no se tienen claros todos los mecanismos que permiten la inmunomodulación del Aloe, muchos de ellos están relacionando su actividad antiviral. También pudiera ocurrir que el Aloe indujera la inserción de un epitopo extraño y con ello aumentaría la inmunogenicidad del virus para que se reconozca y elimine eficazmente por parte del sistema inmune celular; esto explicaría la elevación de la antigenidad que se observa a los 7 d en la (figura 1) del estudio in vitro. En otro estudio in vitro que se realizó en la escuela de medicina de la Universidad de Ehime, Japón, con suero de ratones transgénicos vacunados con altas dosis durante un año y utilizando adyuvante completo de Freud, se obtuvieron resultados alentadores ya que la antigenemia desapareció en la mayor parte de los animales tratados, ello se comprobó con pruebas que utilizan la Biología Celular y Molecular como estudios de DNA y la reacción en cadena de la polimerasa (PCR),9 en este caso no se vacunó a los ratones pero el Aloe puede funcionar como adyuvante lo que a su vez se pudiera relacionar con su actividad inmunomoduladora también.
Existen datos importantes que avalan la actividad antiviral in vivo del Aloe y parece ser que una gran parte del ello tiene que ver con la activación y la estimulación de la célula efectora pluripotencial de la médula ósea y de los macrófagos por parte del acemannan, nombre de la mayor fracción carbohidrata obtenida de la planta. El acemannan permite la producción de citoquinas co-interleucina 6, interferón gamma y el factor de necrosis tumoral, la liberación de óxido nítrico que a su vez está relacionado con receptores para la manosa que es el monosacárido dominante del acemannan, el estallido respiratorio y favorece la actividad candicida por parte de los fagocitos.10-12 También se conoce que aumenta la expresión antigénica en la superficie celular, esto es una consecuencia de la liberación de interferón gamma que permite la mayor expresión de las moléculas del complejo mayor de histocompatibilidad, en este caso las de clase I portarían el virus en la superficie celular y asegurarían su reconocimiento por parte de las células T citotóxicas para que sea eliminado. Otro mecanismo implicado por parte del acemannan es la inhibición de la opsonización del simozan; la producción de anticuerpos específicos y la inducción de la hipersensibilidad retardada,12,13 todo lo relacionado puede ser responsable del efecto inmunomodulador del Aloe.
Otros estudios plantean que del gel obtenido de la hoja del Aloe se ha separado por ultracentrifugación una sustancia de alto peso molecular que disminuye la vía clásica pero eleva la vía alternativa del complemento13,14 y genera un aumento de las opsoninas derivadas del mismo que permiten una fagocitosis óptima por macrófagos y polimorfonucleares lo que sería otra vía de inmunomodulación.
De alguna manera por uno de los mecanismos planteados el Aloe b M pudiera modular el sistema inmune para facilitar determinados mecanismos que favorecen la eliminación viral in vivo, por lo que estos resultados no constituyen una novedad sino marcan los inicios de la profundización de los estudios de los efectos del Aloe sobre el sistema inmunológico.
REFERENCIAS BIBLIOGRÁFICAS
- Pancti T, Brezzi P, Petech L. Historia de la humanidad. Desarrollo cultural y científico. El Mundo Antiguo. Ed. Sudamericana; 1966;t2:197-8.
- Roig y Mesa JT. Plantas medicinales, aromáticas y venenosas de Cuba. La Habana: Editorial Ciencia y Técnica, 1974:31.
- Fuentes VR. Sobre la flora medicinal en Cuba. Bol Res Plant Med 1984;11(7):78.
- Fuentes VR. Consideraciones sobre el estudio de las plantas medicinales en Cuba. Plantas Med 1984;4:78.
- Colectivo de autores. Compendio de investigaciones sobre el Aloe barbadensis Miller (sábila) cultivado en Cuba. Ed. MINFAR; 1990.
- Izquierdo M. Validación de una prueba de potencia para la vacuna cubana antihepatitis B recombinante (Herbiovac HB). Biotecnología Habana ´94. Reportes cortos del Congreso 1994; vol 2:42.
- Izquierdo M. Validación de un ELISA para la cuantificación del Ag de superficie del virus de la hepatitis B. Biotecnología Habana ´94. 1994;vol 2:42.
- Chisari FU. Hepatitis B virus transgenic mice: models of viral immunobiology and pathogenesis. Curr Top Microbiol Immunol 1996;206:149-73.
- Akbar SM, Kajino K, Tanimoto K, Kurose K, Masumoto T, Michitaka K. Placebo-controlled trial of vacunation with hepatitis B virus transgenic mice. J Hepatol 1997;26(1):131-7.
- Zhang L, Tizard IR. Activation of a mouse macrophage cell line by acemannan: major carbohydrate fraction from Aloe vera gel. Immunopharmacology 1996;35(2):119-28.
- Stuart RW, Lefkowitz DL, Lincoln JA, Howard K, Gelderman MD, Lefkowiitz SS. Upregulation of phagocytosis and candicidal activity of macrophages exposed to the immunostimulant acemannan. Int J Immunopharmacol 1997;19(2):75-82.
- Karaca K, Sharma JM, Nordgren R. Nitric oxide production by chiken macrophages by acemannan, a complex carbohydrate extracted from Aloe vera. Int J Immunopharmacol 1997;19(2):75-82.
- T´ Hart LA, Van den Berg AJ, Kuis L, Vam Di JKH, Labadie RP. An anti-complementary polysaccharide with immunological adjuvant activity from the parenchyma gel of Aloe Vera. Planta Med 1989;55(6):509-12.
- . _____ . Two funcionally and chemically distinct immunodulatory compounds in the gel of Aloe vera. Ethnopharmacol 1988; 23(1):61-71.
Recibido: 19 de octubre del 2000. Aprobado: 13 de diciembre del 2000.
Dra. Edelis Castellanos Puerto. Instituto Superior de Medicina Militar Dr. Luis Díaz Soto. Ave. Monumental y Carretera del Asilo. Habana del Este. CP 11700. Ciudad de La Habana. Cuba.
1 Especialista de I Grado en Inmunología Básica y Clínica.
2 Especialista de II Grado en Inmunología Básica y Clínica.
3 Licenciada en Bioquímica.
4 Licenciada en Biología.