Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med v.2003 n.2 Ciudad de la Habana Mayo-ago. 2003
Centro Nacional para la Producción de Animales de Laboratorio
Ensayo de toxicidad a dosis repetidas del extracto acuoso de Morinda royoc L. en ratas Cenp:SPRD
Lic. Yana González Torres,1 Dr. Isidoro Scull Campos,2 Lic. Ana M. Bada Barro,3 Dra. Bárbara González Navarro,4 Dra. Dasha Fuentes Morales,5 Dra. María E. Arteaga Pérez,6 Lic. Edilis Santana Gómez7 y Lic. Osvaldo Hernández Sosa1
Resumen
Se elaboró un extracto acuoso a partir de la planta denominada comúnmente en Cuba Garañón, el cual se emplea en la elaboración de un producto que tiene acción estimulante, revitalizadora, antiestrés e incrementa la líbido. Este producto se emplea en Cuba como suplemento dietético. El ensayo se realizó en ratas Sprague-Dawley para evaluar las características tóxicas del extracto acuoso y determinar los efectos tóxicos que pudieran producirse. Se administró por vía oral, una dosis de 1000 mg/kg de peso corporal durante 28 días. Los animales se observaron diariamente para detectar signos de toxicidad. Al finalizar el tratamiento se realizaron exámenes de hematología, química sanguínea y la necropsia de los animales para realizar el examen anatomopatológico e histopatológico correspondiente. Se pudo concluir que no se afectaron los indicadores hematológicos y de química sanguínea por causa de la sustancia ensayada. Tampoco hubo afectaciones en el peso corporal y el consumo de alimento. Los resultados obtenidos con el análisis histopatológico corroboraron todo lo antes expuesto.
DeCs: PLANTAS MEDICINALES / toxicidad; EXTRACTOS VEGETALES / toxicidad; ANIMALES DE LABORATORIO; TEST DE TOXICIDAD; RATAS SPRAGUE-DAWLEY.
Summary
An extract was obtained from the plant commonly known in Cuba as Garañón, which is used to make a product with stimulating, revitalizing and antistress activity that also increases the libidum. This product is used in Cuba as a diet supplement. The trial was carried out to evaluate the toxic characteristics of the aquous extract and to determine the toxic effects that may appear. It was orally administered at a dose of 1000 mg/kg of body weight during 28 days. Animals were observed daily to detect toxicity signs. At the end of the treatment, hematology and blood chemistry tests were made and the necropsy of the animals was performed to carry out the corresponding anatomopathological and histopathological examination. It was concluded that the hematological and blood chemistry indicators were not affected as a result of the tested substance. Affectations were not observed either in the body weight or in food consumption. The results obtained with the histopathological analysis corroborated the above mentioned.
Subject headings: PLANTS, MEDICINAL / toxicity; PLANTS EXTRACTS / toxicity; ANIMALS, LABORATORY; TOXICITY TESTS; RATS; SPRAGUE-DAWLEY.
La sustancia de ensayo es un extracto acuoso elaborado a partir de la planta Morindo royoc L., denominada Garañón en Cuba, para su obtención se emplearon técnicas homeopáticas. Este extracto posee como principio activo la morindina y contiene, además, otros metabolitos secundarios entre los cuales se destacan flavonoides, quinonas, triterpenos, azúcares, alcaloides y fundamentalmente, taninos. Se emplea como base en la elaboración del producto PV-2 que tiene acción estimulante, revitalizadora, antiestrés e incrementa la libido, en Cuba se usa como suplemento dietético y se produce en el Instituto Politécnico Agropecuario Villena Revolución.
En el Centro Nacional para la Producción de Animales de laboratorio (CENPALAB) se realizó un ensayo de toxicidad aguda oral (prueba límite),en el cual se pudo concluir que la sustancia no provocó síntomas de toxicidad, muerte ni lesiones macroscópicas evidentes en los animales de ensayo. Por los resultados alcanzados, la información existente sobre el producto, el conocimiento sobre sus efectos terapéuticos, el régimen de dosificación propuesto para su empleo en humanos y por ser un producto novedoso, se consideró necesario la realización del estudio de toxicidad a dosis repetidas por vía oral en ratas con el objetivo de detectar los signos de toxicidad manifiestos tras la administración diaria durante 28 días de la sustancia de ensayo. El extracto acuoso fue la sustancia de ensayo, el mismo estuvo compuesto, además de los metabolitos presentes en la planta, expresados anteriormente, por un 6,6 % de sólidos totales, lo cual se tomó como base para la dosificación.
Métodos
Los estudios fueron conducidos cumpliendo las normas internacionales 1-3, y lo establecido para el cuidado y uso de animales de laboratorio.4-6 Todo el procedimiento fue concebido como se estipula en el ensayo 407 de las Directrices de la OCDE.
El estudio se realizó con 40 ratas Sprague Dawley (20 de cada sexo), de la sublínea Cenp:SPRD con 5 semanas de edad y un peso promedio de 150-170 gramos. Los animales fueron sometidos a un período de readaptación de 5 días. El día antes del inicio del ensayo se conformaron los 2 grupos experimentales de 20 animales (10 de cada sexo) un grupo control (I), al cual se le administró vehículo (agua estéril) y un grupo tratado (II) al cual se le administró la sustancia de ensayo a la dosis establecida.
Los animales se alojaron en cajas tipo T4, de policarbonato, área de 855 cm², fondo y tapa de rejilla de acero inoxidable y bandeja plástica para la colección de heces y orina. Las cajas poseían tarjetas con la identificación correspondiente a cada animal. Se empleó la dieta comercial EMO 1001 (ALYco®, CENPALAB) para ratas (SPF). El agua de beber fue potable y tanto esta como el alimento fueron esterilizados en autoclave SAKURA FOA 24.
Se utilizó la vía oral mediante el método de intubación gástrica. Los animales fueron tratados diariamente durante los 28 días del ensayo.
La dosis propuesta a ser usada en el humano fue de 0,75 mg diarios por 7 días de tratamiento. En este ensayo se empleó un solo nivel de dosis, 1 000 mg/kg de peso corporal (PC), ya que en ensayos anteriores donde se aplicó una dosis de 2 000 mg/Kg de PC no se detectaron efectos tóxicos. La dosis del extracto fue administrada de forma directa (sin diluir) en un volumen de 2 ml/100 g de PC. Este volumen fue rectificado semanalmente para que la dosis fuera la misma durante todo el ensayo. Al grupo control le fue suministrado agua como vehículo de la sustancia de ensayo. En el local de trabajo se registraron y mantuvieron las siguientes variables ambientales: temperatura: osciló entre 20 ± 2 °C, la humedad relativa: estuvo de 55 a 65 %, los cambios de aire: más de 12 cambios por hora, y se mantuvo un fotoperíodo de 12 h luz 12 h oscuridad.
Observaciones realizadas
Se efectuaron observaciones clínicas diarias. Estas consistieron en la observación del comportamiento, el estado físico general, las mucosas nasales y oculares en busca de secreciones. Se realizó palpación del abdomen y tórax para detectar masas palpables, así como revisión de la integridad y coloración de la piel y las mucosas, las características del pelo y otras. Además se revisaron periódicamente las heces y orina en las bandejas colectoras para detectar posibles alteraciones en el aspecto, consistencia y características de las mismas. Los animales se pesaron una vez por semana, al finalizar el estudio se promedió el peso de los animales por semana y grupo, teniendo en cuenta el sexo para observar como se comportó este indicador durante el ensayo. El consumo de alimento se calculó semanalmente en cada grupo experimental.
Exámenes hematológicos
Las determinaciones hematológicas se llevaron a cabo al finalizar el tratamiento. A los 28 días, tras ayuno de 12 h y anestesia por inhalación con éter dietílico para lograr la narcosis, se procedió a la extracción de sangre periférica (vena femoral) para realizar los exámenes. A todos los animales de cada grupo experimental se le tomaron muestras de sangre, las cuales fueron recolectadas en viales de seguridad Eppendorf de un volumen de 2 ml que contenían 1 gota de EDTA al 10 %.
De estas se tomaron alícuotas de sangre de un volumen aproximado de 0,5 ml para las determinaciones de los indicadores hematológicos como fueron: hemoglobina (Hb), hematocrito (Hto), leucocitos totales (Leuc), conteo diferencial de leucocitos que incluyó neutrófilos (N), linfocitos (L), monocitos (M) y eosinófilos (E) y conteo de plaquetas (Plaq) Todos estos indicadores se determinaron por el contador de células Micros ABX (Roche Diagnostic Systems).
Exámenes de química sanguínea
Para las determinaciones de química sanguínea la sangre fue recolectada en viales de 2 ml y centrifugada, previa formación y retracción del coágulo, a 12 000 rpm durante 10 min en una centrífuga Eppendorf. Los sueros obtenidos fueron depositados en viales rotulados. Las muestras se procesaron en el analizador automático Hitachi 704 y se usaron los sueros controles Precinorm U y Precipath U; ambos de la firma Boehringer Mannheim Gmbh. Se determinaron los siguientes indicadores: aspartato aminotransferasa (ASAT), alanino aminotransferasa (ALAT), bilirrubina total (Bil-T), albúmina (Alb), proteínas totales (PT), glucosa (Gluc), nitrógeno ureico sanguíneo (BUN), colesterol total (Col-T), triglicéridos (TG), creatinina (Crea) y ácido úrico (AU).
Estudio anatomopatológico
El estudio anatomopatológico se realizó a todos los animales al finalizar el tratamiento, ya que todos los animales culminaron el mismo. Para llevar a cabo las correspondientes observaciones macroscópicas y un estudio microscópico, se realizó la eutanasia a los animales previamente narcotizados con éter y luego desangrados por la vena femoral. Posteriormente se prosiguió a la extracción y pesaje de los siguientes órganos: encéfalo, corazón, pulmones, timo, riñones, bazo, hígado, adrenales, ovario y/o testículos, además del peso corporal post-morten. El estudio histológico se realizó a: tráquea, pulmón, timo, corazón, aorta, bazo, nódulos linfáticos, estómago, duodeno, yeyuno, íleon, ciego, colon, hígado, riñones, ovarios, útero, testículos y encéfalo. Se realizó él estudio microscópico correspondiente.
Análisis estadístico
Se empleó el programa SPSS sobre Windows para determinar estadígrafos, y evaluar diferencias y homogeneidad (prueba de Kolmogorov-Smirnov) entre grupos. La comparación de las medias se realizó con ayuda de la prueba de Student. Los valores promedios del peso corporal a dosis repetidas se compararon por un método no paramétrico, la prueba de la U de Mann-Whitney.
Resultados
Peso corporal
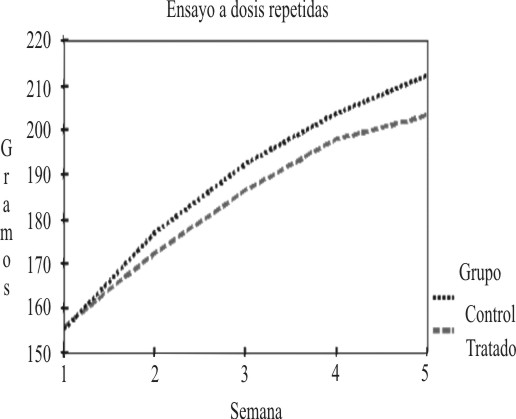
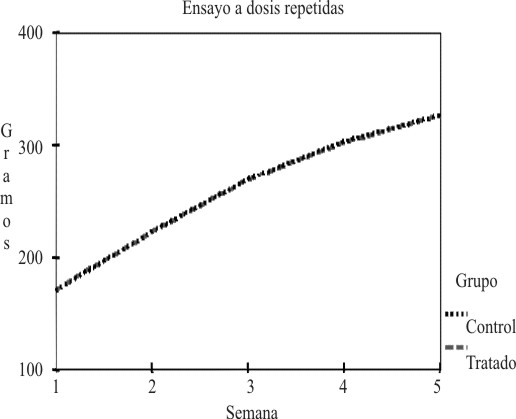
En la tabla 1 se muestra el comportamiento de este indicador, y se observa que en ningún caso hubo pérdida de peso, y la tendencia al aumento fue una constante durante el estudio en ambos sexos. Todos los valores fueron normales para ambos sexos. El análisis de las medias arrojó en las hembras diferencias significativas en la semana 5.7 Las figuras 1 y 2 muestran gráficamente los resultados del peso corporal en hembras y machos.
Tabla 1. Variaciones en el peso corporal (X±DE)
| Peso Corporal (gramos) | |||||
| Hembras | Machos | ||||
| Semanas del ensayo | N° animales | Grupo Control | Grupo Tratado | Grupo Control | Grupo Tratado |
| 0 | 10 | 155,7 ± 3,9 | 156,4 ± 4,2 | 171,9 ± 5, | 172,7 ± 4,7 |
| 1 | 10 | 177,3 ± 6,4 | 172,7 ± 7,9 | 224,2 ± 9, | 224,6 ± 9,2 |
| 2 | 10 | 192,7 ± 7,8 | 186,7 ± 9,7 | 271,0 ± 15,2 | 271,2 ± 15,9 |
| 3 | 10 | 204,1 ± 8,8 | 198,4 ± 12,8 | 304.7 ± 22,1 | 304,1 ± 24,9 |
| 4 | 10 | 212,6 ± 8,9 | 203,5 ± 10,0 | 328,5 ± 26,7 | 328,6 ± 32,8 |
Consumo de alimento
Las variaciones en este indicador se observan en la tabla 2. Este indicador se mantuvo variable durante todo el ensayo y se observó un comportamiento diferente entre sexos y entre grupos, sólo al final se apreció una ligera disminución en ambos sexos.
Tabla 2. Variaciones en el consumo de alimentos (X±DE)
| Consumo de Alimento (gramos) | |||||
| Hembras | Machos | ||||
| Semanas del ensayo | N° animales | Grupo Control | Grupo Tratado | Grupo Control | Grupo Tratado |
| 1 | 10 | 269,7 ± 20,9 | 294,9 ± 19,9 | 339, ± 38,0 | 384., ± 16,6 |
| 2 | 10 | 286,5 ± 6,9 | 282,2 ± 24,9 | 403,8 ± 44,7 | 389,5 ± 36,0 |
| 3 | 10 | 307,4 ± 22,7 | 289,6 ± 33,9 | 391,0 ± 35,9 | 397,3 ± 28,4 |
| 4 | 10 | 309,5 ± 46,8 | 246,1 ± 38,8 | 402,9 ± 36,8 | 353,8 ± 36,9 |
Fig 1. Comportamiento del peso corporal durante el ensayo a dosis repetidas en las hembras.
Fig 2. Comportamiento del peso corporal durante el ensayo a dosis repetidas en los machos.
Hallazgos clínicos
El ensayo concluyó con un 100 % de supervivencia. De forma general no aparecieron signos tóxicos relevantes en los animales de experimentación, sólo aparecieron algunos síntomas aislados a las 48 h de administración del producto. Los síntomas encontrados en gran parte de los animales fueron: depilaciones en diferentes zonas del cuerpo y caídas del pelo fundamentalmente en la zona abdominal. Estas lesiones se observaron en animales tanto del grupo tratado como del grupo control, por lo tanto no son atribuibles a la sustancia de ensayo. Todos los animales se recuperaron en las 72 h posteriores a la aparición de los síntomas.8
Exámenes hematológicos
Los resultados se muestran en la tabla 3. Al realizar el análisis estadístico, t de Student, se encontró que existieron diferencias significativas (p<0.05) del grupo tratado respecto al grupo control, en la hemoglobina y los neutrófilos en ambos sexos. Para las hembras del mismo grupo, sólo los leucocitos totales mostraron diferencias.7
Tabla 3. Variaciones en los indicadores hematológicos (X±DE).
| Grupo | Sexo | Hb(g/dl) | Hto(%) | Plaq(x103ml) | Leu(x103ml) | N(%) | L(%) | M(%) | E(%) |
| Valores | H | (13,4 - 14,1) | (34,1 - 37,1) | (623,2 - 817,0 ) | (2,8 - 5,4) | (21,1 - 27,3) | (70,8 - 77,8) | - | - |
| Normales | M | (13,6 - 14,.3) | (36,4 - 38,7) | (680,2 - 846,0) | (3,4 - 5,6) | (22,8 - 28,3) | (70,5 - 75,8) | - | - |
| Control | H | 13,7 ± 0,34 | 35,6 ± 1,49 | 720,1 ± 96,87 | 4,2 ± 1,38 | 24,2 ± 3,10 | 74,3 ± 3,50 | 0,8 ± 9,92 | 0,2 ± 0,42 |
| M | 13,9 ± 0,35 | 37,58 ± 1,18 | 763,1 ± 82,91 | 4,5 ± 1,10 | 25,6 ± 2,75 | 73,2 ± 2,66 | 1,1 ± 1,37 | - | |
| Tratado | H | 14,7* ± 0,6 | 39,4 ± 1,4 | 736,7 ± 117,6 | 4,5* ± 1,5 | 26,8* ± 1,9 | 72,3 ± 2,0 | 0,5 ± 0,5 | 0,3 ± 0,9 |
| M | 14,1* ± 0,7 | 37,9 ± 2,0 | 724,8 ± 135,0 | 5,8 ± 1,5 | 25,3* ± 2,2 | 73,5 ± 2,5 | 0,9 ± 0,6 | 0,2 ± 0,4 |
* Significativamente diferente respecto al grupo control (p<0,05).
Exámenes de química sanguínea
Los resultados (Tabla 4) muestran que en los machos del grupo tratado todos los indicadores evaluados en el estudio se encontraron dentro de los límites normales; en cambio, en las hembras, los triglicéridos y la ASAT se encontraron aumentados. Al realizar el análisis estadístico, t de Student, se encontró que en las hembras existieron diferencias significativas en la albúmina, ASAT, ácido úrico, proteínas totales y la bilirrubina. En cambio, los machos presentaron diferencias significativas en los triglicéridos.7
Tabla 4. Variaciones en los indicadores de química sanguínea (X±DE)
| Grupo | Sexo | Crea(mg/dl) | Gluc(mg/dl) | ASAT(u/l) | ALAT(u/l) | Alb(g/dl) | Bil-T(mg/dl) | PT(g/dl) | AU(mg/dl) | Col-T(mg/dl) | BUN(mg/dl) | TG(mg/dl) |
| Valores normales | H | (0,73-0,83) | (112,9-170,9) | (161,6-249,5) | (28,8-46,0) | (3,1-3,5) | (0,02-0,10) | (6,02-6,78) | (1,44-1,98) | (44,4-68,2) | (50,4-67,2) | (38,1-66,1) |
| M | (0,61-0,87) | (95,7-147,7) | (181,3-311,9) | (35,1-53,5) | (3,0-3,3) | (0,04-0,10) | (5,85-6,35) | (1,18-1,62) | (36,6-57,2) | (50,2-66,4) | (33,3-65,5) | |
| Control | H | 0,78 ± 0,05 | 141,9 ± 29,0 | 205,6 ± 43,9 | 37,4 ± 8,6 | 3,3 ± 0,2 | 0,06 ± 0,04 | 6,40 ± 0,38 | 1,71 ± 0,27 | 56,3 ± 11,8 | 58,8 ± 8, | 52,1 ± 13,9 |
| M | 0,74± 0,13 | 121,7 ± 26,0 | 246,6 ± 65,3 | 44,3 ± 9,2 | 3,2 ± 0,1 | 0,07 ±0,03 | 6,10 ±0,25 | 1,40 ± 0,22 | 46,9 ± 10,3 | 58,3 ± 8,1 | 49,4 ±16,1 | |
| Tratado | H | 0,76 ± 0,27 | 137,6 ± 41,1 | 314,1* ± 39,7 | 40,5 ± 5,3 | 3,5* ± 0,3 | 0,11* ±0,04 | 6,90* ± 0,52 | 2,21* ± 0,53 | 61,3 ± 14,4 | 61, ± 9,9 | 93, ±40,3 |
| M | 0,82 ± 0,09 | 103,8 ± 10,9 | 281,1 ± 32,2 | 45,3 ± 6,2 | 3,2 ±0,1 | 0,10 ±0,05 | 6,3 ± 0,25 | 1,9 ± 0,47 | 54,0 ± 9,9 | 53,5 ± 8,0 | 66,8* ±18,30 |
* Significativamente diferente respecto al grupo control (p<0,05).
Al analizar las diferencias del estudio estadístico, se encontró que todos los indicadores en el caso de las hembras presentaron mayores valores en el grupo tratado que en el grupo control, sin embargo, todos los valores (excepto los de ASAT y TG), se comportaron normalmente como corresponde a la especie en cuestión. Estos indicadores no mostraron alteración de un órgano específico, lo cual se corroboró con el estudio anátomo-patológico.9,10 15,16
Resultados anatomopatológicos
Análisis del peso corporal post-morten y del peso de los órganos
Resultados de los pesos en hembras
Los resultados de estos análisis se muestran en las tablas 5 y 6. El peso corporal post-morten arrojó diferencias significativas para una p = 0, 049. En el peso absoluto de los órganos, no se observaron diferencias significativas para adrenales, bazo, corazón, encéfalo, hígado, ovarios, timo y riñón izquierdo. Solamente mostró diferencias, por la U de Mann-Whitney, para una p = 0,017, el riñón derecho.
En cuanto al peso relativo, solamente el encéfalo mostró diferencias, según la prueba no paramétrica empleada, para una p = 0,034.
Resultados de los pesos en machos
Los resultados se muestran en las tablas 5 y 6. No se encontraron diferencias significativas, ni para el peso corporal post-morten, ni para el peso de los órganos tanto absoluto como relativo, en este sexo.10
Tabla 5. Variaciones en el peso post-morten y el peso absoluto de órganos (X ± DE)
| Peso de los órganos en gramos (g) | ||||||||||||
| Grupo | Sexo | Peso post-morten | Bazo | Adrenal | Hígado | Ovario/testículo | Timo | Corazón | Pulmon | Encéfalo | Riñón derecho | Riñón izquierdo |
| Control | H | 191,91± 7,42 | 0,46±0,05 | 0,06±0,01 | 6,21±0,57 | 0,12±0,02 | 0,36±0,08 | 0,72±0,06 | 1,03±0,06 | 1,79±0,09 | 0,85 ±0,09 | 0,83±0,09 |
| M | 301,59±26,23 | 0,60 ±0,09 | 0,05±0,00 | 10,03±1,22 | 1,40 ±0,13 | 0,38 ±0,10 | 1,15±0,26 | 1,29±0,12 | 1,92±0,07 | 1,27±0,13 | 1,29 ±0,14 | |
| Tratado | H | 183,02*± 10,59 | 0,44±0,05 | 0,06±0,01 | 5,72±0,52 | 0,12±0,01 | 0,32±0,08 | 0,69±0,06 | 1,07±0,29 | 1,79±0,08 | 0,76*±0,07 | 0,76±0,06 |
| M | 301,18 ±24,93 | 0,66 ±0,14 | 0,5±0,01 | 9,75±1,37 | 1,43±0,22 | 0,38±0,10 | 1,06±0,06 | 1,36±0,14 | 1,94±0,07 | 1,32±0,16 | 1,30±0,15 | |
* Significativamente diferente respecto al grupo control (p<0.05).
Tabla 6. Variaciones en el peso relativo de órganos (X±DE)
| Peso relativo de los órganos (%) | |||||||||||
| Grupo | Sexo | Bazo | Adrenal | Hígado | Ovario/Testículo | Timo | Corazón | Pulmón | Encéfalo | Riñón derecho | Riñón izquierdo |
| Control | H | 0,24±0,2 | 0,3±0,00 | 3,23±0,19 | 0,06±0,01 | 0,18±0,04 | 0,38±0,03 | 0,54±0,03 | 0,93±0,05 | 0,44±0,04 | 0,43±0,04 |
| M | 0,20±0,02 | 0,02±0,00 | 3,32±0,19 | 0,47±0,03 | 0,12±0,03 | 0,39±0,11 | 0,43±0,03 | 0,64±0,06 | 0,42±0,02 | 0,43±0,03 | |
| Tratado | H | 0,24±0,02 | 0,03±0,00 | 3,3±0,23 | 0,06±0,01 | 0,17±0,04 | 0,38±0,05 | 0,59±0,16 | 0,98*±0,04 | 0,41±0,03 | 0,42±0,03 |
| M | 0,22±0,03 | 0,02±0,00 | 3,23±0,31 | 0,47±0,05 | 0,13±0,03 | 0,35±0,03 | 0,45±0,05 | 0,65±0,05 | 0,44±0,03 | 0,43±0,03 | |
* significativamente diferente respecto al grupo control (p<0,05)
Discusión
Desde hace algunos años, el empleo de plantas medicinales y de productos derivados de las mismas está aumentando de manera importante, esto se debe a una serie de factores entre los cuales se destaca el conocimiento preciso, en muchos casos, de su composición química. En la actualidad el empleo de estas plantas está avalada por los ensayos farmacológicos tanto in vitro como in vivo así como por ensayos clínicos, de esta forma, el uso que se ha venido haciendo de una forma empírica y basada en la tradición de las especies vegetales medicinales tiene hoy una base científica.12,13
La introducción de un nuevo medicamento o aplicación de una nueva tecnología, lleva implícito la realización de un conjunto de investigaciones previas que incluyen las relacionadas con aspectos de química farmacéutica, farmacología experimental (farmacocinética y farmacodinamia) y estudios toxicológicos, siendo estos últimos los que cumplen la finalidad de determinar la seguridad de su uso.14, 15
En este trabajo se muestran los resultados de un estudio toxicológico realizado a un producto natural proveniente de una planta de amplia localización y uso tradicional en nuestro país. El estudio es novedoso ya que brinda información sobre las propiedades tóxicas de esta planta cuya especie ha sido poco estudiada en el mundo.
El peso corporal es un indicador de gran importancia pues está involucrado en una serie de cambios orgánicos en diferentes etapas de la vida es por ello que una variación significativa en su comportamiento sugiere que algo no funciona correctamente.
Este indicador, en este estudio tuvo un comportamiento similar a lo publicado para esta especie lo cual demostró la inocuidad de este producto en ese sentido.8
Las variaciones observadas en el consumo de alimento no están relacionadas con una disminución del peso corporal, se pudiera pensar que están justificadas debido a que los animales al inicio del ensayo contaban con 5 semanas de edad, por lo tanto estaban en etapa de crecimiento y el consumo se elevó bruscamente, posteriormente el consumo se estabilizó y se observó un decrecimiento. Esta tendencia fue similar en los dos grupos y para ambos sexos acentuándose más en el grupo tratado, por otro lado este indicador a pesar de ser cuantificable depende mucho de la individualidad en la actividad de roer de cada animal y es a veces un tanto cualitativo ya que todo el alimento que el animal roe no lo ingiere, pues alguno se elimina en la bandeja y entonces se calcula un consumo no real, lo que se corroboró con la observación del comportamiento del peso corporal.11
Los exámenes hematológicos y de química sanguínea son de gran valor en los ensayos toxicológicos a largo plazo ya que los mismos son indicativos del alcance y profundidad de un daño, además los resultados alcanzados pueden correlacionarse con los posibles daños sobre un órgano específico.
Los valores obtenidos en los indicadores hematológicos y bioquímicos no mostraron alteraciones importantes, las variaciones encontradas están dentro del rango establecido por el grupo control y por la literatura especializada. Todos los valores publicados en la literatura se encontraron dentro del rango establecido en el CENPALAB para esta especie.15,16
Las variaciones encontradas en el peso relativo del cerebro, a pesar de poseer significación estadística, no están relacionadas con la alteración de un marcador bioquímico específico, y es por ello que se consideró que carece de relevancia biológica, al no estar asociada a la administración del extracto acuoso.11
Finalmente se puede concluir que en las condiciones empleadas, la sustancia de ensayo, no produjo alteraciones significativas en el peso corporal y el consumo de alimento de los animales de experimentación, tampoco provocó alteraciones anátomo-patológicas atribuibles al efecto de la sustancia de ensayo sobre sistemas, órganos y tejidos. Las diferencias observadas tanto en los indicadores hematológicos y bioquímicos para ambos sexos, no son relevantes biológicamente. Sería útil continuar el estudio toxicológico de esta planta para que pueda ser registrada definitivamente como medicamento de origen natural.
Referencias Bibliográficas
- Organisation for Economic Cooperation and Development. Oecd Guidelines for theTesting of Chemical. V.1. V.2. OCDE; 1993; Paris:1993. Disponible en http://www.oecd.org[ STANDARDIZEDENDPARAG]
- Food and Drug Administration. Good Laboratory Practice for nonclinical laboratory studies. Code of Federal Regulations; 1997. Disponible en http://www.fda.org.
- Guide for the care and use of laboratory animals. National Research Council. Washington: National Academy Press;1996.p.21-79[ STANDARDIZEDENDPARAG]
- Guía para el cuidado, uso y reproducción de los animales de experimentación en el CENPALAB. La Habana: CENPALAB; 2000.p.8-18.
- Olfert ED, Brenda MC, Ann McWillian A, edtiors. Manual sobre el cuidado y uso de los animales de experimentación. Canada: Consejo Canadiense de Protección de los Animales;1998. Disponible en http://www.ccac.ca[ STANDARDIZEDENDPARAG]
- Manual de los Procedimientos Operacionales de Trabajo. CETEX, CENPALAB. 2000.
- Joseph KH, Walter BP. Statistical analysis of developmental toxicity data. Development toxicology. In: Wallace Hayes A, editor. Principles and Methods of Toxicology.2nd ed. New York: Raven Press; 2000.p. 349-61.
- Universities Federation for Animal Welfare. The UFAW Handbook on the care and management of laboratory animals. 7.ed. V.1. Terrestrial vertebrates. Part 3, Species kept in the laboratory. Blackwell Science Ltd;1999.
- Thielmann K. Principios de metodología en Bioquímica Clínica. RDA: Editorial Leipzig;1973.
- Naffakh N, Danos O. Gene trasnfer for erythropoiesis enhancement. Molecular Medicine Today 1996;2:343-8.
- Mosberg AT, Hayes WA. Subchronic Toxicity Testing. In: Wallace Hayes A, editor. Principles and methods of toxicology.2 ed. New York: Raven Press; 2000. p.221-37.
- Villar AM. Farmacognosia General. Madrid: Ed Síntesis;1999.
- Bruneton J. Elementos de fitoquímica y farmacognosia. España: Ed. Acribia Zaragoza; 1991.
- Zbinden G. Predictive value of animal studies in toxicology. Regulat Toxicol Pharmacol 1991; 14:167-77.
- Alemán C, Más R, Rodeiro I, Noa M, Hernández C, Menéndez R, et al. Reference database of the main physiological parameters in Sprague Dawley rats from 6 to 32 months. Lab Animals 1998;32 (4): 457-66.
- Wolford ST, Schroer RA, Gohs FX, Gallo PP, Brodeck M, Falk HB, et al. Reference range data base for serum chemistry and hematology values in laboratory animals. J Toxicol Environm Health 1986;18: 161-88.
Recibido: 29 de noviembre del 2002. Aprobado: 21 de enero del 2003
Lic. Yana González Torres. Edificio C-25 apto 19. Zona 6, Alamar, Habana del Este. La Habana, Cuba
1 Licenciada(o) en Ciencias Farmacéuticas. Investigadora (o). Aspirante.
2 Doctor en Ciencias Veterinarias.
3 Licenciada en Ciencias Farmacéuticas. Investigadora Agregada.
4 Master en Toxicología Experimental. Investigadora Auxiliar.
5 Master en Anatomía Patológica. Investigadora Agregada.
6 Médico Veterinaria. Investigadora Auxiliar.
7 Licenciada en Ciencias Farmacéuticas.