Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med v.2003 n.2 Ciudad de la Habana Mayo-ago. 2003
Centro de Investigación y Desarrollo de Medicamentos. Dpto. de Investigación y Evaluaciones Biológicas
Toxicidad aguda oral de la droga seca de Epilobium parviflorum L.
Lic. Raiza Vega Montalvo,1 Lic. Rosa Menendéz,2 Dra Viviana Bueno Pavón,3 Téc Isbel Guerra Sardiñas4 y Téc Yamilet Vega Hurtado4
RESUMEN
Se determinó la toxicidad aguda de la droga seca obtenida a partir de Epilobium parviflorum L., recomendada para su ingestión en forma de decocción. La administración de la droga se realizó por vía oral mediante el ensayo de dosis límite, en ratas Wistar de 150-200g a la dosis de 2000 mg/kg. Los animales se mantuvieron en observación durante 14 días y al finalizar este período fueron sacrificados para realizarle la autopsia. Se efectuó un examen macroscópico de órganos y tejidos así como un análisis histológico de: corazón, riñón, pulmón, hígado, bazo, cerebro y órganos genitales. También se realizó la determinación del peso relativo de ovarios, testículos, vesícula seminal y próstata. Como resultado se obtuvo que la sustancia no presentó toxicidad importante ni provocó mortalidad. Las alteraciones encontradas en el análisis histológico de los órganos fueron atribuidas a artefactos originados en el sacrificio de los animales. El procesamiento estadístico del peso relativo de los órganos analizados, no arrojó diferencias significativas con respecto al grupo control. Finalmente se consideró que la droga seca de Epilobium parviflorum L., no es tóxica, según el criterio de clasificación establecido.
DeCs: PLANTAS MEDICINALES; ENFERMEDADES DE LA PRÓSTATA; AGENTES ANTIINFLAMATORIOS; RATAS WISTAR.
Summary
The acute toxicity of a dry drug obtained from Epilobium parvioflorum L. recommended for its administration in the form of decoction was determined. The drug was orally administered to Wistar rats (150-200 g) by the limited dose trial at 2000 mg/kg. The animals were under observation during 14 days and at the end of this period they were sacrificed to perform the autopsy. A macroscopic examination of organs and tissues was made as well as an histological analysis of heart, kidney, lung, liver, spleen, brain and genitalia. The relative weight of ovaries, testicles, seminal vesicle and prostate was also determined. As a result, it was observed that the substance did not present either important toxicity or mortality. The alterations found in the histological analysis of the organs were attributed to artifacts originated in the sacrifice of animals. The statistical processing of the relative weight of the analyzed organs did not show significant differences as regards the control group. It was concluded that the dry drug of Epilobium parviflorum L, is not toxic, according to the established classification criterion.
Subject headings: PLANTS, MEDICINAL; PROSTATIC DISEASES; ANTI-INFLAMM ATORY AGENTS; RATS, WISTAR; MICE.
Epilobium parviflorum L. perteneciente a la familia Onagraceae, es una planta con grandes flores de color rosado, muy comunes en las regiones alpinas. Suele encontrarse en los claros de bosques, en las canteras, los bordes de las carreteras y escombreras, además se reproduce vertiginosamente gracias a su gran producción de semillas voladoras. Sus 4 pétalos son rosados, rojos o violetas, con diámetro de 1,5 a 2,5 cm. Las hojas son estrechas y dentadas en los bordes.1
Las partes aéreas del género Epilobium constituyen la parte más utilizada de tales plantas. Como principios activos se han encontrado flavonoides derivados de kenferol, quercetol y miricetol, fitosteroles y taninos elángicos macrocíclicos: oenoteínas A y B (10 y 14 %). Los elangitaninos tienen una acción antiadenomatosa prostática, al inhibir la actividad de la 5 alfareductasa y aromatasa así como acción astringente (cicatrizante).2 La miriscetina muestra experimentalmente una potente acción antiinflamatoria, diez veces superior a la indometacina y una inh*ibición de la síntesis de prostaglandinas comparable a esta. Los extractos acuosos específicamente reducen la liberación de prostaglandinas I2, E2 y D2.3
En un estudio realizado a diferentes extractos acuosos de Epilobium parviflorum L. se encontró la presencia de ácido palmítico, esteárico, oleico, araquidónico y linoleico, también taninos y flavonoides, ácidos triterpénicos y sobre todo la fitosterina. Dentro de este grupo la beta fitosterina se encontró en cantidad suficiente para ser efectiva desde el punto de vista médico. A estos extractos acuosos se les atribuye acción antiinflamatoria y curativa en las infecciones agudas y crónica de la próstata, en el adenoma de la próstata en fase inicial 1 y 2, en las inflamaciones de las vías urinarias y en las inflamaciones vesicales crónicas recidivantes. Además se conoce que dichos extractos estimulan la actividad de la oxidasa de membrana y la mieloperoxidasa de los granulacitos humanos así como la formación y liberación de radicales libres.4,5
Sin embargo es necesario llevar a cabo ensayos clínicos que avalen la inocuidad de E. parviflorum L. en humanos así como su eficacia en el tratamiento de diferentes enfermedades. El objetivo de este trabajo fue la evaluación de la toxicidad aguda oral de la planta en forma de droga seca como etapa preparatoria para futuros ensayos clínicos.
Métodos
Material vegetal
Epilobium parviflorum L. droga seca obtenida a partir de las hojas de la planta.
Herboristería, Botica del Señor S.R.L. Distribuidor Exclusivo Laboratorio ASTER, Costa Rica
Especificaciones de calidad
Humedad: 8,38 %
Cenizas: 5,7 %
Extractivas en alcohol al 30 % : 0,96 %
Extractivas en agua: 0,96 %
La droga fue caracterizada según norma ramal de droga seca del MINSAP,6 en el departamento de Productos Naturales del Centro de Investigación y Desarrollo de Medicamentos.
La misma se administró en forma de decocción y se preparó de la siguiente forma: se tomaron 6 g de la planta triturada que se mezclaron mediante agitación con 100 mL de agua hirviendo, posteriormente se dejó reposar el recipiente durante 15 min y transcurrido este tiempo la solución fue filtrada a través de papel de filtro. Para la investigación se utilizó el líquido filtrado.
Ensayo de toxicidad aguda oral
Para la determinación de la toxicidad aguda mediante el ensayo de dosis límite7 se emplearon ratas Wistar procedentes de la colonia del Laboratorio de Control Biológico con una masa corporal comprendida entre 150 y 200 g. Los animales se mantuvieron en una sala a temperatura controlada de 20 ± 2 °C con un ciclo de luz /oscuridad de 12/12 h. La alimentación consistió en dieta estándar para ratas y ratones proveniente del Centro Nacional para la Producción de Animales de Laboratorios (CENPALAB) y agua a voluntad.
Se formó un grupo control y un grupo tratado de 10 animales cada uno, 5 de cada sexo, los que fueron identificados individualmente para la dosificación exacta de acuerdo a su peso corporal mediante un sistema de marcaje con ácido pícrico.
Se administró a una dosis de 2 000 mg/kg de acuerdo con su peso seco, por vía oral con un factor de volumen de 0, 033mL/g mediante cánula intra gástrica. La comida a los animales se le retiró 18 h antes de la administración.
Los animales fueron observados constantemente durante las primeras 24 h y diariamente durante un período de 14 días.
Se registró cualquier síntoma tóxico. Al finalizar este período se procedió al sacrificio por asfixia bajo atmósfera de éter, se les realizó la autopsia y un examen macroscópico de órganos y tejidos. Se hizo el análisis histológico de diferentes órganos tales como: corazón, riñón, pulmón hígado, bazo, cerebro y órganos genitales. Además se realizó la determinación del peso relativo de ovarios, testículos, vesícula seminal y próstata, los cuales fueron analizados estadísticamente mediante un análisis de varianza de una vía de clasificación con respecto al grupo control (p<0,05).
El peso corporal se registró al inicio, a los 7 días y al final del experimento.
Resultados
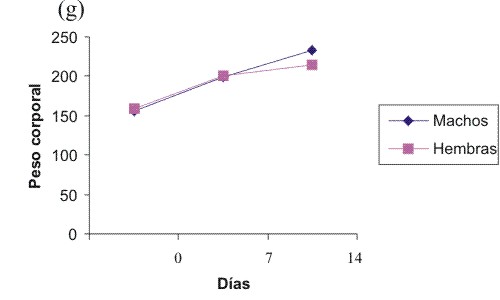
Al administrar la sustancia de ensayo no se observó la presencia de síntomas tóxicos, no se presentó mortalidad en el período de observación, ni disminución en el peso corporal en ninguno de los grupos experimentales según se aprecia en la figura.
Fig.Comportamiento del peso corporal en los grupos experimentales
En la tabla se muestran las medias y las desviaciones estándar del peso relativo de los órganos evaluados, los cuales no mostraron diferencias significativas con respecto al grupo control al ser comparados mediante el análisis de varianza.
Tabla. Peso relativo de órganos en porcientos (`X ± D.S)
| Grupos | Ovarios | Testículos | Vesícula seminal/ Próstata | |
| Hembras | Control | 0,0506± 0,0006 | ||
| E. parviflorum | 0,0444±0,0030 | |||
| Control | 1,0850± 0,0369 | 0,5009±0,0936 | ||
| Machos | ||||
| E. parviflorum | 1,0933±0,0647 | 0,4234±0,0510 |
En la autopsia realizada no se encontraron evidencias de alteraciones patológicas en los órganos analizados. En el análisis histológico de los órganos, las alteraciones observadas en todos los animales fueron de tipo vasculares tales como: congestión y hemorragia, las cuales fueron atribuidas a artefactos originados en el sacrificio de los animales y a la fijación de los tejidos para la observación microscópica.
DISCUSIÓN
No se presentó mortalidad para la dosis de 2 000 mg/kg (de acuerdo con el peso seco de la droga) la cual se consideró límite para este tipo de estudios. La planta no posee toxicidad significativa, y se ubica, por tanto, en el rango de no clasificado según el criterio de clasificación para la toxicidad aguda oral establecido por la Comunidad
Económica Europea (CEE).6
REFERENCIAS BIBLIOGRÁFICAS
- Peris J, Stübing G, Vanaclocha B. Fitoterapia Aplicada. Valencia: M.I. Colegio Oficial de Farmacéuticos;1995:261.
- Ducrey B, Marston A, Göhring S, Hartmann, RW, Hostettmann K. Inhibition of 5 alpha-reductase and aromatase by the ellagitannins oenothein A and oenothein B from Epilobium species. Planta Med 1997; 63:111-4.
- Hiermann A, Juan H, Sametz W. Influence of Epilobium extract on prostaglandin biosíntesis and carragenin induced oedema of rat paw. J Etnopharmacol 1986;17(2): 161-9.
- Lesuisse D, Berjonneau J, Ciot C, Devaux P, Doucet B, Gourvest JF, et al. Determination of oenothein B as the active 5-alpha-reductase-inhibiting principle of the folk medicine Epilobium parviflorum. J Nat Prod 1996;59:490-2.
- Rzudkowska Bodalska H. Study of Epilobium parviflorum Schrib herb. Herb Pol 1987; 33(3):179-84.
- Commission of the European Communities Annex to Commission Directive 92/69/EEC of 31 July 1992 adapting to technical progress for the seventeenth time Council Directive 67/548/EEC on the approximation af laws, regulations and administrative provisions relating to the classification, packaging and labelling of dangerous substances. B.1 Acute toxicity (oral). Off J Eur Comm (L 383 A) 1992;35: 110-2.
Recibido: 28 de febrero del 2003. Aprobado: 31 de marzo del 2003.
Lic. Raiza Vega Montalvo. Centro de Investigación y Desarrollo de Medicamentos. Departamento de Investigación y Evaluaciones Biológicas. Calle 177 No. 6208 entre 62 y 64. Playa. La Habana, CP 11400. Cuba. E.mail: cinfa@informed.sld.cu
1 Licenciada en Ciencias Farmacéuticas. Master en Toxicología Experimental
2 Licenciada en Ciencias Farmacéutica. Investigadora Auxiliar.
3 Médico Veterinario
4 Técnico Medio en Química.