Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med v.10 n.2 Ciudad de la Habana Mayo-ago. 2005
Artículos originales
Facultad de Biología, Universidad de La HabanaDipartimento di Biologia, Universitá degli Studi Roma Tre de Roma
Istituto di Biologia e Patologia Molecolare, CRN de Roma
Extracto de frutos enteros de Punica granatum L. como agente protector del daño inducido por el peróxido de hidrógeno
Dr. Ángel Sánchez Lamar,1 Dra. Renata Cozzi,2 Dr. Enrico Cundari,3 Dr. Mario Fiore,3 Dr. Ruggeno Ricordy,4 Dr. Giuseppe Gensabella,3 Dra. Francesca Degrassi3 y Dra. Rosella De Salvia3
Resumen
Punica granatum L. (Punicaceae) es una planta medicinal cuyo fruto posee propiedades terapéuticas. El extracto obtenido a partir de frutos enteros se encuentra en fase de estudios preclínicos con el propósito de ser utilizado para el tratamiento de enfermedades virales. En los últimos años, algunas investigaciones experimentales han sido dirigidas al estudio de las propiedades antigenotóxicas de este extracto como una valiosa propiedad adicional. Algunos fitocomponentes del fruto de la granada muestran una actividad antioxidante potente y existen resultados experimentales que demuestran su capacidad como agentes antimutagénicos naturales. El presente trabajo expone los resultados obtenidos al valorar, en este extracto de granada, su capacidad de disminuir el daño inducido por el peróxido de hidrógeno en células de ovario de Hamster chino cultivadas in vitro. Se realizaron experimentos de carácter citogenético como es el intercambio de cromátidas hermanas y citofluorimétrico: la fluorimetría de la diclofluoreceína oxidada. En las condiciones experimentales de esta investigación, el extracto de frutos enteros de granada fue capaz de secuestrar especies reactivas del oxígeno producidas por el peróxido de hidrógeno, mecanismo mediante el cual ejerce su acción protectora del ADN frente a las lesiones causadas por este agente.
Palabras clave: Punica granatum L., células de ovario de Hamster chino, antigenotoxicidad, antimutagenicidad, peróxido de hidrógeno, intercambio de cromátidas hermanas.
Los antioxidantes naturales son estudiados ampliamente por su capacidad de proteger al organismos y a las células del daño inducido por las especies reactivas del oxígeno (ERO). El estrés oxidativo es considerado causa de enfermedades degenerativas, el envejecimiento, y el cáncer. En la actualidad se presta una especial atención a la posibilidad de modular los efectos perjudiciales del estrés oxidativo mediante el uso de compuestos naturales capaces de minimizar el daño celular y, en particular, el daño al ADN. En consecuencia, frecuentemente se realizan análisis experimentales con la finalidad de identificar productos naturales capaces de modular favorablemente los procesos mutagénicos y/o carcinogénicos.1
Punica granatum L., popularmente conocida como granada, es una planta con múltiples propiedades terapéuticas de arraigado uso en la medicina tradicional de Cuba y de otros países.2-9 Esta especie vegetal posee actividad anti-viral.10 En particular, el extracto de frutos enteros de granada ha exhibido una alta actividad contra el virus de la influenza y, en estos momentos, está siendo sometido a estudios preclínicos para recomendar su uso en el tratamiento de esta enfermad.11-13 En la literatura se ha descrito que las dosis de este extracto, eficaces como agente anti-influenza, no son tóxicas.14
Recientemente, algunos autores han aportado resultados experimentales acerca de las propiedades antimutagénica y anticarcinogénica del fruto de la granada y, adicionalmente, se plantea que algunos de sus fitocomponentes se comportan como potentes antioxidantes.7,15-20
En virtud de los elementos anteriores, el presente trabajo ha sido diseñado con el objetivo de investigar la efectividad del extracto de frutos enteros de granada como modulador del daño inducido al ADN por un agente oxidante como el H2O2 y encontrar una base racional que fundamente la propuesta de este extracto para su posible empleo en la prevención y terapia de enfermedades asociadas con el daño genético.
Métodos
▪ Extracto de frutos enteros de granada (EFG)
Frutos frescos de P. granatum fueron colectados de plantas salvajes, en la provincia La Habana, en julio de 2001 y su identificación fue confirmada por el Dr. Álvarez (40619 HAJB). El espécimen tipo de esta colecta se depositó en el Jardín Botánico Nacional, La Habana, Cuba. Los frutos (incluyendo la cáscara) se maceraron durante 15 días en solución de etanol al 50 % (v/v), a una proporción de 1:3 (w/v). El extracto fue filtrado y se removió el etanol por evaporación al vacío, con un evaporador rotatorio a 55º C. El extracto así obtenido se liofilizó y guardó a -20° C hasta el momento de su uso.
▪ Ensayos en células de ovario de Hamster chino (CHO)
Se realizaron experimentos de carácter citogenético y citofluorimétrico en células CHO cultivadas in vitro. Las células CHO crecieron en medio de cultivo Ham-F10 complementado con suero fetal de ternera (10 %), penicilina (5 000 IU/mL), estreptomicina (5 000 IU/mL) y L-glutamina (0,5 %), en una atmósfera de CO2 (5 %) a 37° C. Para todos los experimentos, se sembraron células a una densidad inicial de 1 x 106 en frascos de 5 mL, 24 h antes del inicio de los experimentos.
▪ Ensayo de Intercambio de Cromátidas Hermanas (SCE)
Los cultivos fueron tratados con concentraciones apropiadas (10 y 50 mg/mL) del extracto de frutos enteros de granada o con H2O2 6 x 10-5 M, durante 30 min; adicionalmente, se realizaron tratamientos combinados consistentes en añadir, simultáneamente, H2O2 y EFG durante 30 min. Una vez finalizado el tratamiento los cultivos fueron incubados en medio completo fresco con bromodeoxiuridina (BrdUrd) a una concentración final de 5 x 10-6 M. Transcurridas 26 h en tales condiciones, las células fueron fijadas para analizar los SCE.
En todos los cultivos se agregó colchicina (5 x 10-7 M) 2 h antes de que las células fueran fijadas. Para diferenciar las cromátidas hermana, se usó la técnica de tinción Giemsa-Hoechst, según lo indicado por De Salvia y colaboradores en 1999.21 Para cada punto experimental, los SCE fueron registrados en 40 metafases de segunda división mitótica (M2). El índice mitótico (IM) se determinó contando un total de 1 000 células. Los indicadores de mitosis sucesivas (M1, M2 y M3) se analizaron en un total de 100 metafases.
▪ Análisis citofluorimétrico
Las células se sembraron durante 15 min en PBS carente de Ca 2+ y Mg 2+ y con DCFH-DA (5 mM). A continuación se extrajo el medio de cultivo y se adicionó al cultivo de células NaCl (0,9 %) que contiene EFG y H202 (cotratamiento), durante 30 min. Finalizado el tratamiento las células fueron tripsinizadas y analizadas en un citofluorímetro FACSTAR (Becton Dickinson) equipado con una lámpara argón láser de 5 watt (Coherente) (emisión de 488 nm).
▪ Análisis estadístico
Para el análisis de SCE, se determinaron los valores medios y el error estándar. Los tratamientos y controles fueron comparados mediante la prueba t de Student. En el análisis citofluorimétrico, la intensidad de fluorescencia se expresó en unidades arbitrarias (au) y se determinó la desviación estándar. Los valores de intensidad obtenidos en los tratamientos y controles fueron comparados con la prueba t de Student.22
Resultados
Las concentraciones (10 y 50 mg/mL) del EFG probadas en este estudio, fueron seleccionadas a partir de que no resultaron genotóxicas para las células CHO, en experimentos precedentes a esta investigación realizados en el laboratorio del departamento de Biología Vegetal, Facultad de Biología, Universidad de La Habana.
En la tabla se observa que en las condiciones experimentales ensayadas, el EFG, por sí solo, no indujo niveles de SCE superiores a los del control no tratado. Además, no produjo reducción del índice mitótico lo cual significa que no afectó la proliferación celular.
Como era de esperar el H202 aumentó significativamente (p< 0,001) los SCE (20,1 SCE/cell) con respecto a los niveles del control no tratado lo que concuerda con los datos que aparecen en la literatura. Se conoce bien que en los sistemas biológicos el H202 puede inducir daño al ADN por sí mismo y/o a través de las especies reactivas del oxígeno.23,24 El daño oxidativo, en el ADN, incluye roturas de simple y doble cadenas, destrucción de bases nitrogenadas y uniones cruzadas de cadenas. Algunas de estas lesiones pueden conllevar a la formación de SCE.
El EFG usado en tratamiento combinado con H202 redujo la frecuencia de los intercambios inducidos por este agente, de manera particular, la reducción obtenida (40,3 %) con la concentración de 50 mg/mL resultó estadísticamente significativa (p< 0,001).
Tabla. Efecto del extracto de frutos completos de P. granatum (EFG) sobre la frecuencia de intercambios SCE inducidos por el H2O2 en células CHO
| Tratamientos | SCE / célula ± EE a | % R | IM % |
| Control | 8,9 ± 0,2 | 109 | |
| EFG 1 mg/mL | 7,0 ± 0,2 | 115 | |
| EFG 50 mg/mL | 7,7 ± 0,1 | 113 | |
| H2O2 6 x 10 - 5 M | 20,1 ± 0,3 | 78 | |
| H2O2 + EFG 10 mg/mL | 17,6 ± 0,3 | 12,4 | 99 |
| H2O2 + EFG 50 mg/mL | 12,0 ± 0,1 *** | 40,3 | 110 |
a: Media ± error estandar, IM: índice mitótico, %R: porcentage de reducción de SCE,
*** : p < 0,001 (prueba t de Student)
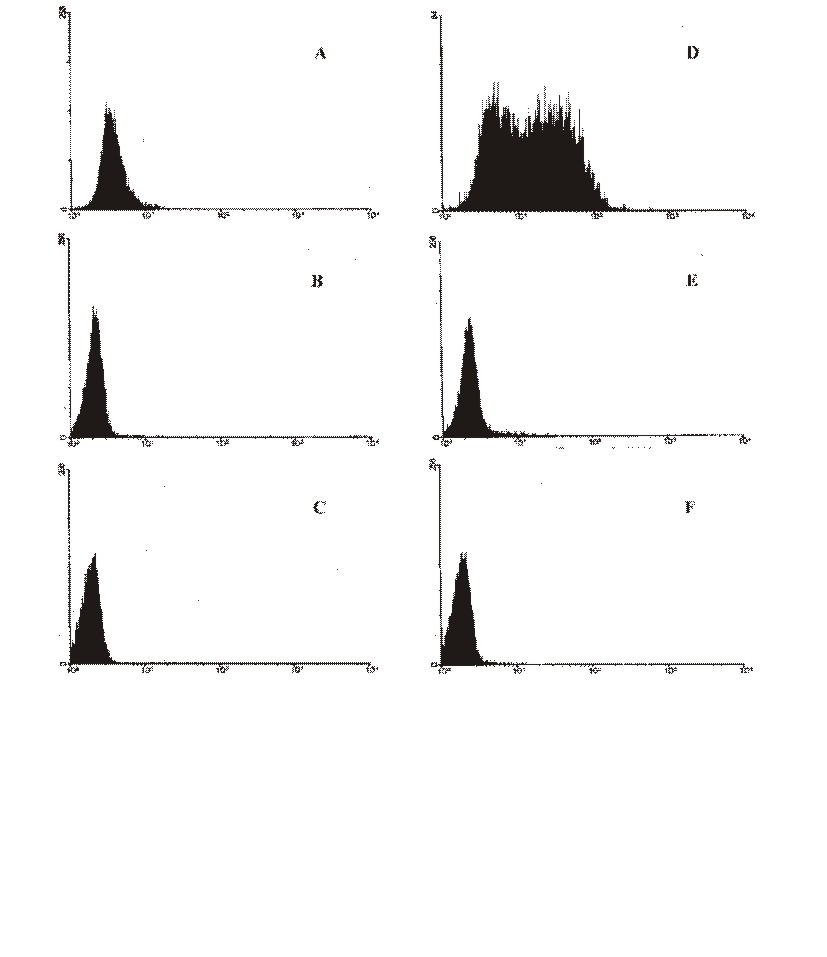
El ensayo citofluorimétrico permitió cuantificar y medir los niveles de oxidación causados por las especies radicalarias del oxígeno. En la figura, los histogramas representan el número de células (ordenada) como una función de intensidad de fluorescencia (abscisa). En las figuras 1B y 1C se muestra que el EFG, a las dosis usadas, no indujo especies oxidativas, al contrario, se observa una ligera disminución de los niveles basales de especies oxidantes endógenas generadas por el metabolismo celular. En la figura 1D, las células tratadas con H2O2 muestran un aumento significativo de la intensidad de la fluorescencia emitida; en los tratamientos combinados de H2O2 y EFG (figuras 1E y 1F) se aprecia una reducción significativa en la fluorescencia emitida, según la dosis de EFG, comparada con las células tratadas con H2O2 solamente.
Fig. Distribución de la fluorescencia emitida por células tratadas con DCFH. En la abscisa, intensidad de fluorescencia; en la ordenada, número de células contadas. A: control, B: extracto de frutos completos de P. granatum (EFG) a la concentración de 10 g/mL, C: EFG a la concentración de 50 g/mL, D: H2O2 (6 x 10-5 M), F: H2O2 + EFG 10 g/mL, G: H2O2 + EFG 50 g/mL.
Discusión
En las condiciones experimentales de esta investigación se ha demostrado la habilidad del EFG para reducir los SCE inducidos por H2O2. Estos datos están en concordancia con la actividad antioxidante del EFG consistente en reducir las especies reactivas del oxígeno responsables del daño cromosómico. La habilidad de atrapar las especies del oxígeno generadas por el H2O2 dentro de las células, se demostró con la prueba citofluorimétrica (ensayo con DCFH) donde, la disminución de la intensidad de fluorescencia emitida por las células sometidas a tratamientos combinados fue drástica.
Este ensayo fue descrito primeramente como un ensayo fluorimétrico del H2O2 y posteriormente se usó en varios estudios acerca del efecto de las especies reactivas del oxígeno sobre células en cultivo permanente.25-27 El fundamento del ensayo se basa en la premisa de que la DCFH-DA cruza la membrana celular y, una vez en el interior de la célula, es desacetilada por la acción de esterasas que la convierten en DCFH, compuesto no fluorescente que es más hidrofílico y no permeable a la membrana, que queda atrapado intracelularmente. En presencia de las especies reactivas del oxígeno, la DCFH es rápidamente oxidada a diclorofluoresceína (DCF) que es altamente fluorescente y puede ser cuantificada como células fluorescentes.
Actualmente se conoce que la oxidación de la DCFH es debida, particularmente, al H2O2 y el radical hidroxilo (OH·).28-30 Por consiguiente, las disminuciones observadas en los tratamientos combinados indicaron la capacidad del extracto de secuestrar este tipo de radical. Lo anterior puede considerarse como una de las vías de acción antioxidante de este producto natural.
El EFG es una mezcla compleja que contiene componentes fitoquímicos como: carbohidratos reductores, mucílagos, glucósidos, fenoles/taninos, flavonoides, antocianidinas y alcaloides.14 Adicionalmente, en la literatura internacional se plantea la presencia de coumarinas y esteroides en diferentes partes del fruto de granada.31,32 Estas clases fitoquímicas incluyen sustancias, como los fenoles, que son capaces de actuar como agentes secuestradores o quelantes de moléculas oxidantes.21 Particularmente el ácido elágico, lactona fenólica presente en la cáscara del fruto de granada tiene una fuerte actividad antioxidante, con demostrada acción secuestradora de radicales libres.33,34
Cozzi y otros en 1995, al evaluar la capacidad antioxidante del ácido elágico, mediante los mismos ensayos utilizados en este trabajo (SCE y citofluorimetría con DCFH), obtuvieron resultados similares a los observados en este estudio. Tal vez, el ácido elágico contenido en el fruto de granada, por sí mismo o en interacción sinérgica con otros componentes, sea responsable de la capacidad mostrada por el EFG de reducir el daño inducido por el H2O2 en el ADN de las células CHO. En tal sentido estudios complementarios futuros permitirán esclarecer a cual o cuales de los componentes del EFG se debe la propiedad que posee de proteger al ADN.
Agradecimientos
Los autores desean agradecer al Dr. Alberto Álvarez por ayudarnos en la recolección del material vegetal. Este trabajo fue apoyado por el convenio bilateral entre la Facultad de la Biología de Universidad de La Habana y el Instituto de Patología y Biología Molecular del CNR de Italia (Roma). Agradecemos también la contribución financiera del Ministerio Italiano de Asuntos Exteriores.
Summary
Punica granatum L. whole fruit extract as a protection against the hydrogen peroxide-induced damage
Punica granatum L. (Punicaceae) is a medicinal plant whose fruit has therapeutical properties. The whole fruit extract is under preclinical study, with the objective of being used for viral disease treatment. In the last few years, some experimental research has been aimed at studying the antigenotoxic characteristics of this extract as an additional valuable property. Some phytocomponents of Punica granatum L. fruit show powerful antioxidative activity and certain experimental results prove their capacity as natural antimutagenic agents. The present paper set forth the results achieved in evaluating the capacity of this extract to reduce hydrogen peroxide-induced damage in in vitro cultured ovarian cells from Chinese Hamster. Cytogenetic experiments such as the exchange of sister chromatids and the cytofluometric test, i.e, oxidized diclofluorescein fluorimetry were performed. Under the experimental conditions of this research work, the Punica granatum whole fruit extract could sequestrate reactive oxygen species caused by hydrogen peroxide, a mechanism that allows it to protect the DNA against the lesions provoked by this agent.
Key words: Punica granatum L., Chinese Hamster ovarian cells, anti-genotoxicity, anti-mutagenicity, hydrogen peroxide, exchange of sister chromatides.
Referencias bibliográficas
1. Cozzi R, Ricordy R, Aglitti T, Gatta V, Perticone P, De Salvia R. Ascorbic acid and b-carotene as modulators of oxidative damage. Carcinogenesis. 1997;18(1):223-8.
2. Roig JT. Plantas medicinales, aromáticas o venenosas de Cuba. La Habana:Ciencia y Técnica, Instituto Cubano del Libro;1974.p. 85-8.
3. Jiménez CA, Rojas N, López AM. Biological evaluation of cuban plants (IV). Rev Cubana Med Trop. 1979;31:29-35.
4. Arseculeratne SN, Gunatilaka AA, Panabokke RG, Studies of medicinal plants of Sri Lanka. Part 14: Toxicity of some traditional medicinal herbs. J Ethnopharmacol.1985;13:323-35.
5. Seoane J. El folklor médico de Cuba. La Habana: Editorial Ciencias Sociales; 1984. p. 29- 642.
6. Gracious Ross R, Selvasubramanian S, Jayasundar S. Inmunomodulatory activity of Punica granatum in rabbits: a preliminary study. J Ethnopharmacol. 2001;78(1):85-7.
7. Kim ND, Mehta R, Yu W, Neeman I, Livney T, Amichay A, et al. Chemopreventive and adjuvant therapeutic potential of pomegranate (Punica granatum) for human breast cancer. Breast Cancer Res Treat. 2002;71(3):203-17.
8. Vasconcelos LC, Sampaio MC, Sampaio FC, Higino JS. Use of Punica granatum as an antifungal agent against candidosis associated with denture stomatitis. Mycoses. 2003;46(5-6):192-6.
9. Murthy KN, Reddy VK, Veigas JM, Murthy UD. Study on wound healing activity of Punica granatum peel. J Med Food. 2004;7(2):256-9.
10. Zhang J, Zhan B, Yao X, Gao Y, Shong J. Antiviral activity of tanin from the pericarp of Punica granatum L. against herpes genital virus in vitro. Chung-Kuo-Chung-Yao-Tsa-Chih. 1995;20(9):556-8.
11. Peña BR, Martínez MT. Inhibición de la hemoaglutinación de cepas de influenza A por un extracto liofilizado de granada BLBU. Rev Cubana Quím. 2001; XIII: 395.
12. Peña BR. BLBU: un extracto de frutos de Punica granatum L. con actividad contra el virus de la Influenza [tesis]. La Habana: Facultad de Biología de la Universidad de La Habana; 1998.
13. Caballero O, Peña BR, Zurcher J, Ortín J, Martínez T. Actividad inhibitoria de extractos del fruto de Punica granatum sobre cepas del virus de la gripe. Rev Cubana Quím. 2001;XIII: 106.
14. Vidal A, Fallarero A, Peña BR, Medina ME, Gra B, Rivera F, et al. Studies on the toxicity of Punica granatum L. (Punicaceae) whole fruit extract. J Ethnopharm. 2003;89(2-3):295-300.
15. Alekperov UK. Plant antimutagens and their mixtures in inhibition of genotoxic effects of xenobiotics and aging processes. Eur J Cancer Prev. 2002;11(Suppl.2):S8-11.
16. Burton A. Chemoprevention: eat ginger, rub on pomegranate. Lancet Oncol. 2003;(12):715.
17. Hora JJ, Maydew ER, Lansky EP, Dwivedi C. Chemopreventive effects of pomegranate seed oil on skin tumor development in CD1 mice. J Med Food Fall. 2003;6(3):157-61.
18. Aviram ML, Dornfeld Kaplan M, Coleman R, Gaitini D, Nitecki S, Hofman A, et al. Pomegranate juice flavonoids inhibit low-density lipoprotein oxidation and cardiovascular diseases: studies in atherosclerotic mice and in humans. Drugs Exp Clin Res. 2002;28(2-3):49-62.
19. Chidambara Murthy KN, Jayaprakasha GK, Singh RP. Studies on antioxidant activity of pomegranate (Punica granatum) peel extract using in vivo models. J Agric Food Chem. 2002;50(17):4791-5.
20. Noda Y, Kaneyuki T, Mori A, Packer L. Antioxidant activities of pomegranate fruit extract and its anthocyanidins: delphinidin, cyanidin, and pelargonidin. J Agric Food Chem. 2002;50(1):166-71.
21. De Salvia R, Fiore M, Aglitti T, Festa F, Ricordy R, Cozzi R. Inhibitory action of melatonin on H2O2 and cyclophosphamide-induced DNA damage. Mutagenesis. 1999;14(1):107-12.
22. Sigarroa A. Biometría y Diseño Experimental. La Habana: Editorial Pueblo y Educación; 1985.
23. Oya Y,Taniimloto K, Tonomura A. The biological activity of hydrogen peroxide. Induction of chromosome-type aberrations susceptible to inhibition by scavengers of hydroxyl radicals in human embryonic fibroblasts. Mutat Res. 1986;172:245-53.
24. Rueff U, Bras A, Cristovao L, Mexia J, Sa da Costa M, Pires V. DNA strand breaks and chromosomal aberrations induced by H202 and 60Co gamma-radiation. Mutat Res. 1993;289:197-204.
25. Keston AS, Brandt R. The fluorimetric analysis of ultramicro quantities of hydrogen peroxide. Anal Biochem. 1965;11:1-5.
26. Yuan L, Inoue S, SaitoY, Nakajima.O. An evaluation of cytokines effects on intracellular oxidative production in neutrophils by cytometry. Exp Cell Res. 1993;209:375-81.
27. Vowells SJ, Sekhsaria S, Malech HL, Shalit M, Aeisher T.A. Flow cytometric analysis of the granulocyte respiratory burst: a comparison study of fluorescent probes. J Immunol. 1995;178:89-97.
28. Lebel CP, Alí SF, McKee M, Bondy SC. Organometal induced increases in oxygen reactive species: the potential of 2',7' - dichlorofluorescin diacetate as an index of neurotoxic damage. Toxicol Appl Pharmacol. 1990;104:17-34.
29. Lebel CP, Bondy SC. Oxidative damage and cerebral aging. Prog Neurobiol. 1999;38(6):601-9.
30. Zhu H, He M, Bannenberg GL, Moldeus P, Shertger HG. Oxidation pathways for the intracellular probe 2',7' - dichlorofluorescin. Arch Toxicol. 1994;68:582-7.
31. Hoelscher M. Exposure to phytoestrogens may surpass des residues. Feedstuffs. 1979;51:54-68.
32. Sotrus D. Polyphenol in pomegranate. Izv Vyssh Dchebn Zaveg Pishch.1984;3:117-9.
33. Nair AGR, Gunasegaran R Joshi B. Chemical investigation of certain south indian plants. Indian J Chem Ser. 1982;8(21):979-80.
34. Cozzi R, Ricordy R, Bartolini F, Ramadori L, Perticone P, De Salvia R. Taurine and ellagic acid: two differently-acting natural antioxidants. Environ Mol Mutagen. 1995;26:248-54.
Recibido: 20 de octubre de 2004. Aprobado: 22 de julio de 2005.
Dr. Ángel Sánchez Lamar. Universidad de La Habana, Fac. de Biología, Dpto. Biología Vegetal. Calle 25 No. 455, e/ J e I, Vedado, Plaza de La Revolución. La Habana, Cuba. Teléfono: +53-7-83 Fax: +53-7-8321321 e-mail: alamar@fbio.uh.cu
1Dr. en Ciencias Biológicas. Máster en Genética Vegetal. Profesor Auxiliar.
2Dra. en Ciencias Biológicas. Profesora Titular.
3Dr. en Ciencias Biológicas. Investigador.
4Dr. en Ciencias Biológicas. Investigador Jefe.
 Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons
Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons