Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med v.11 n.2 Ciudad de la Habana abr.-jun. 2006
Artículos originales
Laboratorio Central de Farmacología.
Facultad de Ciencias Médicas Dr. Salvador Allende.
Validación preclínica de extractos fluidos de Croton argenteus L.
DrC. Francisco Morón Rodríguez,1 Lic. María del Carmen Victoria Amador,2 Lic. Zulema Morejón Rodríguez,3 Lic. María Julia Martínez Guerra,4 Lic. Marisol López Barreiro5 y DrC. Víctor Fuentes Fiallo6
Resumen
Croton argenteus L. no es conocida como planta medicinal tradicional en Cuba; pertenece al mismo género de C. lechleri, de cuyo tronco se obtiene la sangre de grado o drago en los países amazónicos que tiene diversos usos etnomédicos para tratar problemas de salud como: diarrea, heridas, úlceras gastroduodenales, inflamaciones, dolor, picaduras de insectos e infecciones virales. Existen estudios sobre esta especie, sin embargo, no se encontraron publicaciones sobre esta planta que crece en Cuba. El objetivo fue validar, en extractos de C. argenteus, efectos reportados para la planta amazónica. Se prepararon 2 extractos fluidos de partes aéreas, sin tallos, secas con etanol al 30 y 80% y se realizaron estudios de: tamizaje fitoquímico, analgesia en contorsiones provocadas por ácido acético intraperitoneal y tránsito intestinal con carbón activado por vía oral en ratones; antiinflamatorio en granuloma inducido por algodón, lesiones gástricas inducidas por indometacina y toxicidad aguda oral con el modelo de clases tóxicas agudas en ratas. Las dosis administradas de ambos extractos fueron 500 y 1000 mg de material vegetal seco/kg p.o.). Los resultados no demostraron ninguno de los efectos farmacológicos estudiados. El extracto fluido 30% no resultó tóxico, pero el preparado con etanol al 80% clasificó como muy tóxico. Los extractos fluidos de partes aéreas sin tallos de C. argenteus carecieron de actividad para las acciones farmacológicas evaluadas.
Palabras clave: Croton argenteus L., antiinflamatorio, analgésico, antiulceroso, tránsito intestinal.
Croton argenteus L., sinónimos: Cieca argentea (L.) Kuntze, Julocroton argenteus (L.) Didr.), es una especie que no es conocida popularmente como planta medicinal en Cuba y pertenece a la familia Euphorbiaceae. Es un subfrútice o pequeño arbusto que puede alcanzar 80 cm o más de altura, la especie está bastante extendida por todo el país, pero principalmente en la región occidental, es segetal o maleza de los cultivos y propia de las orillas de los caminos o ruderal y está en floración-fructificación todo el año (figura 1). Su presencia en la Isla parece que no es muy antigua porque en la Flora de Cuba (Alain, 1953)1 no aparece referida; luego su introducción, o al menos, su distribución de forma extendida, debe ser posterior a esa fecha.
En las bases de datos MedPub, LILACS, SciELO y TOXMED la única referencia que se encontró, reportaba esta especie como reservorio de Aphis gossypii Glover (Aphididae), como vector del virus del melón en Costa Rica.2
La sangre de drago o grado, preparado tradicional, se obtiene de varias especies amazónicas del género Croton. Una revisión publicada considera que los usos etnomédicos de la sangre de drago se encuentran validados por los estudios publicados y que estos comprenden: diarrea, heridas, úlcera péptica, infecciones virales y la inflamación, dolor y picazón producida por picaduras de insectos. También se considera que la savia y sus preparaciones tienen poca toxicidad y que existen diversos fenotipos químicos, por lo que la composición de alcaloides varía de un área geográfica a otra.
El nombre de la especie, de donde se obtiene principalmente la sangre de drago, es C. lechleri Müll., pero se ha encontrado que se extrae de otras especies suramericanas como son: C. palanostigma Klotzsch, C. erythrochilus Müll., C. perspeciosus Croizat y C. rimbachii Croizat en Perú y C. urucurana Baillon en Brasil.3
La sangre de drago es vendida en los Estados Unidos como suplemento dietético, que es la categoría con la cual la Food and Drug Administration (FDA) registra los preparados herbarios para la comercialización.3 Las hojas de C. lechleri contienen alcaloides, aunque se reportan 3 quimiotipos. La savia tiene taninos, el 90 % por peso seco de proantocianidinas solubles, además posee flavonoles. La corteza presenta diterpenos y esteroides. Los alcaloides y las proantocianidinas o procianidinas son considerados los componentes más activos de la savia.3
La sangre de grado o drago (C. lechleri) ha mostrado actividad antimicrobiana, in vitro, contra Helicobacter pylori.4 Sin embargo, si se analiza críticamente la revisión publicada,3 podemos constatar que la mayoría de los estudios farmacológicos y toxicológicos han sido realizados con administración de fracciones activas o de taspina, el alcaloide activo mayoritario, y muchos de los modelos empleados son in vitro .
En Cuba, Roig reportó más de 13 especies de Croton empleadas tradicionalmente con fines medicinales como: el romero de costa (C. myricifolius Griseb) del cual se emplea la planta entera en decocción para baños como aromático, contra el reuma y para tomar en cocimiento para las enfermedades del estómago y contra el catarro. De otras especies se señala popularmente la utilidad para bajar la fiebre y antiespasmódico. La yerba de la Virgen de la Caridad del Cobre (C. nummulariaefolius A. Rich.) es usada como cocimiento de toda la planta por vía oral contra la colitis y toda clase de dolores de vientre.5
Trabajos científicos publicados prueban actividades farmacológicas de interés en varias especies del género Croton, aunque otros no avalan dichas acciones. Los extractos acuosos de corteza al 20 % de C. rhamnifolius y C. rhamnifolioides , por vía oral (0,5 a 2,0 g/kg) de corteza, no causaron efecto tóxico en ratas y en dosis de 0,5 y 1,0 g/kg no protegieron contra las lesiones gástricas inducidas por etanol 70 %. El extracto de C. rhamnifolioides (0,5 y 1,0 g/kg) no disminuyó las contorsiones abdominales inducidas por ácido acético en ratones. Ambos extractos, in vitro (2 a 20 mg/mL), presentaron un posible efecto relajante en el conducto deferente estimulado con acetilcolina y en el yeyuno de rata contraído con cloruro de potasio.6
Los objetivos del presente trabajo fueron: identificar los principales grupos de metabolitos secundarios, evaluar efectos farmacológicos de interés terapéutico y la toxicidad aguda oral sistémica de 2 extractos fluidos de partes aéreas sin tallo de C. argenteus .
Métodos
Material vegetal y extractos
Los extractos fluidos de partes aéreas sin tallos secas y molidas fueron preparados con etanol al 30 ó al 80% mediante el método de repercolación.
El material vegetal fue colectado por el DrC. Víctor Fuentes Fiallo, en la finca Reunión, Alquízar, La Habana. Una muestra fue depositada con el número ROIG 4743 en el herbario de la Estación Experimental de Plantas Medicinales Juan Tomás Roig. La planta se encontraba en floración-fructificación.
El secado del material vegetal se realizó en un horno con ventilación a 40 °C.
Empleamos los indicadores de control de calidad establecidos en las normas cubanas ramales de salud para droga,7 extractos y tinturas.8,9
Los valores del control de calidad del extracto fluido al 30% fueron: índice de refracción (? D 20 = 1,3574), porcentaje de sólidos totales (7,28 %), densidad relativa (1,0061) y contenido alcohólico (25,0 %). Para el extracto fluido al 80 % fueron: índice de refracción (ηD20 = 1,3683), porcentaje de sólidos totales (3,70 %), densidad relativa (0,8814) y contenido alcohólico (75,0 %).
Estudio fitoquímico
Luego de la preparación de los 2 extractos, se realizó el tamizaje fitoquímico a través de reacciones químicas de identificación, mediante cambios de color o formación de precipitados, destinadas a determinar la presencia de metabolitos secundarios: flavonoides (Shinoda), compuestos fenólicos (cloruro férrico), alcaloides (Dragendorff y Mayer), triterpenos y esteroides (Liebermann-Buchard), quinonas (Bortrager), compuestos lactónicos y cumarinas (Baljet), aminoácidos (ninhidrina), antocianidinas ( Rosemhein) y azúcares reductores (Fehling), presentes en ambos extractos.10
Estudio farmacológico
Contorsiones inducidas por ácido acético
Se utilizaron ratones machos, convencionales, no isogénicos OF-1 (20 - 25 g). Para los 2 experimentos, los animales fueron seleccionados al azar, en grupos de 10 ratones.
Los grupos controles negativos recibieron agua destilada, etanol 25 ó 75 %, de manera isovolumétrica, con la dosis administrada de extracto fluido correspondiente. A los animales del grupo tratado se les administró el extracto fluido 30 u 80 % de C. argenteus , en dosis de 500 ó 1000 mg de material vegetal/kg de peso corporal (p.c.).
El grupo control positivo recibió indometacina (10 mg/kg de p.c.) disuelta en bicarbonato de sodio al 4 %.
Los tratamientos de los grupos controles o con extracto fueron administrados por vía oral (p.o.) mediante sonda orogástrica.
A los 60 minutos de haber recibido el tratamiento correspondiente, se inyectó ácido acético al 0,75 % (0,1 mL/10g p.c.) por vía intraperitoneal (i.p.) y se dejó al animal en reposo en su caja para medir la variable: número total de contorsiones durante 15 minutos.11
Granuloma inducido por algodón
Se utilizaron ratas machos, no isogénicas, convencionales, de la línea Wistar (150-200 g). En cada experimento, los animales fueron seleccionados al azar para formar los diferentes grupos.
Los animales de los grupos controles negativos recibieron agua o etanol 25 ó 75 %, de manera isovolumétrica, con la dosis administrada de extracto fluido correspondiente.
Esta técnica consiste en hacer una incisión a cada lado de la línea media del dorso del tórax de cada animal, para introducir subcutáneamente 1 pellet de algodón de 50 mg, previo decolado de la piel, de manera que quedan situados aproximadamente a 3 cm de la herida. Se sutura con agrafes Michel y se añade antibiótico (0,5 mL de sulfato de estreptomicina 1 %) en la herida para evitar las infecciones.11
Los grupos tratados recibieron extracto fluido 30 u 80 % (500 ó 1000 mg de material vegetal/kg p.c.), en dosis única diaria, y el grupo control positivo recibió indometacina (5 mg/kg/día p.c.) disuelta en bicarbonato de sodio al 4 %, en dosis única diaria por 4 días. Al quinto día, se procedió al sacrificio de los animales y a la exéresis de los granulomas, estos se llevaron a peso seco constante en un horno con ventilación a temperatura de 150 + 10 o C durante 3 h. Los granulomas fueron pesados antes y después de este proceder, con el propósito de determinar las variables: contenido acuoso del granuloma (peso húmedo-peso seco = contenido acuoso) y contenido fibrogranuloso (peso seco-peso del pellet de algodón) en gramos.
Tránsito intestinal
La actividad sobre el tránsito intestinal fue estudiada en el modelo in vivo con ratones OF-1, privados de alimentos 12 h antes del experimento y distribuidos al azar en grupos de 10 animales. Fue administrado extracto fluido 80 %, por vía oral, en dosis 500 y 1000 mg de material vegetal seco/kg. El grupo control recibió etanol al 75 % en igual volumen que la mayor dosis.
A los 30 minutos, se administró una suspensión acuosa de carbón activado al 10 % (0,1 mL/10 g), por vía oral a todos los animales. Pasada 1 h, sacrificamos los ratones y extrajimos los intestinos delgados que fueron medidos, en milímetros, desde el píloro hasta donde se encontró más distal el carbón y la longitud total hasta la unión íleo-cecal, fue calculado el por ciento de avance del carbón con relación al largo total del intestino.12
Lesiones gástricas inducidas por indometacina
Se utilizaron ratas machos, no isogénicas, convencionales, de la línea Wistar (150-200 g), que fueron escogidas al azar para formar los grupos.
Los animales de los controles negativos recibieron agua y etanol 25 ó 75 %, de manera isovolumétrica con la dosis administrada de extracto fluido.
Los grupos tratados recibieron extracto fluido 30 u 80 % de partes aéreas sin tallos (500 ó 1000 mg de material vegetal/kg p.c.) y al control positivo se le administró ranitidina (50 mg/kg), todos por vía oral, 1 h antes del agente ulcerogénico.
Todos los grupos recibieron indometacina (10 mg/kg p.c.), disuelta en bicarbonato de sodio al 4 %, en dosis única por vía subcutánea.
Trascurridas 4 h, se procedió al sacrificio de los animales y a la exéresis de los estómagos, estos fueron abiertos por la curvatura menor.13 Las lesiones o úlceras gástricas fueron medidas, con el propósito de determinar las variables: número (cantidad de lesiones en cada estómago), severidad (la suma de los grados o puntuaciones de las lesiones en cada estómago) e índice de severidad (suma de la severidad de cada una de las lesiones dividida entre el número total de lesiones por estómago) de las lesiones. La severidad fue registrada en 5 grados o puntos: 1, lesión menor de 1mm; 2, entre 1-2 mm; 3, entre 2-3 mm; 4, entre 3-4 mm y 5, mayor de 4 mm.
Clases tóxicas agudas
Se emplearon ratas machos y hembras, no isogénicas, convencionales, de la línea Wistar (200 + 20 gramos).
El método usado fue el de las clases tóxicas agudas (CTA),14,15 se administró extracto fluido 30 u 80 % de partes aéreas secas por vía oral.
El extracto fluido al 30 % se suministró inicialmente a dosis máxima de 2000 mg de sólidos totales/kg de p.c., equivalente a 15,67 g de material vegetal seco/kg p.c.
El extracto fluido al 80 % fue administrado a dosis máxima de 2000 mg de sólidos totales/kg de p.c., por vía oral, equivalente a 740 mg de sólidos totales/kg, y posteriormente a dosis de 200 mg de sólidos totales/kg.
Los grupos controles recibieron isovolumétricamente etanol 25 ó 75 %.
Se emplearon 6 animales por dosis (3 de cada sexo), los grupos fueron conformados de manera aleatoria. Los animales fueron observados constantemente durante las primeras 4 h, la evaluación continuó diariamente durante 14 días. El protocolo de estudio tenía previsto registrar: las muertes en las primeras 24 h, cualquier signo clínico durante los 14 días de observación, el peso corporal al inicio y al final del ensayo. Al sacrificar los animales, se realizó un estudio macroscópico de los órganos.
Las observaciones clínicas a los animales incluyeron: comportamiento, estado físico general, mucosas nasales y oculares en busca de secreciones, palpación del abdomen, cambios en la piel y el pelaje, sistema respiratorio, circulatorio, nervioso central y autónomo, actividad somatomotora y se prestó especial atención a la posible ocurrencia de signos como temblores, convulsiones, diarrea, letargo, salivación, sueño y coma.
El estudio anatomopatológico se realizó a todos los animales al finalizar el tratamiento. La eutanasia se llevó a cabo mediante sobredosis de éter, para efectuar las correspondientes observaciones macroscópicas de los órganos: corazón, pulmones, riñones, bazo, hígado, estómago e intestino.
Procedencia y atención a los animales
Todos los animales empleados fueron suministrados por el Centro Nacional para la Producción de Animales de Laboratorio (CENPALAB) y mantenidos en cajas de poliuretano-T4 en el bioterio del Laboratorio Central de Farmacología, Facultad de Ciencias Médicas "Dr. Salvador Allende", a temperatura de 23 °C, humedad relativa de 50-60 %, un período de luz-oscuridad de 12 h cada uno, con libre acceso al alimento y al agua para ratones y ratas (ALYCO® CMO 1000). Estuvieron sin alimento, pero con libre acceso al agua, durante las 12 h antes del estudio.
Los estudios se realizaron cumpliendo las guías de buenas prácticas16 y para el cuidado y uso de animales de laboratorio.17
Procesamiento de los datos
Para el análisis estadístico de los resultados se sometieron a prueba de hipótesis de distribución normal de las variables estudiadas, con este propósito se utilizó el estadígrafo W y se encontró que se distribuyen normalmente. Entonces se aplicó el análisis de varianza de una vía (ANOVA) para determinar si existían diferencias entre las medias de los grupos. La prueba de Kruskal Wallis fue utilizada cuando las variables no cumplieron el criterio de normalidad.
El nivel de significación fue de 5 % (p < 0,05).
Resultados
Estudio fitoquímico
En la tabla 1 se pueden apreciar los metabolitos secundarios presentes en los extractos fluidos al 30 y 80 % de partes aéreas sin tallos secas; no encontramos diferencia en la composición entre ambos. Los metabolitos encontrados fueron: alcaloides, antocianidinas, flavonoides y aminoácidos.
Tabla 1. Metabolitos secundarios en los extractos fluidos de partes aéreas sin tallo secas de C. argenteus
| Metabolitos secundarios | Extracto fluido (etanol | Extracto fluido (etanol 80 %) |
| Alcaloides | + | + |
| Antocianidinas | + | + |
| Flavonoides | + | + |
| Compuestos fenólicos | - | - |
| Quinonas | - | - |
| Triterpenos y esteroides | - | - |
| Cumarinas | - | - |
| Aminoácidos | + | + |
| Azúcares reductores | - | - |
+ = presencia del grupo - = ausencia del grupo
Contorsiones inducidas por ácido acético
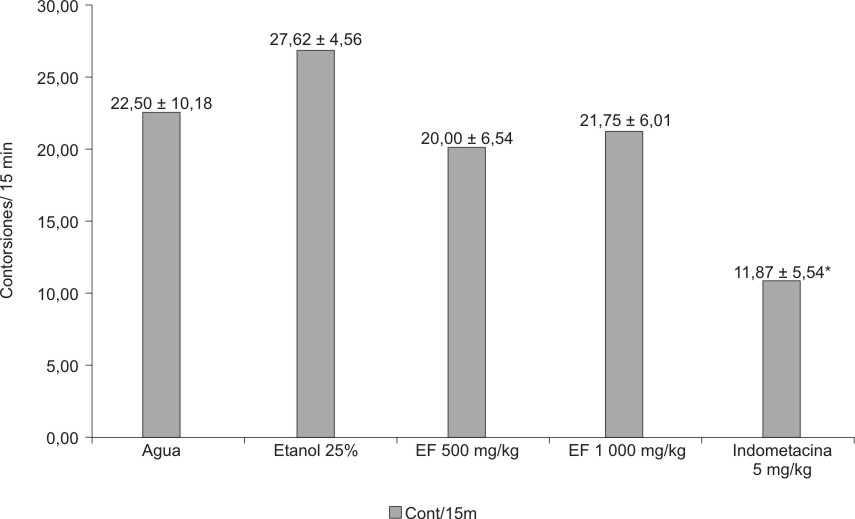
El ANOVA fue estadísticamente significativo (F = 5,576; p = 1,399e-03) para el extracto fluido al 30 % de partes aéreas sin tallos secas, administrados por vía oral, en dosis de 500 y 1000 mg de material vegetal seco/kg. Solamente el grupo control positivo tratado con indometacina 5 mg/kg/día p.o. disminuyó significativamente las contorsiones inducidas por ácido acético i.p. (figura 2). Para el extracto fluido al 80 %, el ANOVA también resultó significativo (F = 42,057 p = 1,000e -14) a expensas del grupo tratado con indometacina (figura 3).
Fig. 1. C. argenteus L. (Foto V. Fuentes).
EF = extracto fluido media ± desviación estándar* = p < 0,05.
Fig. 2. Efecto del extracto fluido 30 % de partes aéreas sin tallo
de C. argenteus sobre contorsiones inducidas por ácido acético en ratones.
EF = extracto fluido media + desviación estándar* = p < 0,05.
Fig. 3. Efecto del extracto fluido 80 % de partes aéreas sin tallo
de C. argenteus sobre contorsiones inducidas por ácido acético en ratones.
Granuloma inducido por algodón
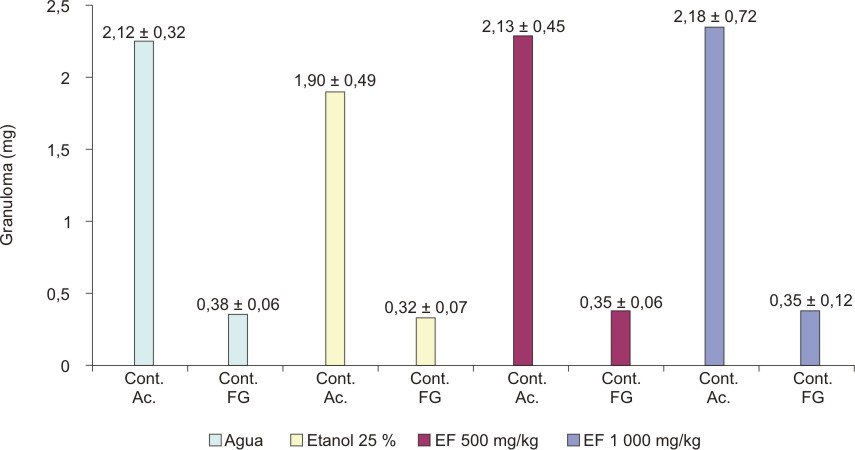
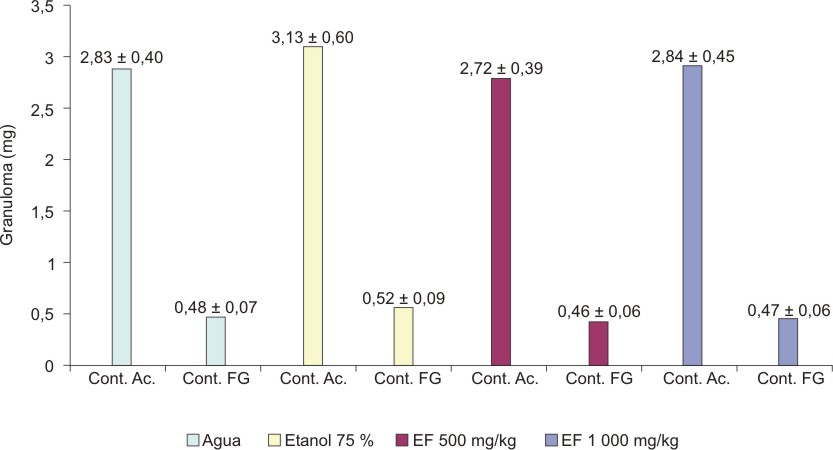
El extracto fluido al 30 %, administrado en dosis de 500 y 1000 mg de material vegetal seco/kg no modificó significativamente el contenido acuoso (F1 = 0,521; p = 0,6705) ni el fibrogranuloso (F2 = 0,676; p = 0,5726) en la respuesta inflamatoria inducida por pellet de algodón en ratas (figura 4). El extracto fluido al 80 %, en iguales condiciones, tampoco tuvo efecto significativo sobre las 2 variables evaluadas (F1 = 1,357; p = 0,2720 y F2 = 0,944; p = 0,4299) (figura 5).
EF = extracto fluido media + desviación estándar
Cont. Ac. = contenido acuoso; Cont. FG = contenido fibrogranuloso.
Fig. 4. Efecto del extracto fluido 30% de partes aéreas sin tallo
de C. argenteus en el granuloma inducido por algodón en ratas.
EF = extracto fluido media + desviación estándar
Cont. Ac. = contenido acuoso; Cont. FG = contenido fibrogranuloso.
Fig. 5. Efecto del extracto fluido 80% de partes aéreas sin tallo
de C. argenteus en el granuloma por algodón en ratas.
Tránsito intestinal
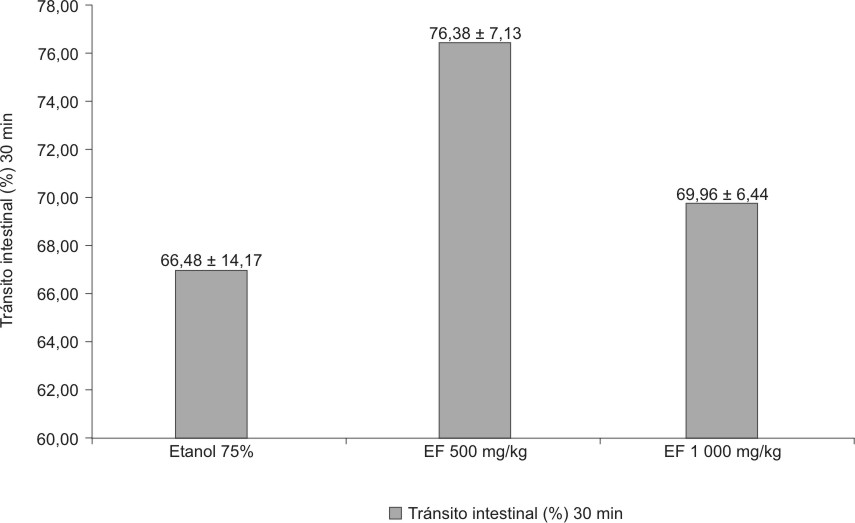
El extracto fluido al 80 % en dosis de 500 y 1000 mg de material vegetal seco/kg no modificó significativamente (F = 2,840; p = 0,0742) el tránsito intestinal con relación al etanol al 70 % (figura 6).
EF = extracto fluido media + desviación estándar.
Fig. 6. Efecto del extracto fluido 80 %
de C. argenteus sobre tránsito intestinal en ratones.
Lesiones gástricas inducidas por indometacina
Los extractos fluidos al 30 y al 80 % no disminuyeron significativamente las variables: número, severidad, índice de severidad de las lesiones gástricas inducidas por indometacina (figuras 7 y 8).
EF = extracto fluido media + desviación estándar* = p < 0,05
Num. Ulc. = número de lesiones; Sev. Ulc. = severidad de lesiones
Ind. Sev. = índice de severidad.
Figura 7. Efecto del extracto fluido 30 % de partes aéreas sin tallo
de C. argenteus sobre lesiones gástricas inducidas por indometacina en ratas.
EF = extracto fluido media + desviación estándar* = p < 0,05
Num. Ulc. = número de lesiones; Sev. Ulc. = severidad de lesiones
Ind. Sev. = índice de severidad.
Fig. 8. Efecto del extracto fluido 80 % de partes aéreas sin tallo
de C. argenteus sobre lesiones gástricas inducidas por indometacina en ratas.
Clases tóxicas agudas
El extracto fluido al 30 % (2 000 mg de sólidos totales/kg p.o.) no causó muerte, pero observamos signos clínicos de toxicidad como: poca actividad, somnolencia, dificultad para caminar y caída del tren posterior en algunos, que se recuperó a las 24 h. No se encontraron daños macroscópicos. El aumento de peso fue el esperado para los animales y no hubo diferencia significativa entre los tratados con relación a los controles (tabla 2).
Tabla 2. Efecto del extracto fluido 30 % de partes aéreas sin tallo secas de C. argenteus en el modelo de clases tóxicas agudas en ratas
| Tratamientos
| Días | |||||
| 0 | 7 | 14 | ||||
| H | M | H | M | H | M | |
| Etanol 25% | 236,66 | 192,33 | 238,00 | 258,66 | 248,66 | 297,66 |
| EF 2000 mg/kg | 228,00 | 193,33 | 233,00 | 264,66 | 252,66 | 307,00 |
Valores = medianas de pesos en gramos; H = hembras; M = machos.
El extracto fluido al 80 %, administrado en dosis de 750 mg de sólidos totales/kg p.o., causó muerte de 1 animal macho con signos hemorrágicos oftálmicos a las 24 h. Se apreciaron diversos signos clínicos de toxicidad, que fueron más marcados en los machos, con: letargo, caída del tren posterior, piloerección, falta de apetito. La recuperación ocurrió pasadas las 48 h. La dosis inferior de 200 mg/kg, que establece el modelo de CTA, no provocó muerte y el signo clínico de toxicidad observado fue somnolencia, que se recuperó a las 24 h. No se apreciaron daños macroscópicos en los órganos estudiados en los animales. El aumento de peso fue el esperado y no hubo diferencia significativa entre los tratados con relación a los controles (tabla 3).
Tabla 3. Efecto del extracto fluido 80% de partes aéreas sin tallo secas de C. argenteus en el modelo de clases tóxicas agudas en ratas
| Tratamientos | Días | |||||
| 0 | 7 | 14 | ||||
| H | M | H | M | H | M | |
| Etanol 75% | 224,00 | 186,33 | 235,00 | 253,33 | 251,66 | 304,66 |
| EF 200 mg/kg | 231,66 | 194,66 | 236,00 | 264,00 | 243,33 | 306,66 |
Valores = medianas de pesos en gramos; H = hembras; M = machos.
Discusión
Los extractos fluidos al 30 y al 80 % de partes aéreas secas contenían los grupos de metabolitos secundarios, los alcaloides y las antocianidinas, que se consideran los responsables de las actividades farmacológicas reportadas como comprobadas en la literatura, para la sangre de drago que se extrae principalmente de la savia del C. lechleri en los países amazónicos. El C. argenteus que se estudió, también posee flavonoides de igual manera a como se reporta para las especies de las cuales se obtiene tradicionalmente la sangre de drago.3
En nuestra hipótesis consideramos que, al menos alguna de las acciones principales reportadas para la sangre de drago, sería demostrable en los estudios farmacológicos preclínicos que se realizaron. Sin embargo, no se encontró actividad en ninguno de los modelos empleados. Este hecho podría explicarse simplemente porque se trata de 2 especies diferentes, aunque son del mismo género, y a que crecen en condiciones ecológicas completamente diferentes. El C. lechleri, la especie principal amazónica empleada para preparar la sangre de drago, es un árbol que alcanza tallas de 10 a 15 metros y que crece en la selva húmeda a alturas de 1000 metros por encima del nivel del mar;3 por el contrario, el C. argenteus es un pequeño arbusto que crece principalmente a nivel del mar.
Si se analizan cuidadosamente los artículos científicos publicados que reportan la comprobación de efectos de la sangre de drago, puede apreciarse que muchos de esos trabajos se hicieron administrando fracciones activas de alcaloides, antocianidinas e incluso con principios activos aislados, como la taspina.3
Puede citarse como ejemplo, el reporte sobre los extractos acuosos de corteza al 20 % de C. rhamnifolius y C. rhamnifolioides, por vía oral, que no causaron efecto tóxico en ratas y tampoco protegieron contra las lesiones gástricas inducidas por etanol 70 %, ni disminuyeron las contorsiones abdominales inducidas por ácido acético en ratones.6
La información publicada nos hace considerar que no todos los efectos farmacológicos supuestamente comprobados de la sangre de drago, están adecuadamente validados para sustentar científicamente sus usos tradicionales.
La toxicidad del extracto fluido al 80 % de partes aéreas sin tallos de C. argenteus pudiera ser expresión de presencia de compuestos activos de interés médico, como psicofármacos u otros grupos farmacológicos que suelen mostrar elevada toxicidad sistémica. Deben profundizarse las investigaciones para evaluar otras acciones y que los usos tradicionales por vía interna de preparados con partes aéreas secas de esta especie, no deben ser recomendados hasta que no se disponga de mayor información farmacológica y toxicológica.
Summary
Preclinical validation of fluid extracts from Croton argenteus L.
In Cuba , Croton argenteus L. is not known as traditional medicinal plant. It belongs to the same genus that C. lechleri , from whose trunk sangre de drago is obtained in the Amazonian countries. It has diverse ethnomedical uses to treat health problems, such as diarrhea, wounds, gastroduodenal ulcers, inflammations, pain, insect bites, and viral infections. There are studies on this species; however, no publications have been found on this plant growing in Cuba . The objective was to validate, in extracts from C. argenteus , the effects reported for the Amazonian plant. Two fluid extracts were prepared from aerial parts, without stalks, dried with ethanol 30 % and 80 %. Studies of phytochemical screening, analgesia in contortions caused by intraperitoneal acetic acid, and bowel transit with oral activated carbon were conducted in mice. The antiinflammatory effect was studied in the case of cotton-induced granuloma, indomethacin-induced gastric injury, and oral acute toxicity with the model of acute toxic lesions in rats. The administered oral doses of both extracts were 500 and 1000 mg of dry plant material /kg. According to the results, the expected pharmacological effects were not proved. The fluid extract (30 %) wasn't toxic, but preparation using ethanol 80% was. Fluids extracts of aerial parts without stalks of C. argenteus lacked activity for the evaluated pharmacological actions.
Key words: Croton argenteus L., anti-inflammatory, analgesic, antiulcerative, bowel transit.
Referencias bibliográficas
1. Alain H. Flora de Cuba. Contribuciones ocasionales del Museo de Historia Natural de La Salle. No.13 , VIII. La Habana : Imprenta de P. Fernández y Cía;1953.
2. Sánchez MV, Agüero R, Rivera C. Plantas hospederas de Aphis gossypii (Aphididae), vector de virus del melón Cucumis melo (Cucurbitaceae) en Costa Rica. Rev Biol Trop. 2004;49(1):305-11.
3. Jones K. Review of Sangre de Drago (Croton lechleri) - A South American tree Sap in the treatment of diarrhea, inflammation, insect bites, viral infections, wounds: traditional uses to clinical research. Alternative Complementary Med. 2003;99(6):877-96.
4. Tamariz Ortiz JH, Capcha Mendoza R, Palomino Cadenas EJ, Aguilar Olano JL. Actividad antibacteriana de la sangre de grado (Croton lechleri) frente al Helicobacter pylori . Rev Méd Hered. 2003;14(2):81-8.
5. Roig JT. Plantas medicinales aromáticas o venenosas de Cuba. 2da ed. La Habana : Editorial Científico-Técnica;1988.
6. Randau KP, Xavier HS, Dimech GS, Wanderley AG. Avaliaçäo preliminar da atividade farmacológica (antiespasmódica e antiulcerogênica) do extrato aquoso bruto de Croton rbamnifolius H. B. K. e Croton rbamnifolioides PAX & Hoffm. (Euphorbiaceae). Lecta-USF. 2002;20(1):61-8.
7. Cuba. Ministerio de Salud Pública. NRSP No. 309. Medicamentos de origen vegetal: droga cruda. Método de ensayos. La Habana : Editorial Ciencias Médicas;1992.
8. Cuba. Ministerio de Salud Pública. NRSP No.311. Medicamentos de origen vegetal: extractos fluidos y tinturas. Procesos Tecnológicos. La Habana : Editorial Ciencias Médicas;1992.
9. Cuba. Ministerio de Salud Pública. NRSP No. 312. Medicamentos de origen vegetal: extractos fluidos y tinturas. Métodos de ensayos. La Habana : Editorial Ciencias Médicas;1992.
10. Miranda M, Cuellar A. Manual de prácticas de laboratorio de análisis farmacognóstico. La Habana : Editorial Ciencia y Educación;1992.
11. Morón F, Furones JA, Pinedo Z. Ausencia de efectos antiinflamatorio y analgésico del extracto fluido de Cymbopogon citratus al 30 % por vía oral. Rev Cubana Plant Med. 1996;1(2):3-6.
12. García AJ, Martínez MC, Morón F. Actividad antiespasmódica de extractos de Piper auritum en intestino. Rev Cubana Plant Med. 2001;6(1):19-22.
13. Lapa JA, Monteiro de Lima TC. Métodos de evaluación de la actividad farmacológica de plantas medicinales. Sao Paulo: CYTED/CNPq; 2002.
14. Schlede E, Mischke V, Roll R, Kayser D. A national validation study of the acute-toxic-class method as alternative to the LD 50 test. Arch Toxicol. 1992;66:455-70.
15. Martínez MJ, Betancour J, Ramírez MR, Barceló H, Meneses R, Lainez A. Evaluación toxicológica aguda de los extractos fluidos al 30 y 80 % de Cymbopogon citratus (D.C.) Stapf. (caña santa). Rev Cubana Plant Med. 2000;5(3):97-101.
16. Cuba. Buró para la Protección de la Salud Pública. Principios de las Buenas Prácticas de Laboratorio no Clínico de Seguridad Sanitaria y Medioambiental: Regulación 39/2004. La Habana : El Buró Regulatorio;2004.
17. EE.UU. National Research Council. Guide for the Care and Use of Laboratory Animals. Washington, DC: National Academy Press; 2001.
Recibido: 9 de septiembre de 2006. Aprobado: 16 de septiembre de 2006.
Dr. Francisco Morón Rodríguez. Laboratorio Central de Farmacología. Facultad de Ciencias Médicas Dr. Salvador Allende Carvajal e/ Agua Dulce y A, Cerro, Ciudad de La Habana, Cuba, CP 12000. e-mail: moron@infomed.sld.cu Telf.: 406571 Ext. 1048
1Doctor en Ciencias Médicas. Profesor Titular de Farmacología.
2Licenciada en Ciencias Farmacéuticas. Investigadora aspirante.
3Licenciada en Química.
4Licenciada en Biología. Investigadora Agregada
5Licenciada en Bioquímica. Investigadora Agregada
6Doctor en Ciencias Médicas. Investigador Titular.