Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med v.12 n.4 Ciudad de la Habana oct.-dic. 2007
Artículos originales
Centro de investigación y desarrollo de medicamentos. CIDEM
Desarrollo tecnológico y estudio de estabilidad de un medicamento antiulceroso de origen natural
MSc. Nilia de la Paz Martín-Viaña,1 Lic. Iván Gastón Morales Lacarrere1 y Lic. Leonid Torres Amaro1
Resumen
Aloe vera L. es una planta nativa de la región mediterránea, posee variados usos farmacológicos como son cicatrizante, antiinflamatorio, analgésico, antitumoral, antiulceroso e hipoglicémico. Se llevó a cabo el diseño de formulación de una solución viscosa de esta planta medicinal, para ello se efectuó el estudio de formulación, a través de su desarrollo tecnológico, análisis microbiológico y estudio de estabilidad químico-física durante 12 meses, almacenada a temperatura ambiente en frascos de vidrio ámbar por 125 mL. Se obtuvo una solución viscosa correctamente formulada desde el punto de vista galénico, que presentó adecuadas propiedades mecánico-estructurales, resultó estable durante el tiempo de estudio y bajo las condiciones de almacenamiento ensayadas.
Palabras clave: Estabilidad, Aloe vera L., reología, solución viscosa, producto natural.
Aloe vera L. es una planta nativa de la región mediterránea, posee variados usos farmacológicos como son cicatrizante, antiinflamatorio, analgésico, antitumoral, antiulceroso e hipoglicemiante. En Cuba, se ha empleado en forma empírica en afecciones gastrointestinales,1 hepatitis crónica y hemorroides,2 tiene un alto valor curativo en enfermedades oftalmológicas, úlceras del estómago y asma bronquial entre otras.3 Además se le atribuyen otras propiedades, entre las que se encuentran antidisentérica, anticatarral y antineoplásica.
Aloe vera L. ha sido empleado en diferentes formulaciones orales, parenterales y tópicas, el extracto acuoso se ha utilizado para la confección de ungüentos, jaleas, inyecciones subcutáneas o intramusculares, cremas, jarabes y soluciones.
En este trabajo presentamos el desarrollo de un medicamento en forma de solución viscosa, que contiene como principio activo el 50 % m/v de extracto acuoso de Aloe vera L., confeccionado a nivel industrial a partir de las hojas completas de esta planta, mantenidas previamente en condiciones de baja temperatura y ausencia de luz según el método de Filatov,4 el cual planteó que en los tejidos de las hojas de Aloe vera L. se generaban estimulantes “biógenos” como resultado de los cambios químicos que se producen en respuesta a las condiciones adversas del medio. Estas “bioestimulinas” al introducirse en el organismo del humano intensifican los procesos curativos y regenerativos. Este producto tiene propiedades antiinflamatoria, cicatrizante y regeneradora de la mucosa gástrica, así como actividad inmunoestimulante.
Para lo anterior se desarrolló la formulación, se controló la calidad de los lotes de experimentación, se efectuó el estudio de preformulación a través de su desarrollo tecnológico, análisis microbiológico y estudio de estabilidad químico-física durante 12 meses, almacenada a temperatura ambiente en frascos de vidrio ámbar por 125 mL, se siguió la técnica del fabricante desarrollada y validada, lo que nos permitió establecer la fecha de vencimiento del producto natural desarrollado y obtener su registro como medicamento de uso humano en el Centro Estatal de Control de la Calidad de los Medicamentos de Cuba (CECMED).
Métodos
Desarrollo de formulación
Se desarrolló la formulación, se elaboraron varios ensayos tecnológicos preliminares con el objetivo de ajustar la técnica de preparación y el comportamiento del extracto acuoso de Aloe vera L. y de cada sustancia auxiliar a las concentraciones adecuadas. La solución viscosa obtenida se envasó en frascos de vidrio ámbar por 125 mL de capacidad nominal, con tapa para frasco pilfer de 28 mm de diámetro.
Se elaboraron 6 lotes, correspondientes a la formulación seleccionada, se envasó la preparación en los frascos de vidrio ámbar antes mencionados. Se almacenaron a temperatura ambiente y se rotularon como lotes 0001, 62, 63, 2001, 76 y 77.
Estudio microbiológico
A la preparación se le realizó el conteo de microorganismos totales y la prueba de efectividad de preservativos antimicrobianos, para ello el producto se contaminó con una concentración de 500 000 a 1000 000 de microorganismos/mL de S. aureus, P. aeruginosa, E. coli, C. albicans, A. níger y B. subtilis. Se realizaron siembras inmediatamente después de contaminado y a los 7, 14, 21 y 28 días, como se describe en la literatura. 5
Estudio químico-físico
a) Control de la calidad:
Se evaluaron las características organolépticas, se realizó la identificación a través de la determinación de derivados antracénicos, el carácter ácido-base (pH), densidad relativa, volumen por frasco y cuantificación de derivados de antraceno libres, según la técnica # 02-4 desarrollada y validada en el Centro de Investigación y Desarrollo de Medicamentos.
b) Estudios de estabilidad químico-física:
El estudio de estabilidad químico-física se efectuó por el método acelerado y de vida de estante, siguiendo la Regulación No. 23-2000 del CECMED, para el estudio acelerado se utilizaron muestras correspondientes a los lotes 2001, 76 y 77, se almacenaron a 40 ± 2°C y 75 ± 5 % de humedad relativa y se valoraron las muestras de los tres lotes al inicio, a los 3 y 6 meses.
Para el estudio de estabilidad por vida de estante, las muestras de los lotes 0001, 62 y 63 fueron almacenadas a temperatura ambiente (30 ± 2ºC), se valoraron al inicio, a los 3, 6, 9 y 12 meses de fabricado el medicamento.
Para el estudio de estabilidad se empleó el método utilizado en el control de calidad. Se basó en la formación de los fenolatos coloreados mediante la reacción entre el álcalis y los grupos fenólicos de los derivados de antraceno libres y su medición fotométrica a 525 nm, se utilizó como estándar la solución de cloruro de cobalto teniendo en cuenta que una solución de este al 1% del es equivalente a 0,43 mg de ácido crisofánico (oxiantraquinona) en 100 mL de solución alcalina amoniacal.
El comportamiento reológico se estudió al inicio y decursados 6 y 12 meses de elaborados los lotes 0001, 62 y 63, empleando el viscosímetro digital de rotación Haake, modelo RV 20, con sistema sensor M5/NV y un gradiente de velocidad comprendido entre 0-50.s-1 con un tiempo de corrida de 2 minutos. Se trabajó en ambiente termostatado a 30 ± 0,1°C. Fue utilizado un programa computarizado denominado Rotovisco, versión 2.3, de la firma Haake.
Resultados
Desarrollo de formulación
Se obtuvo una formulación líquida con característica viscosa, opalescente, que puede presentar o no partículas en suspensión, de color amarillo-carmelita y olor característico.
Estudio microbiológico
El ensayo de conteo microbiológico arrojó un conteo de bacterias de 30 unidades formadoras de colonias por mL (UFC/mL) y menos de 10 UFC/mL el de hongos.
En la efectividad de preservativo antimicrobiano germinaron en la primera siembra, S. aureus 1 000 000 UFC/mL, P. aeruginosa 1 000 000 UFC/mL, E. coli 1 000 000 UFC/mL, A. níger 1 000 UFC/mL. A los 7, 14, 21 y 28 días no se detectó contaminación.
Estudio químico-físico
a) Control de la calidad:
En la tabla 1, se muestran los resultados del control de calidad realizado a los lotes elaborados.
Tabla 1. Control de calidad
| Lotes | C. Org. | Identif. | pH | Den. rel (g/mL) | Vf (mL) | ADL (mg/%) | CM |
| 0001 | Cumple | Cumple | 5,6 | 1,025 | 119 | 0,31 | Cumple |
| E-62 | Cumple | Cumple | 5,7 | 1,026 | 119 | 0,24 | Cumple |
| E-63 | Cumple | Cumple | 5,8 | 1,004 | 117 | 0,31 | Cumple |
| E-76 | Cumple | Cumple | 5,7 | 1,003 | 119 | 0,26 | Cumple |
| E-77 | Cumple | Cumple | 5,7 | 1,002 | 118 | 0,25 | Cumple |
| 2001 | Cumple | Cumple | 5,9 | 1,027 | 119 | 0,31 | Cumple |
C. Org: Características organolépticas: Líquido viscoso, opalescente, que puede presentar o no partículas en suspensión, amarillo carmelitoso y olor característico.
Identif: Identificación de antracenderivados: coloración naranja rojiza en presencia de solución amoniacal.
pH: Carácter ácido-base: 6,0 ± 0,5.
Den. rel: Densidad relativa: 1,000 - 1,500.
Vf: Volumen por frasco: 118 ± 0,2.
ADL: Contenido de antracenderivados libres: 0,036 – 0,44 mg/%.
CM: Conteo microbiano: bacterias: menor de 103 UFC/mL, hongos: menor de 102 UFC/mL, ausencia de microorganismos patógenos.
b) Estudios de estabilidad químico-física:
En las tablas 2 y 3 se presentan los resultados de los estudios de estabilidad química acelerada (lote 2001, 76 y 77) y de vida de estante (lote 0001, 62 y 63), respectivamente.
Tabla 2. Resultados analíticos del estudio de estabilidad acelerada
| Lotes | Ensayos | Inicial | 3 meses | 6 meses |
| E-76 | C. organolépticas | Cumple | Cumple | Cumple |
| pH | 5,6 | 5,5 | 5,8 | |
| Valoración ADL (mg/%) | 0,3 | 0,24 | 0,25 | |
| E-77 | C. organolépticas | Cumple | Cumple | Cumple |
| pH | 5,7 | 5,7 | 5,6 | |
| Valoración ADL (mg/%) | 0,24 | 0,23 | 0,22 | |
| E-2001 | C. organolépticas | Cumple | Cumple | Cumple |
| pH | 5,6 | 5,7 | 5,63 | |
| Valoración ADL (mg/%) | 0,3 | 0,23 | 0,25 |
Límites: C. organolépticas: Líquido viscoso, opalescente, que puede presentar o no partículas en suspensión, amarillo carmelitoso y olor característico.
pH: 6,0 ± 0,5
Valoración ADL: 0,036 - 0,44 mg/%.
Tabla 3. Resultados analíticos del estudio de estabilidad por vida de estante
| Lote | Ensayos | Inicial | 3 meses | 6 meses | 9 meses | 12 meses |
| 0001 | C. organolépticas | Cumple | Cumple | Cumple | Cumple | Cumple |
| pH | 5,6 | 5,61 | 5,62 | 5,54 | 5,5 | |
| Valoración (mg/%) | 0,3 | 0,32 | 0,3 | 0,33 | 0,23 | |
| Conteo microbiano | Cumple | - | - | - | Cumple | |
| E-62 | C. organolépticas | Cumple | Cumple | Cumple | Cumple | Cumple |
| pH | 5,4 | 5,41 | 5,22 | 5,34 | 5,5 | |
| Valoración (mg/%) | 0,24 | 0,23 | 0,23 | 0,24 | 0,22 | |
| Conteo microbiano | Cumple | - | - | - | Cumple | |
| E-63 | C. organolépticas | Cumple | Cumple | Cumple | Cumple | Cumple |
| pH | 5,5 | 5,41 | 5,32 | 5,34 | 5,4 | |
| Valoración (mg/%) | 0,24 | 0,22 | 0,23 | 0,20 | 0,20 | |
| Conteo microbiano | Cumple | - | - | - | Cumple |
Límites: Características organolépticas, límites-líquido viscoso, opalescente que puede o no presentar partículas en suspensión, color amarillo carmelitoso con olor característico
pH límite: Entre 6,0 ± 0,5
Valoración, límites: 0,036 - 0,44 mg/%
Conteo microbiano: bacterias: menor de 103 UFC/mL, hongos: menor de 102 UFC/mL, ausencia de microorganismos patógenos
Al inicio y decursados 12 meses se obtuvieron en el rotoviscosímetro los reogramas correspondiente a un cuerpo con flujo no newtoniano:
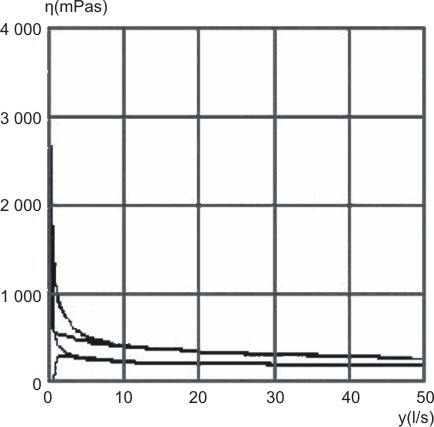
A: tiempo inicial
B: decursados 12 meses
Fig. 1. Curva viscosimétrica
Se comprobó a través de la relación entre el esfuerzo cortante y el gradiente de velocidad un comportamiento típico de un cuerpo pseudoplástico:
A: tiempo inicial
B: decursados 12 meses
Fig. 2. Curva de fluidez
Discusión
Desarrollo de formulación
Teniendo en cuenta las características organolépticas de la formulación obtenida podemos plantear que corresponde a una solución viscosa que cumple con los requerimientos de calidad farmacéutica establecidos en la técnica del fabricante (técnica # 02-4, CIDEM), además desde el punto de vista terapéutico son importantes sus características organolépticas en cuanto a su consistencia, ya que este medicamento es capaz de adherirse a su sitio de acción (estómago) y así ejercer de forma efectiva su acción farmacéutica como antiulceroso.
Estudio microbiológico
El conteo microbiológico demostró que la formulación no se encuentra contaminada microbiológicamente, cumpliendo con los límites establecidos en la literatura oficial al no existir microorganismos patógenos y el conteo de bacterias y de hongos ser menor de 103 UFC/mL y 102 UFC/mL, respectivamente. No obstante, la prueba de efectividad de preservativo antimicrobiano nos demostró que los preservativos antimicrobianos empleados protegen correctamente la formulación de la contaminación microbiana a la que pudiera estar expuesta durante la fabricación y el uso del medicamento por el paciente, ya que nos muestra cuantitativamente la inhibición de la carga microbiana que fue inoculada al inicio de esta prueba, al no detectarse contaminación microbiana decursados 28 días. De esta forma se demuestra la correcta acción de los preservativos antimicrobianos empleados en la formulación, así como se garantiza su estabilidad microbiológica durante su elaboración y uso por el paciente.
Estudio químico-físico
a) Control de la calidad:
Los resultados demostraron que se obtuvo una preparación farmacéutica que cumple con los requisitos de calidad descritos en la técnica del fabricante (técnica # 02-4, CIDEM), teniendo en cuenta que los ensayos químico-físicos efectuados cumplen con los límites establecidos. Se demostró la correcta elaboración de la formulación desarrollada.
b) Estudios de estabilidad químico-física:
El estudio acelerado nos permite predecir la estabilidad químico-física del medicamento debido a que pesar de estar sometido a condiciones de temperatura y humedad drásticas para el medicamento, se mantuvo estable cumpliendo con los límites establecidos, estos resultados pudieron corroborarse al analizar los obtenidos de la estabilidad en vida de estante, se demostró que pasados 12 meses de elaborado el producto mantiene su integridad químico-física, garantiza así su estabilidad terapéutica y su correcta formulación desde un punto de vista galénico.
Al analizar la curva viscosimétrica obtenida (figura 1) nos muestra un cuerpo con flujo no newtoniano, debido a que no existe una relación constante entre la viscosidad y el gradiente de velocidad, además la relación entre el esfuerzo cortante y el gradiente de velocidad demostró que al aplicar un esfuerzo inicial mínimo el sistema comienza a fluir, un comportamiento típico de un cuerpo pseudoplástico. Este comportamiento reológico se mantiene durante el tiempo y las condiciones de estudio ensayadas, se demostró la estabilidad mecánico–estructural del medicamento, indicativo de su estabilidad física durante 12 meses, similar en los 3 lotes ensayados.
Todos los resultados obtenidos son característicos del sistema físico-químico desarrollado, a partir de extracto acuoso de Aloe vera L. Se obtuvo una formulación en forma de solución viscosa como un medicamento de origen natural antiulceroso, que forma parte ahora de nuestro arsenal farmacéutico.
Summary
Technological development and stability study of an antiulcerous drug of natural origin
Aloe vera L. is a plant original from the Mediterranean region. It has diverse pharmacological uses as cicatrizant, antiinflammatory, analgesic, antitumoral, antiulcerous and glycemia lowering agent. The formulation design of a viscous solution of this medicinal plant was made. To this end, the formulation study was undertaken through its technological development, microbiological analysis and chemicophysical stability for 12 months stored at ambient temperature in amber crystal flasks of 125 mL. A viscous solution correctly formulated from the galenical point of view that presented adequate mechanical and structural properties was obtained. It was stable during the time of study and under the storage conditions assayed.
Key words: Stability, Aloe vera L., rheology, viscous solution, natural product.
Referencias bibliográficas
1. Litter M. Farmacología Experimental y Clínica. 7ma. ed. Argentina: El Ateneo;1986: 900-4.
2. González-Quevedo M. Compendio de Investigaciones sobre el A. barbadensis Miller (Sábila) cultivado en Cuba. La Habana: Inst. Sup. de Med. Militar Luis Díaz Soto;1990.
3. MINSAP. Sistema de Plantas Medicinales. FITOMED. La Habana: Editorial Ciencias Médicas;1991.
4. Filatov VP. Extracto de Aloe líquido para inyección. Farmacopea X URSS;1980.
5. Microbiological Attributes of Nonsterile Pharmaceutical Products.USP 29-NF 22S1 [serie en Internet]. [citado 28 sept 2007]. Disponible en:
support@usp.org
Recibido: 19 de septiembre de 2007. Aprobado: 24 de octubre de 2007
MSc. Nilia de la Paz Martín-Viaña. Calle 19 de Mayo No. 13, esquina a Amézaga, Plaza, Ciudad de La Habana, Cuba. CP 10 600. Teléfono: 8702536-38; 8781154. E-mail: nilia.delapaz@infomed.sld.cu















