Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med v.13 n.4 Ciudad de la Habana sep.-dic. 2008
ARTÍCULO ORIGINAL
Efecto sedante de extractos de las hojas de Pedilanthus tithymaloides (L.) Poit.
Sedative effect of extracts from Pedilanthus tithymaloides (L.) Poit. leaves
Hirán Cabrera SuárezI; Yanier Núñez FigueredoII
I Máster en Ciencias en Química Farmacéutica. Instructor. Laboratorio Central de Farmacología. Facultad Ciencias Médicas "Salvador Allende". Ciudad de La Habana, Cuba.
II Máster en Ciencias en Farmacología. Investigador Agregado. Centro de Investigación y Desarrollo de Medicamentos. Ciudad de La Habana, Cuba.
RESUMEN
INTRODUCCIÓN: Pedilanthus tithymaloides (L.) Poit. es comúnmente conocido como ítamo real, se le han atribuido numerosas aplicaciones terapéuticas.
OBJETIVOS: evaluar el efecto neurosedante de diferentes fracciones obtenidas de extractos de hojas de P. tithymaloides.
MÉTODOS: se realizaron sucesivas extracciones a partir de hojas secas trituradas, con el objetivo de obtener diversas fracciones mediante el empleo de solventes como tolueno, cloroformo y solvente hidroalcohólico (1:1); se evaluó su actividad neurosedante con el empleo del modelo de conducta exploratoria en ratones como indicativo de este efecto y los datos se procesaron con la prueba estadística de Duncan y un nivel de significación de p< 0,05.
RESULTADOS: de las fracciones obtenidas por cristalización fraccionada a partir del extracto toluénico, el To (triterpeno) mostró efecto sedante a dosis superiores a 100 mg/kg, la fracción que contenía el resto del extracto toluénico no mostró actividad. Por otra parte, el extracto clorofórmico también mostró efecto neurosedante, mientras que a partir del extracto hidroalcohólico se obtuvieron 2 fracciones por cambio de la polaridad del disolvente, las fracciones obtenidas resultaron tener una ligera actividad sedante; el crudo de fenoles redujo la conducta exploratoria a dosis de 200 mg/kg, mientras que la fracción remanente mostró actividad a dosis de 450 mg/kg.
CONCLUSIONES: el P. tithymaloides posee compuestos que le confieren efecto sedante.
Palabras clave: Neurosedante, extracto fluido, Pedilanthus tithymaloides, conducta exploratoria, plantas medicinales.
ABSTRACT
INTRODUCTION: Pedilanthus tithymaloides (L.) Poit is widely known as "itamo real" and numerous therapeutical applications have been attributed to it.
OBJETIVES: to evaluate the neurosedative effect of different fractions of extracts from P. tithymaloides leaves.
METHODS: succesives extractions were made from smashed dry leaves, with the purpose of obtaining several fractions using toluene, chloroform and hydroalcohol solvents (1:1); the neurosedative activity was also evaluated with an exploratory behaviour model in mice as an indication of this effect and data were processed with Duncan´s statistical test, with a level of significance of p< 0.05.
RESULTS: out of the fractions obtained by fractioned crystallization of toluene extract, triterpene showed sedative effect at a dose over 100 mg/kg. The fraction containing the rest of toluene extract revealed no activity. On the other hand, the chloroform extract also showed neurosedative effect whereas two other fractions were obtained from hydroalcoholic extract because of change of solvent polarity; these fractions exhibited slight sedative activity; the phenol crude reduced the exploratory behaviours at 200 mg/kg dose whereas the remaining fraction showed this kind of action at 450 mg/kg.
CONCLUSIONS: P. tithymaloides possesses some compounds that provide it with a sedative effect.
Key words: Neurosedative, fluid extract, Pedilanthus tithymaloides, exploratory behaviour, medicinal plants.
INTRODUCCIÓN
El estudio de los productos naturales representa una prioridad del estado cubano, comprobar las propiedades que se atribuyen a las plantas medicinales representa una importancia trascendental como alternativa en la terapéutica médica y como una fuente de obtención de nuevos fármacos. El ítamo real es el nombre popular que se le asigna en Cuba al Pedilanthus tithymaloides (L.) Poit. de la familia Euphorbiaceae, se emplea comúnmente como planta ornamental por su porte y por formar macizos. Además, ha sido utilizada como planta medicinal, se le atribuyen propiedades eméticas, antiblenorrágicas, pectorales, odontálgicas, antiherpéticas y se usa también en el tratamiento de bronquitis y laringitis. El látex que produce es muy usado en tratamientos de carcinomas y verrugas, en tanto que la raíz ha sido considerada como abortiva.1,2
Por otra parte, estudios preliminares realizados por instituciones separadas demostraron la presencia de ácidos grasos y triterpenos o esteroides (o ambos) en las hojas de P. tithymaloides,3,4 mientras que algunos reportes de la literatura hacen referencia a la acción neurosedante de triterpenos, entre otros.5,6
Por tal motivo, se llevó a cabo este trabajo con el objetivo de evaluar la actividad neurosedante de los extractos obtenidos de las hojas de P. tithymaloides.
MÉTODOS
Animales
Se emplearon ratas Wistar machos de 200 a 250 g de peso corporal para la evaluación de las estereotipias inducidas por anfetamina y ratones albinos Swiss 18-22 g para el resto de los ensayos; todos procedentes de la colonia de la UCTB Control Biológico del CIDEM. Se alojaron en sala con condiciones de temperatura controlada de 22 ± 2 °C, cama con viruta con cambio cada 48 h y un ciclo de luz-oscuridad de 12/12 h. El pienso peletizado CMO 1000®, dieta proveniente del Centro Nacional para la Producción de Animales de Laboratorio (CENPALAB), y el agua fueron administrados a libre demanda.
Actividad exploratoria
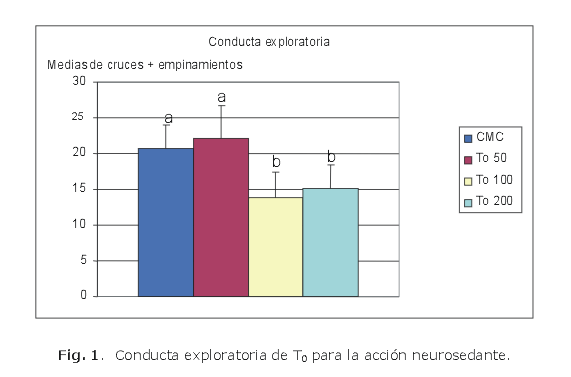
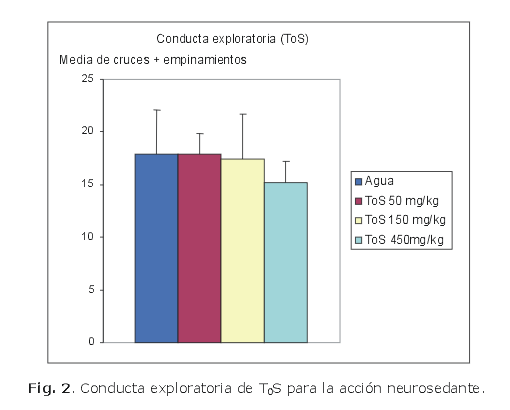
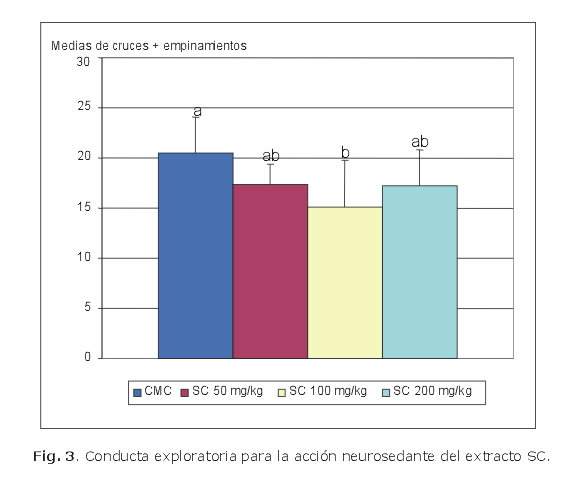
Las dosis empleadas fueron de 200, 100 y 50 mg/kg. En todos los experimentos se emplearon 10 animales por grupo. Después de 30 min de la administración del compuesto de ensayo, cada animal fue colocado en el centro de una caja de actividad exploratoria y se determinó el número de cruces y empinamientos durante 6 min (figs. 1, 2, 3 y 4).7,8
Procesamiento estadístico
Los resultados obtenidos en los diferentes ensayos se expresaron a través de la media ± desviación estándar; se procesaron mediante un análisis de varianza de una vía y posteriormente se realizó una prueba de Duncan con un nivel de significación de p< 0,05.9
Preparación de los extractos
Las hojas de P. tithymaloides se colectaron en las áreas del huerto de plantas medicinales del Instituto de Farmacia y Alimentos (IFAL) en diciembre de 2006, las cuales se encontraban en estado de floración. La planta fue identificada por la doctora Cassia Mónica Sakaraqui, con el número de herbario 6104 de la Universidad de Maringa, estado de Paraná, Brasil.
Las hojas recolectadas fueron secadas en estufa a una temperatura controlada de 40 °C por espacio de 3 d, luego se trituraron con ayuda de una tijera y fueron tamizadas a 5 mm aproximadamente.
Para la preparación del extracto toluénico se partió de 20 g de hojas previamente secadas y fraccionadas, se procedió a humectar la droga con 240 mL de tolueno durante 16 h, se enrasó después hasta un volumen de 1,5 L y se maceró durante 72 h; se coló y luego se desecó el extracto por rotoevaporación y se obtuvo un extracto toluénico seco (MT) de coloración oscura.
Una vez finalizada la maceración con tolueno se secó el material remanente a la sombra y se procedió a la extracción continua de 20 g del material vegetal remanente, con 500 mL de cloroformo por el método de Soxhlet durante 10 h; luego se procedió a la desecación del extracto por rotoevaporación hasta obtener el extracto seco (SC) de color amarillo.
Para la preparación del extracto hidroalcohólico, se partió de 20 g de las hojas remanente del extracto clorofórmico y secadas en la sombra durante 24 h, se humectó con 240 mL de la mezcla etanol/agua en una proporción 1:3 durante 48 h, luego se enrasó hasta un volumen de 2,5 L y se maceró durante 7 d, después el extracto se coló y se procedió a su desecación por rotoevaporación y se obtuvo un extracto seco (Mac/Etoh).
Se realizaron estudios cualitativos siguiendo el método de Chabrass10,11 y por cromatografía con empleo de placas delgadas de sílica gel (preelaboradas) G-60, F-254; se empleó como solvente de elusión cloroformo y como revelador, vapores de iodo y luz ultravioleta.
RESULTADOS
Los ensayos realizados a los extractos toluénicos (MT) y clorofórmicos (SC) mostraron que responden positivo al ensayo de Liberman-Buchard y al ensayo de Sudán IV, mientras que fueron negativos a Baljet, Drangerdorff y Bötranger. Por otra parte, el extracto hidroalcohólico resultó positivo a los ensayos de FeCl3, Shinoda, se consideró la presencia de compuestos fenólicos, o taninos y flavonoides, o ambos.
En el cromatograma del extracto de tolueno (MT) se reveló la presencia de abundante cantidad de metabolitos presentes, por lo que se llevó a cabo una cristalización fraccionada por cambio de polaridad de solvente con el objetivo de aislar los posibles triterpenos o esteroides, o ambos, que contiene el extracto; se obtuvo como resultado un sólido (T0) que posee un Rf= 0, el líquido madre resultante se desecó (T0S); ambos sólidos fueron destinados a la evaluación de la conducta exploratoria para determinar su efecto neurosedante.
Para el caso de T0 se determinó un efecto neurosedante a la dosis de 100 mg/kg y este efecto no dependió del incremento de la dosis. Sin embargo, en el caso de T0S no se encontraron diferencias significativas que demuestren efecto neurosedante a las dosis empleadas en este modelo.
Por otra parte, el cromatograma del extracto SC no manifestó complejidad química alguna; se observaron solo 2 manchas positivas al ensayo de Liberman-Buchard, mientras que para el estudio de la conducta exploratoria como neurosedante fue positiva la dosis de 100 mg/kg, donde también se evidenció que no existe dependencia de la dosis.
Se evaluaron los efectos del extracto seco hidroalcohólico (Mac/EtOH) sobre el sistema nervioso central y posteriormente se fragmentó por inversión de la polaridad del disolvente, para lo cual se predisolvió en 100 mL de agua y se le incorporó 300 mL de etanol a temperatura ambiente; la suspensión se almacenó en refrigeración durante 24 h y se separaron los sólidos por filtración. Los sólidos (CF) se lavaron con etanol a temperatura de entre 10 y 15 °C, el líquido madre (EA) se desecó por rotoevaporación; ambos sólidos que responden al ensayo de FeCl3 son evaluados sobre su actividad en el sistema nervioso central.
Los resultados obtenidos en la evaluación de la conducta exploratoria como neurosedante de ambos sólidos manifestaron un ligero efecto neurosedante.
DISCUSIÓN
El ensayo de Liberman-Buchard es positivo a la presencia de triterpenos o esteroides, o ambos, de estructura tetracíclica o pentacíclica;12 además, estos compuestos pueden responder positivamente al ensayo de Sudán IV, el cual permite reconocer la presencia de grasa.
No existe una diferencia fundamental entre los triterpenos y esteroides, estos últimos se consideran triterpenos tetracíclicos que han perdido como mínimo 3 metilos.12 Por otra parte, los 3b hidroxi de los triterpenos tetracíclicos se han aislado principalmente de las especies, que pertenecen a la familias de las Euforbiaceas.13
Uno de los métodos más usados para la extracción de los triterpenos tetracíclicos es el empleo de disolventes orgánicos,13 y a través de la inversión de la polaridad con solventes de mayor polaridad se puede lograr la precipitación de estos, lo cual constituye un método para el aislamiento de esos compuestos
Según el grado en que su estructura química afecte la acción biológica pueden considerarse compuestos de acción específica o inespecífica, en esta última, la actividad dependerá mucho más de las propiedades fisicoquímicas que de la estructura propiamente dicha; en cambio, para una actividad específica la estructura es de mayor importancia pero se deben considerar también las propiedades fisicoquímicas.14
Algunos depresores del sistema nervioso central, hipnóticos y agentes bactericidas poseen actividad inespecífica, que al parecer se debe a que interactúan con las membranas biológicas y producen cambios conformacionales en los biopolímeros susceptibles. De este modo inhiben su función, en cambio, existen también depresores del sistema nervioso central que su efecto es llevado a cabo a través de receptores específicos.14
El látex secretado por algunas decenas de especies pertenecientes a las Euforbiaceas es rico en diterpenos relacionados con los esqueletos del tigliano (ej: los ésteres de forbol), dafnano (ej: resinferol) o del ingenano (ej: ingenol), los cuales son compuestos tóxicos que se encuentran en concentraciones muy bajas, pero que son los principales responsables de dermatitis severas cuando el látex se pone en contacto con la piel.14
Los diterpenos son compuestos obtenidos con el empleo de solventes apolares o de mediana polaridad y constituyen parte de los principios activos que pueden responder al ensayo de sudan IV; por otra parte, algunas plantas ricas en diterpenos poseen efecto sedante y ansiolítico.14
Los ácidos grasos también son compuestos que se encuentran presentes en los extractos con solventes orgánicos, los compuestos pertenecientes a la serie alifática se consideran desde el punto de vista farmacológico sedantes del sistema nervioso central, mientras que los de la serie cíclica se consideran antipiréticos.15
Los flavonoides desde un punto de vista biológico son compuestos antioxidantes que no atraviesan con facilidad la barrera hematoencefálica, por lo que se les confiere entre otras actividades, acción antiinflamatoria, así como distintos efectos sobre el sistema hematopoyético; entre ellos, que disminuye la fragilidad capilar y el efecto hipotensor porque disminuye la resistencia vascular. Algunos de sus mecanismos descritos refieren la capacidad de formar quelatos con el Ca2+ intracelular,13 el cual es imprescindible para muchas de las funciones del sistema nervioso central.
Los resultados permiten concluir que la fracción T0, que al parecer es un triterpeno único obtenido por cristalización fraccionada del extracto toluénico (MT), mostró el mejor resultado como neurosedante en el modelo de actividad exploratoria; las fracciones obtenidas del extracto hidroalcóholico y la que resulta del extracto clorofórmico demostraron ligera actividad neurosedante; la fracción T0S que resulta de la cristalización fraccionada del extracto toluénico no mostró efectos neurosedantes a las dosis estudiadas en el modelo de conducta exploratoria.
REFERENCIAS BIBLIOGRÁFICAS
1. Cuba. Ministerio de Salud Pública. Plantas Medicinales (Fitomed III). La Habana: Editorial Ciencias Médicas; 1994. p. 34-5.
2. Roig J. Plantas medicinales, aromáticas y venenosas de Cuba. La Habana: Ed. Científico-Técnica; 1988: p. 242-373.
3. Sánchez Govín E, Pérez Lamas AM, Chávez Figueredo D, Hechevarría Sosa I. Caracterización farmacognóstica de Pedilanthus tithymaloides (L.) Poit. Rev Cubana Plant Med [periódico en la Internet]. 2005 Abr [citado 2008 Sep 19];10(1): Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S102847962005000100004&lng=es&nrm=iso
4. Cabrera H. Estudio químico y farmacológico de Pedilanthus tithymaloides (L.) Poit., Tesis de Grado de Máster en Ciencias, Instituto de Farmacia y Alimentos, Universidad de La Habana (IFAL UH), Ciudad de La Habana; 1999.
5. Osuna L, Pereda-Miranda R, Tortoriello J, Villarreal ML. Production of the sedative triterpene galphimine B in Galphimia glauca tissue culture. Planta Med. 1999;65(2):149-52.
6. Tortoriello J, Ortega A. Sedative effect of galphimine B, a nor-seco-triterpenoid from Galphimia glauca. Planta Med. 1993;59(5):398-400.
7. Tyler CB, Miczed KA. Effects of phencyclidine on aggressive behavior in mice. Pharmacol Biochem Behav. 1982;17:503-10.
8. Palanza P. Animal models of anxiety an depression: how are females different? Neuroscience Biobehavioral Reviews. 2001;25:219-33.
9. Sigarroa A. Biometría y Diseño Experimental. Ciudad de La Habana: Ed. Pueblo y Educación; 1985. p. 430.
10. Chabra SC, Viso FC, Mshin. EN: Phytochemical screening of Tanzanian Medicinal. Plants. I. J Ethnopharmacol. 1984;11:157-79.
11. Organización Mundial de la Salud. Métodos de control de calidad de plantas medicinales. Ginebra: OMS; 1992 (No. Serie 92/ 559).
12. Bruneton J. Elementos de fitoquímica y farmacognosia. Zaragoza: Editorial ACRIBIA; 1991. p. 298-345.
13. Cuellar A, Miranda M. Farmacognosia y productos naturales. La Habana: Editorial Félix Varela; 2001. p. 207-13.
14. Gómez González C, Bacallao Lauzardo N, Pérez Martínez J. Apuntes de química y síntesis de medicamentos. La Habana: Editorial Pueblo y Educación; 1989. p. 16-38.
15. Casamada San Martín R. Farmacognosia con farmacodinámica. Barcelona: Editorial Científico-Médica; 1968. p. 172-3.
Recibido: 12 de junio de 2008.
Aceptado: 28 de agosto de 2008.
M. C. Hirán Cabrera Suárez. Laboratorio Central de Farmacología. Facultad Ciencias Médicas "Salvador Allende". Carvajal s/n e/ Agua Dulce y A, Cerro. Ciudad de La Habana, Cuba, Teléf.: (53-7) 8776661 Ext. 1049. Correos electrónicos: irancs@infomed.sld.cu; yaniernf@infomed.sld.cu
Centro de Investigación y Desarrollo de Medicamentos














