Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med v.13 n.4 Ciudad de la Habana sep.-dic. 2008
ARTÍCULO ORIGINAL
Efecto del extracto acuoso de Aloe vera (L.) N. L. Burm. sobre indicadores lipídicos de suero de conejo
Effect of the water extract from Aloe vera (L.) N. L. Burm. on rabbit serum lipids
Juana Tillán CapóI; Marjorie Fernández NievesII; Rosa Menéndez CastilloIII; Carmen Carrillo DomínguezIV; Dariel Pérez GonzálezV
I Licenciada en Bioquímica Farmacéutica. Doctora en Ciencias Veterinarias. Investigadora Auxiliar. Centro de Investigación y Desarrollo de Medicamentos (CIDEM). Ciudad de La Habana, Cuba.
II Licenciada en Ciencias Farmacéuticas. CIDEM. Ciudad de La Habana, Cuba.
III Licenciada en Bioquímica Farmacéutica. Investigadora Auxiliar. CIDEM. Ciudad de La Habana, Cuba.
IV Técnica Farmacéutica. CIDEM. Ciudad de La Habana, Cuba.
V Técnico en Química. CIDEM. Ciudad de La Habana, Cuba.
RESUMEN
INTRODUCCIÓN: trabajos realizados con extracto acuoso y gel hojas de Aloe vera (L.) N. L. Burm., administrados a ratones en un modelo de hiperlipidemia aguda inducida con tritón, demostraron un efecto protector al incremento de los lípidos.
OBJETIVOS: estudiar el efecto de la administración a dosis repetida de extracto acuoso de A. vera sobre los indicadores lipídicos de suero de conejo.
MÉTODOS: conejos machos Nueva Zelandia fueron tratados con extractos acuosos de A. vera a las dosis de 17 y 34 mg/kg de peso corporal, sobre la base de sólidos totales durante 6 semanas, también se incluyó un grupo control sin tratamiento, el peso corporal, colesterol total, HDL-colesterol, LDL colesterol y triglicéridos fueron determinados al inicio y al final del período del experimento.
RESULTADOS: se encontró una disminución significativa del colesterol, LDL colesterol y triglicéridos en suero de los animales tratados con la dosis de 34 mg/kg de extracto acuoso al final del experimento, pero el HDL-colesterol no mostró variaciones.
CONCLUSIÓN: la administración de extracto acuoso de A. vera a conejo durante 6 semanas causó una disminución significativa de los lípidos en suero.
Palabras clave: Aloe vera, extractos acuosos, colesterol, LDL-colesterol, triglicéridos, conejos.
ABSTRACT
INTRODUCTION: the research works conducted with water extract and gel from Aloe vera (L.) N. L. Burm., administered to mice in a triton-induced acute hyperlipidemia pattern, showed a protective effect against the increase of lipids.
OBJETIVES: to study the effect of administration of water extract from A. vera at repeated doses on the lipid indicators of rabbit serum.
METHODS: male New Zealand rabbits were treated with water extracts from Aloe vera at doses of 17 and 34 mg/kg of bodyweight, on the basis of whole solids for 6 weeks. An untreated control group was included. Body weight, total cholesterol, HDL-cholesterol, LDL cholesterol and triglycerides were determined at the beginning and at the end of the experimental period.
RESULTS: it was found that cholesterol, LDL cholesterol and triglycerides significantly decreased in serum of animals treated with 34 mg/kg dose of the water extract at the end of the experiment, however, the HDL-cholesterol did not show any variation.
CONCLUSIONS: the administration of water extract from Aloe vera to a rabbit for 6 weeks significantly reduced serum lipids.
Key words: Aloe vera, water extracts, cholesterol, LDL-cholesterol, triglycerides, rabbits.
INTRODUCCIÓN
Las consecuencias de las alteraciones del metabolismo de los lípidos, particularmente la hipercolesterolemia y su relación con la ateroesclerosis, continúan siendo motivo de gran interés para médicos, bioquímicos, farmacólogos, biólogos, etc. Entre las enfermedades ateroscleróticas, los accidentes cardiovasculares y encefálicos constituyen hoy día la tercera causa de muerte en la mayoría de los países industrializados.1,2 En los países en vías de desarrollo, la muerte por estos trastornos ha ido creciendo en forma relativa y absoluta, doblando ya en algunos de ellos las muertes por causa de cáncer, en Cuba se mantiene en el tercer lugar.3
La principal enfermedad causante de los accidentes cardiovasculares es la ateroesclerosis, cuyas lesiones, los ateromas presentes en arterias coronarias, cerebrales, renales y aorta, disminuyen la luz de estos vasos que provocan problemas isquémicos agudos y crónicos en los órganos que ellos irrigan de sangre y oxígeno.4-6
Aloe vera (L.) N. L. Burm. comúnmente conocida como sábila,7 es una planta prometedora en lo que respecta a su uso en el sistema de salud, así lo confirman los variados efectos farmacológicos que se reportan tanto por su uso tradicional como los resultados de las experiencias científicas desarrolladas.8-10
Trabajos realizados con extracto acuosos y gel de A. vera administrados a ratones con hiperlipidemia aguda inducida con tritón, demostraron un efecto protector al incremento de los indicadores lipídicos,11 de ahí el interés de los autores de este estudio en continuarlos en otra especie, para evaluar la actividad de A. vera en administración a dosis repetidas sobre estos indicadores en suero de conejos, alimentados con la dieta estándar, según requerimientos de la especie.12
MÉTODOS
Animales
Se utilizaron 15 conejos machos albinos Nueva Zelandia de 2,0 a 2,2 kg de peso corporal suministrados por el Centro de Producción de Animales para Laboratorios (CENPALAB), los cuales fueron mantenidos en sala con temperatura controlada de 22 ± 2 °C y un ciclo de luz-oscuridad de 12/12 h. La alimentación consistió en Conejina® peletizada y agua a voluntad.
Sustancias de pruebas
El material vegetal se obtuvo de la Estación Experimental de Plantas Medicinales "Dr. Juan Tomás Roig" de San Antonio de los Baños, cuya muestra fue depositada en el herbario de la propia estación, identificada con el número de herbario ROIG 4591,
El extracto acuoso utilizado de A. vera (lote 03) fue elaborado en el Departamento de Productos Naturales del Centro de Investigación y Desarrollo de Medicamentos (CIDEM), a partir de la extracción de las hojas frescas en agua purificada sometida a ebullición durante 30 min en la proporción de 40 %.
Caracterización del extracto acuoso de Aloe vera
Se realizaron las determinaciones de pH, índice de refracción, densidad relativa, sólidos totales, polisacáridos totales sobre la base de manosa y antracenderivados, empleando las técnicas descritas en NRSP.13
El análisis microbiológico del extracto acuoso se hizo según la Farmacopea Británica.14
Tratamientos
Los animales fueron distribuidos al azar en 3 grupos: control sin tratamiento, extracto acuoso de Aloe 34 mg/kg y extracto acuoso de A. vera 17 mg/kg. La administración se realizó diariamente durante 6 semanas, mediante cánula intragástrica utilizando un factor volumen/peso de 5 mL/kg de peso corporal.
Procedimiento
Al inicio y al final del tratamiento los animales fueron sometidos a un ayuno de 18 h previo a la extracción de sangre de la vena marginal de la oreja, las muestras de sangre fueron centrifugadas a 2 500 rpm durante 10 min para la obtención de suero y la determinación de colesterol total, HDL colesterol y triglicéridos mediante un kit comercial de Boehringer Manhein (CHOD-PAP).
Los animales fueron pesados, al inicio, semanalmente y al final del experimento.
Los valores obtenidos en el muestreo inicial fueron tomados como niveles basales y se compararon con los obtenidos una vez terminado el tratamiento, mediante el uso de la prueba de t de Student15 para muestras pareadas.
El presente trabajo se realizó de acuerdo con las regulaciones internacionales establecidas y las Normas Éticas fijadas por CIOMS para el manejo de animales en la experimentación.16,17
RESULTADOS
Los resultados de la caracterización del extracto acuoso de A. vera fueron: pH 4,31, índice de refracción 1,335, densidad relativa 1,00, sólidos totales 0,68 %, polisacáridos totales 0,23 % y antracenderivados totales 5,29 mg/100 mL.
El análisis microbiológico cumple con los resultados por debajo de los límites: bacilos GP género Bacillos (bacterias 60 ufc/mL, hongos <10 ufh/mL) (límites hasta 1 000 ufc/g bacterias y 100 ufh/g de hongos). No Enterobacterias, no Pseudomonas aeruginosa, no Staphylococcus aureus, no Candida sp.
Los animales mostraron un incremento de peso normal para la especie, no existió diferencia significativa en el incremento medio de peso de los animales de cada grupo entre tratamiento, durante el período de las 6 semanas de experimentación (datos no mostrados).
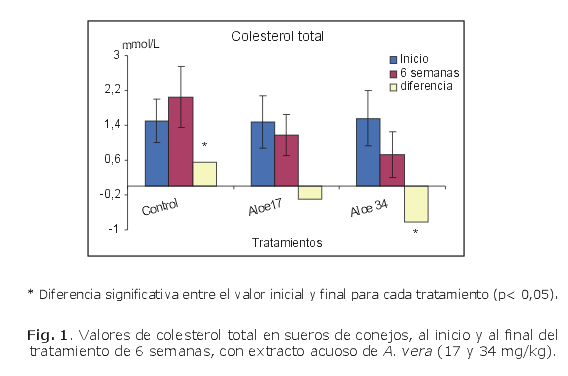
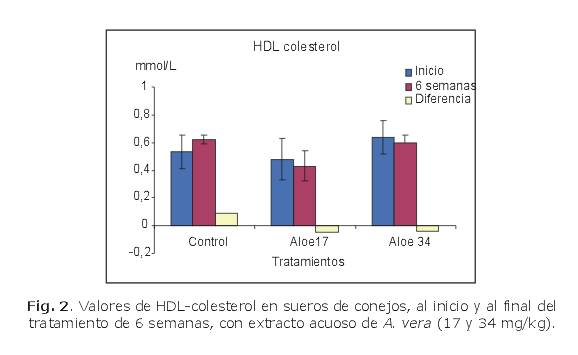
En las figuras 1, 2, 3 y 4 se muestra el comportamiento de los indicadores evaluados al inicio y al final del tratamiento (6 semanas), con extracto acuoso de A. vera a las dosis de 17 y 34 mg/kg de peso corporal sobre la base de sólidos totales.
El grupo control solo mostró disminución no significativa de los valores de triglicéridos y aumento significativo de los valores de colesterol total y LD- colesterol, en relación con sus correspondientes valores basales, mientras que el grupo tratado con A. vera a la dosis de 34 mg/kg mostró disminución significativa de los valores de colesterol total, LDL-colesterol y triglicéridos en relación con sus valores basales y con los valores del grupo control administrado solo con agua. Los valores de HDL-colesterol mostraron muy poca variación en relación con sus correspondientes valores basales.
DISCUSIÓN
El incremento de la concentración de colesterol total en suero del grupo control y la disminución significativa observada en el grupo tratado con extracto acuoso de A. vera a la dosis de 34 mg/kg de peso corporal, en relación con sus respectivos valores basales, son indicativos de un efecto hipocolesterolemiante del extracto evaluado. De igual forma, se pudo observar que esta disminución en los grupos tratados con A. vera resultó ser dosis dependiente.
Los valores de LDL-colesterol tuvieron un comportamiento muy similar a los valores de colesterol total, con un aumento en suero para los animales del grupo control y disminución significativa para el grupo tratado con la dosis alta de extracto acuoso de A. vera. Esto tiene un gran significado a la hora de plantear el efecto hipocolesterolémico de una sustancia, porque justamente estas lipoproteínas de baja densidad aseguran la mayor parte del transporte de colesterol en la sangre y tienen como función suministrar colesterol a las células del organismo, de aquí que se conozca como mal colesterol.18 También se ha podido demostrar, mediante estudios epidemiológicos, que la elevación del riesgo de infarto cardiaco está estrechamente relacionado con la elevación de las LDL-colesterol en sangre. Trabajos realizados en pacientes hiperlipémicos administrados con gemfibrozil han demostrado una reducción moderada de LDL-colesterol (11 %) y un aumento del HDL-colesterol (11 %), lo cual ha sido posible asociarlo con una disminución de 34 % de las enfermedades coronarias.19
Es posible que el tratamiento con A. vera produzca un aumento en la cantidad de receptores LDL hepáticos que ayuden a captar más LDL-colesterol circulante en la sangre, bien por una disminución del retorno de colesterol al hígado, ocasionado por la unión de la sustancia a los ácidos biliares o a través de una inhibición de la síntesis intracelular de colesterol, dado por un aumento de los receptores LDL o de la unión de LDL-colesterol a sus receptores, o ambos.18
Los valores de HDL-colesterol aumentaron ligeramente en los animales del grupo control y variaron muy poco en los animales tratados con extracto acuoso de A. vera. Llama la atención el comportamiento de este indicador cuyas variaciones en relación con los valores basales son pequeñas, aunque estudios anteriores realizados con este extracto mostró comportamiento muy similar para ese indicador.11 El HDL-colesterol se conoce como buen colesterol y su incremento en suero permite asegurar el retorno al hígado del colesterol liberado en la sangre por las células del organismo; de hecho, estas lipoproteínas se relacionan con una baja incidencia de infarto y por su acción en oposición al colesterol relacionado con las LDL-colesterol se le llama buen colesterol.18 El incremento en las HDL-colesterol también se considera un efecto beneficioso asociado a la disminución de infarto.19
Los valores de triglicéridos disminuyeron en todos los grupos, aunque solo en la dosis de 34 mg/kg de A. vera resultó ser significativo, aspecto de gran importancia, porque son pocos los fármacos capaces de provocar disminuciones significativas de los triglicéridos. Estos resultados coinciden con la disminución de triglicéridos reportada en el estudio del efecto hipolipemiante del extracto y el gel de A. vera en ratones, con un modelo agudo de hiperlipidemia inducido por tritón.11 Los resultados del presente trabajo también corroboran la disminución del colesterol plasmático en pacientes hiperlipidémicos tratados con A. vera reportado por Nasiff.20
A partir de los resultados obtenidos en este estudio se puede plantear que el efecto hipolipemiante dosis dependiente del extracto acuoso de A. vera, administrado durante 6 semanas en conejos bajo régimen normal de alimentación, confirma el uso popular de la planta en la disminución del colesterol plasmático.
REFERENCIAS BIBLIOGRÁFICAS
1. Rodríguez Mutuberría I, Galvazán Sánchez R, Alvárez González E. Neuromodulación farmacológica de la enfermedad cerebrovascular. Rev Cubana Med. 2002;41(2):98-110.
2. Otalta MT, Medriano MJ, Sierra MJ, Almazan J. Mortalidad por enfermedad cerebrovascular en España. Rev Neurol. 1999;29(8):872-8.
3. Ministerio de Salud Pública de Cuba. The Nacional Health Statistics Report Havana 2006; p. 1-87.
4. Goldstein JL, Brown MS. En JB Stanbury. The metabolic basic of iinherited diseases. 5ta ed. Ed. Mc Graw Hill; 1984. p. 33:672-6.
5. Litter M. Farmacología experimental y clínica. 7ma. ed. Buenos Aires, Argentina: Ed. El Ateneo; 1986; p. 900.
6. Kovanen PT. El control del colesterol. Rev Mundo Científico. 1985;55:156-5.
7. Roig JT. Plantas medicinales aromáticas o venenosas de Cuba. La Habana: Editorial Científico-Técnica; 1988. p. 698-9.
8. Kozac CA. Composición mineral de las hojas de Aloe y sus extractos. Reporte No. 2. Fisiologicheski-activnie Veshestva. 1997;9:302-7.
9. MINSAP. Plantas medicinales. FITOMED. La Habana: Ed. Ciencias Médicas; 1991.
10. González-Quevedo M. Compendio de Investigaciones sobre el Aloe barbadensis Miller (sábila) cultivado en Cuba. Ciudad de La Habana: Ed. MINFAR. Instituto Superior de Medicina Militar "Dr. Luis Díaz Soto"; 1990.
11. Tillán Capó JI, Gómez Mirabal JM, Menéndez Castillo R. Efecto hipolipemiante de Aloe vera L. Rev Cubana Plant Med. 2005;10(3-4):ISSN 1028-4796.
12. IFFA CREDO (Institut Francais de la Fièvre Aphteuse Centre de Recherche et d`Elevage du Domaine des Oncins). L´Arbresle, France: Edico Publicis. ATL/Pronted in France; 1990. p. 45.
13. NRSP 312 Norma Ramal de Salud Pública. Medicamentos de origen vegetal. Extractos fluidos y tinturas. Método de ensayo.1992. Ciudad de La Habana: Ed. MINSAP; 1992.
14. British Pharmacopoeia. London: Ed. Health Ministers; 2000. p. 1370.
15. Sigarroa A. Biometría y Diseño Experimental. La Habana: Editorial Pueblo y Educación; 1985. p. 430-9.
16. Guide for the care and use of laboratory animals. National Research Council. Washington: National Academy Press; 1996. p. 21-79.
17. CIOMS: Principios Guías Internacionales para las Investigaciones Biomédicas que implique animales, normas, documentos y ética médica. Ginebra: Consejo de Organizaciones Internacionales de Ciencias Médicas; 1985. p. 97-107.
18. Brown MS, Kovanen PT, Goldstein JL. Regulation of plasma cholesterol by liproprotein receptors. Science. 1981,212:628-32.
19. Frick MH, Elo O, Haapa K, Heinonen OP, Heinsalmi P, Helo P, et al. Helsinki Heart Study: Primary Prevention Trial with gemfibrozil in middle-aged men with dyslipemia. Safety of treatment, changes in risk factors and incidence of coronary heart disease. N Engl J Med. 1987;317(1)237-45.
20. Nasiff Hadad A, Fajardo Ferra R, Pablos Vélez ME. Efecto del Aloe sobre la hiperlipidemia en pacientes refractarios a la dieta. Rev Cubana Med Gen Integr. 1993;9:43-51.
Recibido: 8 de agosto de 2008.
Aprobado: 13 de agosto de 2008.
Lic. Juana Tillán Capó. Centro de Investigación y Desarrollo de Medicamentos (CIDEM). Ave 26 No. 1605 entre Ave. Boyeros y Calzada de Puentes Grandes, municipio Plaza, Ciudad de La Habana, Cuba. CP 10600. Correos electrónicos: juana@cidem.quimefa.cu; juana@infomed.sld.cu