Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med v.14 n.2 Ciudad de la Habana abr.-jun. 2009
ARTÍCULO ORIGINAL
Capacidad antioxidante in vitro de fracciones de hojas de Piper peltatum L.
In vitro antioxidant capacity of fractions from Piper peltatum L. leaves
Miguel A. Puertas-MejíaI; Luisa Gómez-ChabalaII; Benjamín RojanoIII; Jairo A. Sáez-VegaIV
I Doctor en Química. Instituto de Química, Facultad de Ciencias Exactas y Naturales, Universidad de Antioquia. Medellín, Colombia.
II Química. Instituto de Química, Facultad de Ciencias Exactas y Naturales, Universidad de Antioquia. Medellín, Colombia.
III Doctor en Ciencias Químicas. Escuela de Química, Universidad Nacional de Colombia. Sede Medellín, Medellín, Colombia.
IV Doctor en Ciencias Farmacéuticas. Instituto de Química, Facultad de Ciencias Exactas y Naturales. Universidad de Antioquia, Medellín, Colombia.
RESUMEN
INTRODUCCIÓN: el estudio de plantas medicinales se ha venido realizando desde hace décadas, por causa de su uso potencial como fuente de sustancias con propiedades biológicas. Piper peltatum L. ha presentado un sinnúmero de aplicaciones médicas, por lo que surge la necesidad de indagar su eventual capacidad antioxidante.
OBJETIVO: evaluar la actividad antioxidante de extractos no alcohólicos obtenidos de las hojas de P. peltatum.
MÉTODOS: hojas secas y pulverizadas fueron sometidas a cromatografía en columna y 3 fracciones fueron obtenidas. El potencial antioxidante se determinó sobre la base de la capacidad reductora medida por el ensayo de FRAP (ferric reducing ability of plasma) y de la capacidad de atrapamiento del radical estable 2-2-difenil-1-picrilhidrazilo (DPPH, 2-2-diphenyl-1-picrylhydrazyl).
RESULTADOS: aunque todas las muestras evaluadas mostraron buena capacidad antioxidante frente a los métodos aplicados, la identificada como fracción 1 fue la más promisoria, inclusive más eficiente que el ácido ascórbico (inhibición radical DPPH: 75 y 68 %, respectivamente).
CONCLUSIONES: los datos presentados en este estudio demostraron que todas las muestras evaluadas poseen propiedades antioxidantes, lo cual soporta el uso tradicional de P. peltatum para el tratamiento de diferentes afecciones de la piel y otras enfermedades.
Palabras clave: Piper peltatum, antioxidantes naturales, ensayo DPPH, ensayo FRAP, compuestos fenólicos, extracto no polar.
ABSTRACT
INTRODUCTION: medicinal plants have been studied for decades because of their potential use as sources of substances with biological properties. Piper peltatum L. has many medical applications, hence the need of ascertaining its eventual antioxidant capacity.
OBJECTIVE: to evaluate the antioxidant action of non-alcoholic extracts from P.peltatum leaves.
METHODS: dry powered leaves were subjected to column chromatography, thus obtaining three fractions. The antioxidant potential was determined based on the reducing capacity as measured by FRAP assay (ferric reducing ability of plasma) and the trapping capacity of stable radical 2-2-diphenyl-1-picrylhydrazyl (DPPH assay).
RESULTS: although all the evaluated samples showed good antioxidant capacity in comparison to the applied methods, fraction #1 was the most promising, being more efficient than ascorbic acid (radical DDPH inhibition; 75 and 68 % respectively).
CONCLUSIONS: the data provided in this study proved that all the evaluated samples had antioxidant properties, all of which endorses the traditional use of P. peltatum for treatment of several skin diseases and other kind of ailments.
Key words: Piper peltatum, natural antioxidants, DPPH assay, FRAP assay, phenolic compounds, non-polar extract.
INTRODUCCIÓN
En la franja tropical de América del Sur existe una gran variedad de plantas pertenecientes a la familia Piperaceae, tanto en número de especies como en sus diversas funcionalidades biológicas. En Colombia, esta familia está representada por los géneros Piper, Peperomia, Trianopiper y Pothomorphe y por más de 400 especies,1 algunas de ellas muy conocidas por su actividad biológica como agentes insecticidas, hemostáticos, antimaláricos y fungicidas, así como también para el tratamiento de úlceras externas.2-5 La especie Piper peltatum L. o Pothomorphe peltata (L.) Miq. distribuida ampliamente en Colombia se conoce popularmente como "cordoncillo" o "santa maría"; crece en sitios parcialmente cubiertos en forma de maleza y tiene diversas aplicaciones como diurético, antipirético y como agente antiinflamatorio de uso interno y externo en algunas regiones de la Amazonía peruana y boliviana.6-8 Adicionalmente, en la región noroccidental de Colombia ha sido usada como antídoto contra picaduras de serpientes.9 De esta especie se han aislado y caracterizado un gran número de compuestos químicos, como amidas, lignanos, neolignanos, hidroquinonas, alcaloides, terpenos, compuestos oxigenados, y derivados del ácido benzoico.10-12 La función de los compuestos fenólicos aislados de plantas está asociada a su similitud estructural con sustancias antioxidantes de origen sintético.13-16 Las propiedades biológicas y químicas de las plantas medicinales dependen de muchos factores, entre las cuales figuran las propiedades edáficas de la región de cultivo, las condiciones del clima, fase vegetativa, entre otros, razón por la cual es importante el estudio de la flora en diferentes sitios, países y zonas geográficas. Luego, el objeto de estudio de la presente investigación es evaluar el efecto antioxidante de un extracto no-polar de las hojas de P. peltatum, especie que se encuentra en forma silvestre en la región noroccidental de Colombia. El resultado ayudará a entender su potencial medicinal y el significado que tiene para las comunidades locales.
MÉTODOS
Material vegetal: las hojas de P. peltatum fueron recolectadas en el área rural del departamento de Córdoba (Colombia). Un espécimen fue depositado en el Herbario de la Universidad de Antioquia (voucher, Callejas, No. 7919).
Obtención de los extractos: 450 g de hojas secas y pulverizadas fueron sometidos a percolación con éter de petróleo a temperatura ambiente (c.a. 25 °C). Posteriormente, al material desengrasado se le realizó una extracción con hexano hasta obtener 50 g (rendimiento 11,1 % p/p) de extracto crudo. Luego, 20 g del extracto crudo se sometió a cromatografía flash en columna usando sílice gel como relleno (Merck, Darmstadt, Alemania) y empleando como fase móvil mezclas de hexano-acetato de etilo con incrementos de polaridad. Con el fin de monitorear las fracciones activas del extracto crudo, se llevó a cabo un seguimiento por cromatografía en capa fina (TLC, Thin Layer Chromatography), rociando las placas de TLC (que contenían entre 0,1 a 50 µg de muestra) con una solución DPPH (0,2 % v/v) en metanol. Las fracciones activas presentaron manchas amarillas después de 30 min de contacto con la solución de DPPH, lo cual se confirmaba con una placa blanca (solo contenía DPPH, color púrpura). Finalmente, 3 fracciones fueron aisladas y su efecto antioxidante fue determinado.
Análisis fitoquímico: se llevó a cabo la determinación de quinonas libres, alcaloides, terpenoides, cumarinas y flavonoides de las fracciones aisladas de acuerdo con el método descrito por Douhou y otros.17
Estudio de la capacidad antioxidante
Contenido de fenoles totales (CFT): los fenoles totales se determinaron mediante el método de Folin-Ciocalteau descrito por Nurmi y otros18 con algunas modificaciones. Una alícuota de 0,5 mL de la solución problema (con una dilución apropiada para obtener un valor de absorbancia en el intervalo de concentraciones de la curva de calibración previamente preparada) se mezcló con 1,0 mL del reactivo FolinCiocalteau y se dejó reaccionar durante 5 min a 30 °C en cuarto oscuro. Luego, 2,0 mL de una solución saturada de Na2CO3 se adicionó y la mezcla se dejó en reacción por 1 h; la absorbancia se midió a 765 nm. Los resultados fueron expresados como miliequivalentes de ácido gálico (mEqAG) por gramo de muestra.
Ensayo de DPPH: el estudio del efecto secuestrador de radicales de cada fracción en diferentes concentraciones se estimó de acuerdo con la metodología descrita por Puertas-Mejía y otros19 y la concentración efectiva (EC50) a la cual 50 % de DPPH fue removido, se expresó como kg extracto/mmol DPPH, basada en la ecuación siguiente:
EC50 = concentración de la muestra en el estado estacionario/concentración de DPPHt=0
En resumen, una alícuota (0,1 mL) de cada muestra (con la dilución necesaria) se adicionó a 2,0 mL de una solución etanólica de DPPH (0,1 mM). Inmediatamente después, se midió la absorbancia a 514 nm y luego a 1, 2, 3, 4, 5, 10, 15 min y, después, cada 15 min, hasta la obtención del estado estacionario en la reacción o una disminución en la absorbancia menor que 10 %. La concentración inicial exacta del DPPH en el medio de reacción se determinó mediante una curva de calibración de soluciones de DPPH (2,5 a 100 µM) medidas a 514 nm. Todos los experimentos se realizaron por triplicado.
Ensayo de FRAP: se usó el método descrito por Benzie y Strain20 con algunas modificaciones. Una alícuota (0,05 mL) de cada muestra se adicionó a 0,9 mL de una solución que contenía el reactivo de FRAP (buffer de acetato de sodio 0,3 µM, pH 3,6; 10 µM de tripiridiltriazina [TPTZ] en una solución 40 mM de HCl y 20 µM FeCl3 6H2O) y la mezcla de reacción se incubó por 30 min a 37 °C. La absorbancia se determinó a 593 nm. La capacidad de las muestras de reducir el ion férrico se calculó a partir de la curva de calibración y la capacidad antioxidante se expresó como miligramos de ácido ascórbico por 100 g de muestra seca. Todos los ensayos se realizaron por triplicado. Con el fin de evaluar la sensibilidad de los 2 métodos, se usaron sustancias de referencia (ácido ascórbico, trolox y BHA (tert-butil hidroxianisol) en diferentes concentraciones (entre 1 y 15 g/L), en dependencia de la actividad de estas sustancias. Todos los experimentos de actividad antioxidante se realizaron en un espectrofotómetro ThermoSpectronic Genesis 2. Los análisis se hicieron en cubetas desechables (1 cm x 1 cm x 4,5 cm).
Análisis estadístico: los diferentes valores mostrados en las tablas y figuras corresponden al promedio ± las desviaciones estándares de 3 mediciones en paralelo. Los datos de la EC50 fueron calculados a partir de curvas de calibración. Adicionalmente, se determinó la correlación que existía entre la capacidad antioxidante y el contenido de fenoles, usando el método de análisis por regresión lineal.
RESULTADOS
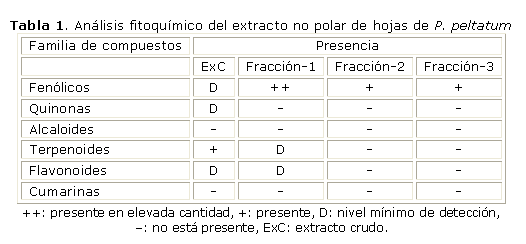
La composición fitoquímica del extracto crudo y de las 3 fracciones aisladas (tabla 1), demostró que estos extractos son ricos en compuestos fenólicos, con una menor presencia de compuestos terpenoides.
El CFT determinado (R2 = 0,994; y = 0,004x + 0,136) fue significativamente diferente entre el extracto y las fracciones (tabla 2). El CFT en todas las fracciones fue más alto comparado con el extracto crudo.

En la figura 1 se muestra el estado estacionario de la reacción entre el DPPH y las diferentes fracciones, el cual fue en todos los casos menor que 5 min. En este estudio preliminar tanto el extracto crudo como las fracciones presentaron buena actividad antirradical.
En la tabla 2 se observa que el potencial antioxidante de las fracciones fue considerablemente más alto que el extracto crudo. Por otro lado, la EC50 estuvo en el intervalo de 4,7 a 87,1 mg extracto/µmol DPPH (tabla 3). Lo anterior sugiere que la fracción 1 puede contener los compuestos con mayor capacidad antioxidante.
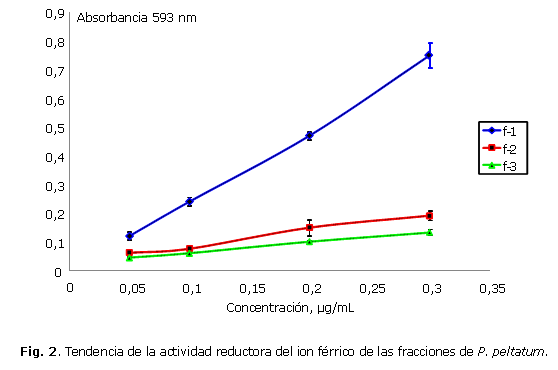
En la figura 2 se presenta la actividad de las muestras de las hojas de P. peltatum sobre el reactivo de FRAP. Se observa que la absorbancia para las fracciones 1, 2 y 3 aumentó por causa de la formación del complejo Fe2+-TPTZ con el incremento de la concentración de los extractos. De la misma manera como sucedió con el ensayo de DPPH, la fracción 1 presentó la actividad reductora más promisoria.
Los extractos mostraron una buena correlación entre el contenido de fenoles y su capacidad antioxidante. En la figura 3 se observa que los coeficientes de correlación entre el CFT y los valores para el ensayo FRAP (R2= 0,9899; y= 1,485X 12,94) y de la actividad de atrapamiento del radical DPPH (R2= 0,8994, y= - 0,608X + 88,86), fueron muy buenos (R2> 0,89).
DISCUSIÓN
Los datos presentados en este estudio demostraron que todas las muestras evaluadas poseen propiedades antioxidantes, lo cual soporta el uso tradicional de P. peltatum para el tratamiento de diferentes afecciones de la piel y otras enfermedades. Estos extractos con carácter lipofílico pueden ser considerados como potenciales fuentes de sustancias antioxidantes; resulta muy promisoria la fracción 1, cuya capacidad antioxidante fue incluso mejor que la de las sustancias de referencia y del extracto crudo. Esto es muy usual para los extractos crudos, porque los compuestos activos presentes en este pueden ser atenuados por otros componentes de la mezcla. Efecto sinérgico similar ha sido reportado por Puertas y otros21 a partir de una fracción aislada del aceite esencial de orégano y los compuestos antioxidantes naturales timol y carvacrol (la actividad aumentó en 82,7 % en una mezcla 1:1). Por lo tanto, para obtener una buena capacidad antioxidante, los constituyentes activos de un extracto natural deberían ser más eficientes que los compuestos de referencia o ejercer su actividad de modo sinérgico.
De acuerdo con nuestro conocimiento, este es el primer reporte de actividad antioxidante encontrado en un extracto no alcohólico de las hojas de P. peltatum, lo cual permite asumir que el principal componente, el 4-nerolidilcatecol, que ha presentado diversas propiedades biológicas y antioxidantes,22-25 ha sido aislado de esta y otras especies de Piper, ejemplo, P. umbellata; podría estar presente en el extracto crudo (hexano-acetato de etilo) por causa de su dualidad en la polaridad.
De hecho, mientras que el extracto metanólico reportado por Desmarchelier y otros26 está caracterizado por la presencia de compuestos polares con una actividad antioxidante relativamente buena, el extracto no alcohólico reportado en este estudio contendría mezcla de compuestos polares y poco polares en una muy alta concentración, como los neolignanos, que han sido aislados de las hojas de P. regnellii.27 En cualquier caso, su presencia en las fracciones aisladas, así como su papel en la capacidad antioxidante es solo una hipótesis. Con respecto a la especie en estudio, P. peltatum, a partir de su aceite esencial se han aislado e identificado sesquiterpenos y peltatoles.28 Por tanto, al ser compuestos poco polares es posible asumir su presencia en los extractos bajo estudio y su papel en la actividad antioxidante. En resumen, este trabajo demuestra que los ensayos de DPPH y FRAP, pueden ser usados como una primera aproximación en la búsqueda de compuestos antioxidantes a partir de productos naturales.
De otro lado, el análisis de regresión lineal indicó que las correlaciones entre la actividad antioxidante basadas en los ensayos de DPPH, FRAP y el CFT fueron significativamente muy altas (0,89 0,98). Un resultado similar fue descrito por Thaipong y otros29 que reportaron una buena correlación entre el contenido de fenoles y los métodos evaluados en un extracto metanólico. Adicionalmente, Nsimba y otros30 demostraron una fuerte actividad reductora (FRAP) de los extractos en butanol y acetato de etilo de la especie C. quinoa. Los autores sugirieron que ambos extractos podían contener altas concentraciones de compuestos activos con la capacidad de reducir iones metálicos, estos últimos actuando como catalizadores en las reacciones oxidativas. En conclusión, las fracciones bajo estudio mostraron, en general, una buena capacidad antioxidante y podrían ser fuentes potenciales de fitonutrientes con propiedades antioxidantes. Adicionalmente, los resultados dan un soporte acorde con el uso de la P. peltatum en la medicina tradicional de Colombia y las regiones subtropicales de América del Sur; y a su vez permitirá proponerla como una fuente natural con un alto uso potencial en la industria farmacéutica y de alimentos. Por último, es necesario llevar a cabo una investigación más detallada de los componentes fenólicos individuales presentes en los extractos de las hojas de P. peltatum responsables de su actividad antioxidante.
AGRADECIMIENTOS
Este trabajo fue desarrollado en el Laboratorio de Química de Plantas Colombianas de la Universidad de Antioquia (Proyecto: Sostenibilidad CODI 2008). Todos los experimentos fueron realizados bajo las normas y leyes colombianas.
REFERENCIAS BIBLIOGRÁFICAS
1. García H. Flora medicinal de Colombia: Botánica médica. 2da edi. Bogotá: Tercer Mundo Editores; 1992. p. 222.
2. Desmarchelier C, Slowing UK, Ciccia G. Anti-inflammatory activity of Pothomorphe peltata leaf methanol extract. Fitoterapia. 2000;71:556-8.
3. Lee SE, Park BS, Kim MK, Choi WS, Kim HT, Cho KY, et al. Fungicidal activity of pipernonaline, a piperidine alkaloid derived from long pepper, Piper longum L., against phytopathogenic fungi. Crop Protection. 2001;20:523-8.
4. Park BS, Son DJ, Park YH, Kim TW, Lee SE. Antiplatelet effects of acidamides isolated from the fruits of Piper longum L. Phytomedicine. 2007;14:853-5.
5. Kaou AM, Mahiou-Leddet V, Hutter S, Aïnouddine S, Hassani S, Yahaya I, et al. Antimalarial activity of crude extracts from nine African medicinal plants. J Ethnopharmacol. 2008;116:74-83.
6. De Feo V. Uso di piante ad azione antiinfiammatoria nell'Alto Ucayali, Perú Orientale. Fitoterapia. 1991;62:481-94.
7. Duke JA, Vásquez R. Amazonian Ethnobotanical Dictionary. Boca Ratón, USA: CRC Press; 1994. p. 138.
8. Desmarchelier C, Gurni A, Ciccia G, Giulietti AM. Ritual and medicinal plants of the Ese'ejas of the Amazonian rainforest (Madre de Dios, Perú). J Ethnopharmacol. 1996;52:45-51.
9. Otero R, Nuñez V, Jiménez S, Fonnegra R, Osorio RG, García ME, et al. Snakebites and ethnobotany in the northwest region of Colombia. Part III: Neutralization of the haemorrhagic effect of Bothrops atrox venom. J Ethnopharmacol. 2000;73:233-41.
10. Felipe DF, Dias Filho BP, Nakamura CV, Franco SL, Garcia Cortez DA. Analysis of neolignans compounds of Piper regnellii (Miq.) C. DC. var. pallescens (C. DC.) Yunck by HPLC. J Pharm Biomed Anal. 2006;41:1371-5.
11. Tabopda TK, Ngoupayo J, Liu J, Mitaine-Offer A-C, Tanoli SA, Khan SN, et al. Bioactive aristolactams from Piper umbellatum. Phytochemistry. 2008;69:1726-31.
12. Valdivia C, Marquez N, Eriksson J, Vilaseca A, Muñoz E, et al. Bioactive alkenylphenols from Piper obliquum. Bioorg Med Chem. 2008;16:4120-6.
13. Huang D, Ou B, Prior RL. The chemistry behind antioxidant capacity assays. J Agric Food Chem. 2005;53:1841-56.
14. Baydar NG, Özkan G, Yasar S. Evaluation of the antiradical and antioxidant potential of grape extracts. Food Control. 2007;18:1131-6.
15. Liu D, Shi J, Ibarra AC, Kakuda Y, Xue SJ. The scavenging capacity and synergistic effects of lycopene, vitamin E, vitamin C, and â-carotene mixtures on the DPPH free radical. LWT - Food Sci Technol. 2008;41:1344-9.
16. Burton GW, Ingold KU. Autoxidation of biological molecules. 1. The antioxidant activity of vitamin E and related chain-breaking phenolic antioxidants in Vitro. J Am Chem Soc. 1981;103:6472-7.
17. Douhou N, Yamni K, Tahrouch S, Idrissi Hassani M, Badoc A, Gmira N. Screening phytochimique d'une endémique Ibéro-Marocaine, Thymelaea Lythroides. Bull Soc Pharm Bordeaux. 2003;142:61-78.
18. Nurmi K, Ossipov V, Haukioja E, Pihlaja K. Variation of total phenolic content and individual low-molecular-weight phenolics in foliage of mountain birch trees (Betula pubescens ssp. tortuosa). J Chem Ecol. 1996;22:2023-40.
19. Puertas-Mejía M, Mesa AMV, Sáez JA. In vitro radical scavenging activity of two columbian magnoliaceae. Naturwissenschaften. 2005;92:381-4.
20. Benzie IFF, Strain JJ. The ferric reducing ability of plasma (FRAP) as a measure of ``antioxidant power'': the FRAP assay. J Anal Biochem. 1996;239:70-6.
21. Puertas MA, Hillebrand S, Stashenko E, Winterhalter P. In vitro radical scavenging activity of essential oils from columbian plants and fractions from oregano (Origanum vulgare L.) essential oil. Flavour Fragr J. 2002;17:380-4.
22. Gustafson KR, Cardellina JH, Mcmahon JB, Pannell LK, Cragg GM, Boyd MR. The peltatols, novel HIV-inhibitory catechol derivatives from Pothomorphe peltata. J Org Chem. 1992;57:2809-11.
23. Mongelli E, Coussio J, Ciccia G. Investigation of the larvicidal activity of Pothomorphe peltata and isolation of the active constituent. Phytother Res. 2002;16:71-2.
24. Ropke CD, Meirelles RR, da Silva VV, Sawada TC, Barros SB. Pothomorphe umbellata extract prevents alpha-tocopherol depletion after UV-irradiation. Photochem Photobiol. 2003;78:436-9.
25. Pinto ACS, Pessoa C, Lotufo LVC, Moraes MOM, Moraes ME, Cavalcanti BC, et al. In vitro cytotoxicity of Pothomorphe peltata (L.) Miquel (Piperaceae), isolated 4- nerolidylcatechol and its semi-sythetic diacetyl derivative. Rev Bras Pl Med Botucatu. 2006:8:205-11.
26. Desmarchelier C, Barros S, Repetto M, Latorre LR, Kato M, Coussio J, et al. 4-Nerolidylcatechol from Pothomorphe spp. scavenges peroxyl radicals and inhibits Fe(II)-dependent DNA damage. Planta Medica. 1997;63:561-3.
27. Koroishi AM, Foss S, Cortez D, Ueda-Nakamura T, Nakamura CV, Dias Filho BP. In vitro antifungal activity of extracts and neolignans from Piper regnellii against dermatophytes. J Ethnopharmacol. 2008;117:270-7.
28. Moraes MS, Machado SR, Marques MOM. Essential oil of the Pothomorphe peltata (L.) Miq. J Essent Oil Res. 2004;16:15-6.
29. Thaipong K, Boonprakob U, Crosby K, Cisneros-Zevallos L, Byrne DH. Comparison of ABTS, DPPH, FRAP, and ORAC assays for estimating antioxidant activity from guava fruit extracts. J Food Compos Anal. 2006;19:669-75.
30. Nsimba RY, Kikuzaki H, Konishi Y. Antioxidant activity of various extracts and fractions of Chenopodium quinoa and Amaranthus spp. Seeds. Food Chem. 2008;106:760-6.
Recibido: 17 de febrero de 2009.
Aprobado: 10 de marzo de 2009.
Dr. Miguel A. Puertas-Mejía. Instituto de Química, Facultad de Ciencias Exactas y Naturales, Universidad de Antioquia, A.A. 1226, Medellín, Colombia. Teléf.: +57(4) 219 5653; Fax: +57(4) 233 0120. Correo electrónico: mpuertas@exactas.udea.edu.co














